骨靶向外泌体纳米颗粒诱导骨肉瘤细胞铁死亡
近年来,开发BMSCs来源外泌体(EXO)治疗骨肉瘤(OS)是一种安全且有前景的骨肉瘤治疗方式,它可以在体内有效地将药物输送到肿瘤细胞中。然而,所携带药物的差异以及EXO与其他器官的结合限制了它们的治疗效果。因此,提高BMSCs EXO靶向OS的能力,开发新药,对OS靶向治疗的临床应用至关重要。在这项研究中,我们利用骨靶向肽SDSSD修饰BMSCs EXO,并在外壳内封装卷曲霉素(CAP),构建了一个潜在的治疗纳米平台。这些构建的纳米颗粒(NPs)显示出同源靶向能力,骨靶向外泌体(BT-EXO)显著促进体外细胞内吞作用和体内肿瘤积累。此外,构建的NPs通过促进活性氧(ROS)的过度积累、Fe2+聚集和脂质过氧化诱导OS细胞铁死亡,并进一步确定了铁死亡的潜在抗癌分子机制,该机制通过Keap1/Nrf2/GPX4信号通路转导。此外,这些构建的NP导向的铁死亡在体内表现出明显的肿瘤生长抑制作用,没有明显的副作用。这些结果表明,这些构建的NPs在小鼠骨肉瘤模型中具有良好的体外和体内抗癌活性,为骨肉瘤以铁死亡为基础的化疗与靶向治疗相结合提供了一种新的、有前景的策略。本文于2023年9月发表于“Journal of Nanobiotechnology”(IF=10.2)上。
技术路线

结果
1)BT-EXOs-CAP的生成与表征
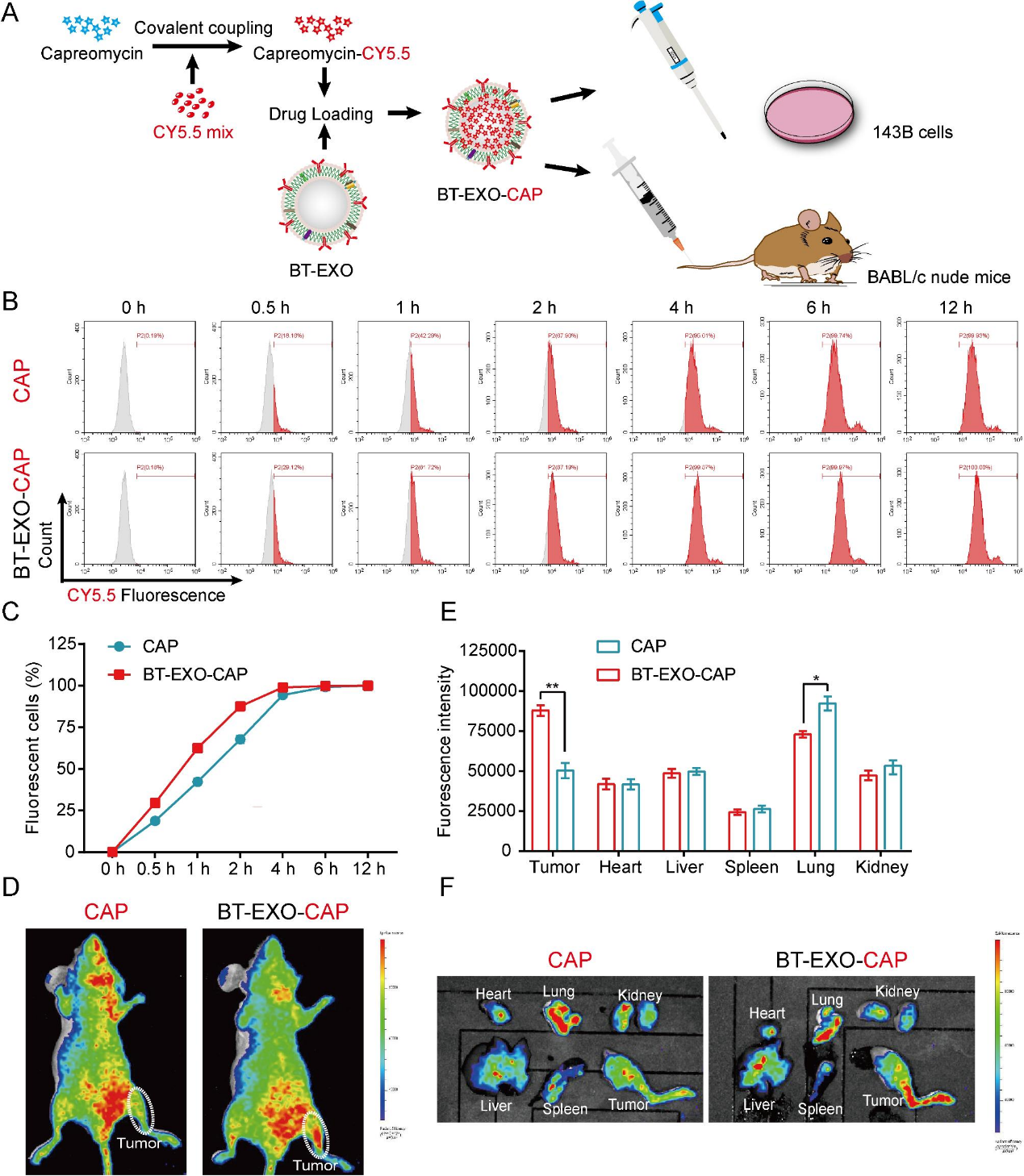
我们使用超离心技术从BMSCs培养基中分离出EXO,在EXO上标记骨靶向肽(SDSSD),然后使用超高速振荡促进CAP进入BT-EXO(图1A-1B)。通过TEM和大小分布分析对EXO、BT-EXO和BT-EXO-CAP进行表征(图1C-1D)。WB结果显示,EXO、BT-EXO和BT-EXO-CAP均表达EXO特异性抗原TSG101和CD9/63/81,而内质网特异性抗原calnexin表达缺失,β-actin表达低(图1E)。在-80℃下保存8周后,BT-EXO的平均粒径保持在100 nm, BT-EXO-CAP的平均粒径保持在110 nm(图1F)。本研究考虑OS的弱酸性微环境,考察了pH 7.4和pH 4.5时BT-EXO-CAP的药物释放动力学,发现在弱酸性条件下,BT-EXO-CAP的药物释放速度明显加快(图1G)。

2)BT-EXOs的加载促进了CAP向OS的靶向
为了实现CAP的药物追踪,我们使用CY5.5荧光标记CAP,然后将其加载到BT-EXO中(图2A)。在体外,BT-EXO加载加速了CAP-CY5.5进入OS细胞(图2B-2C)。在体内,BT-EXO负载有助于CAP-CY5.5靶OS,并减少CAP-CY5.5在肺部的积累(图2D-2F)。
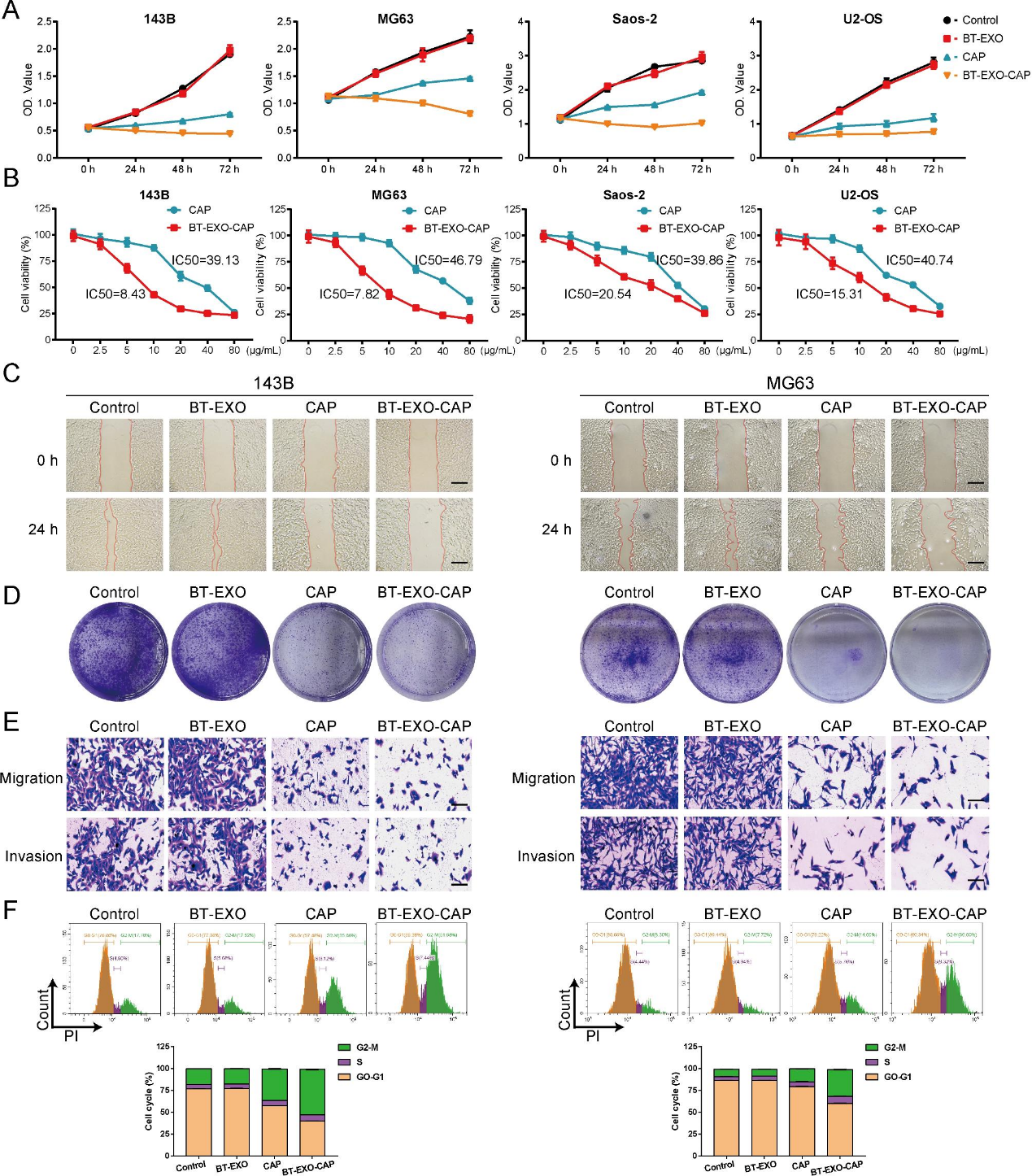
3)BT-EXO-CAP体外抗OS作用
我们比较了BT-EXO、CAP和BT-EXO-CAP对4种OS细胞系药物孵育72 h后存活率的影响,发现BT-EXO-CAP显著抑制OS细胞的存活(图3A)。同时,我们比较了CAP和BT-EXO-CAP的一半最大抑制浓度,发现BT-EXO-CAP的IC50明显低于CAP(图3B)。BT-EXO-CAP抑制人OS细胞的增殖、集落形成和侵袭(图3C-3E)。流式细胞术还发现BT-EXO-CAP诱导G2/M期细胞周期阻滞(图3F)。
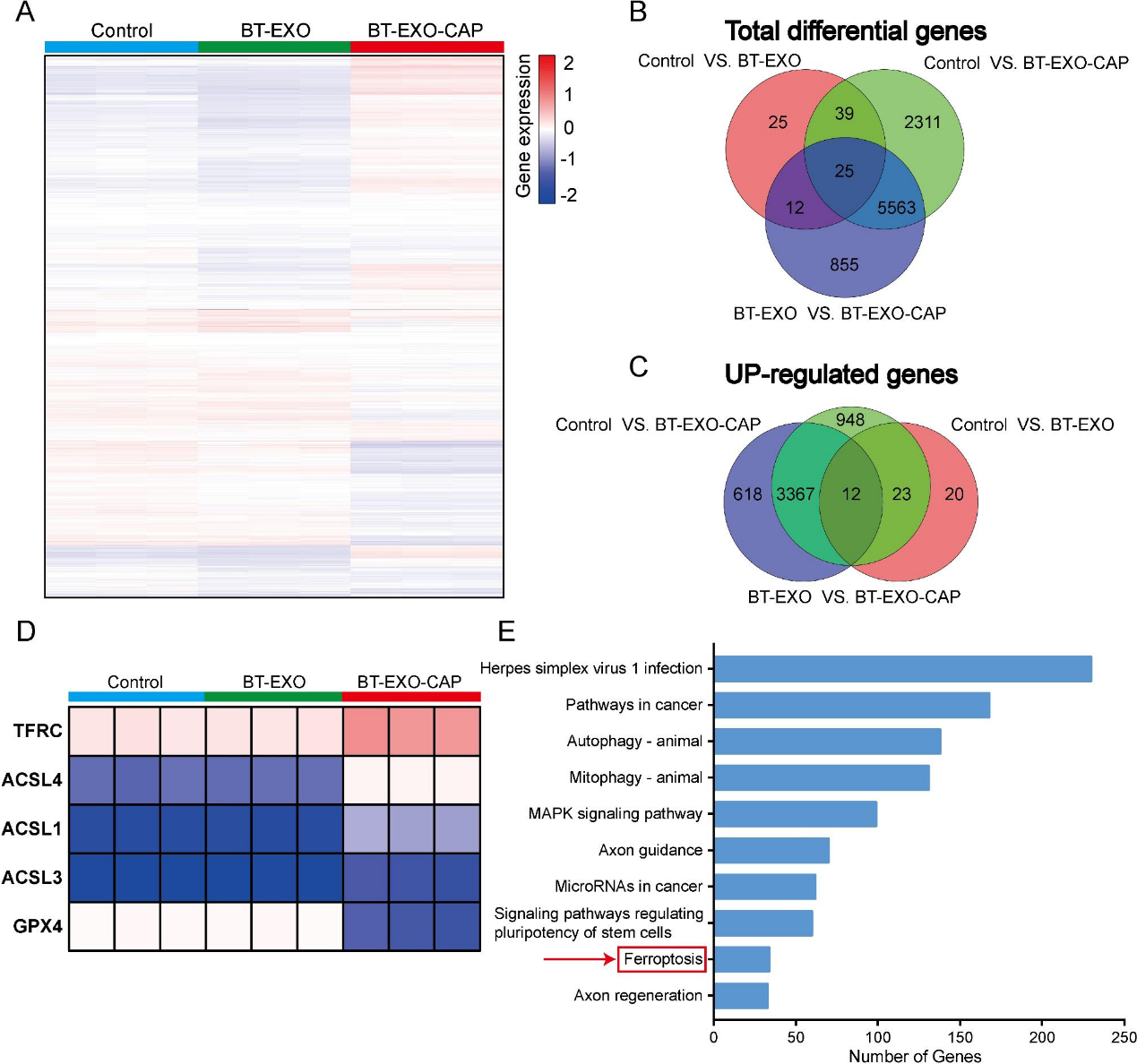
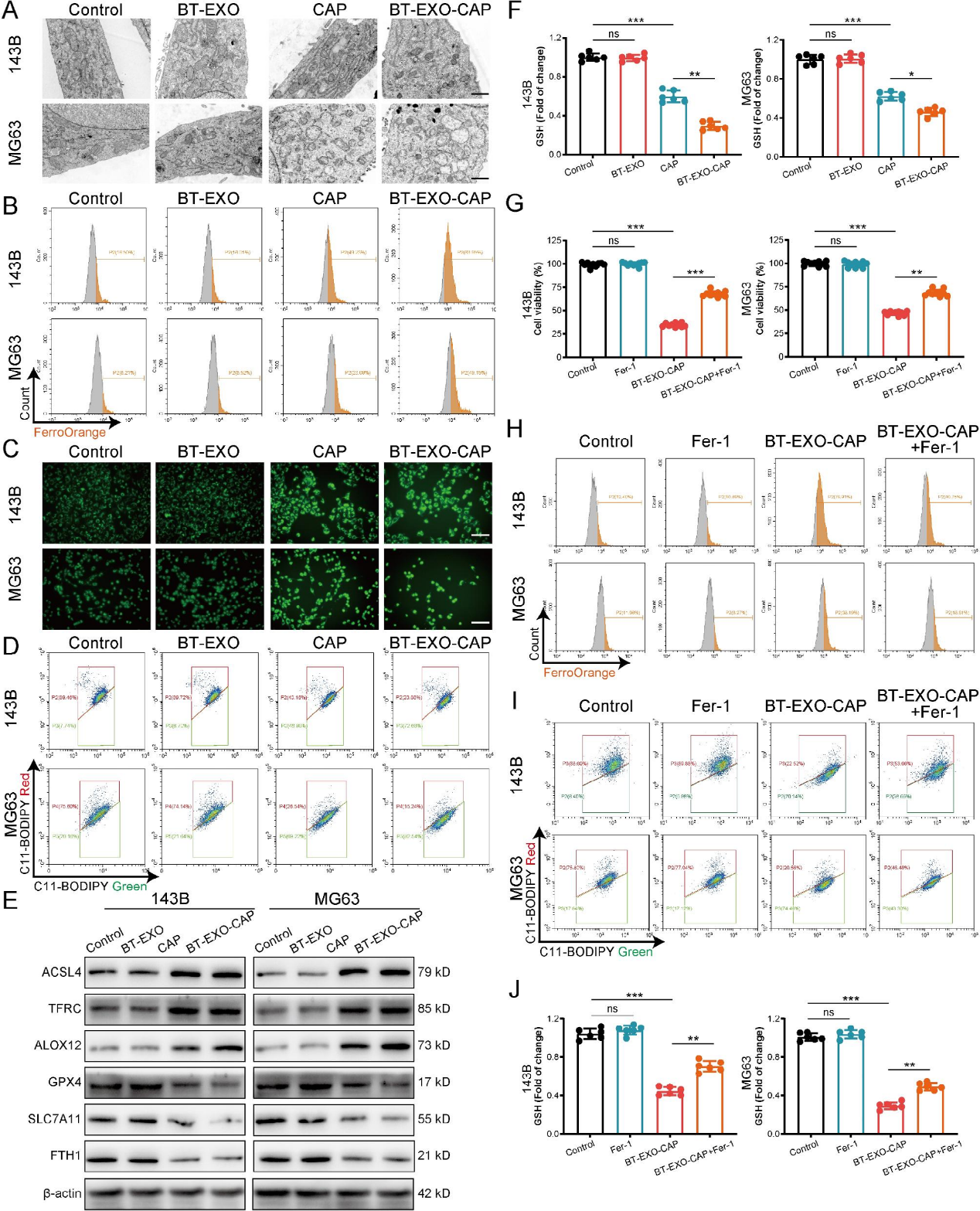
4)BT-EXO-CAP诱导OS细胞铁死亡
RNA-Seq分析表明可能与线粒体自噬有关(图4A-4E),透射电镜下BT-EXO-CAP处理后,线粒体变小,双膜密度增加,线粒体脊消失,外膜破裂(图5A)。BT-EXO-CAP诱导细胞内Fe2 +浓度升高和ROS积累(图5B-5C),促进细胞膜脂质过氧化(图5D)。WB结果显示,BT-EXO-CAP过表达ACSL4、TFRC和ALOX4,抑制GPX4、SLC7A11和FTH1(图5E)。BT-EXO-CAP降低OS细胞GSH浓度(图5F)。这些结果表明,BT-EXO-CAP促进OS的铁死亡。铁死亡激动剂(fer1)逆转了BT-EXO-CAP对OS的生存抑制(图5G),降低了细胞内Fe2 +浓度(图5H),阻止了细胞膜脂质过氧化(图5I)并增加了GSH浓度(图5J)。
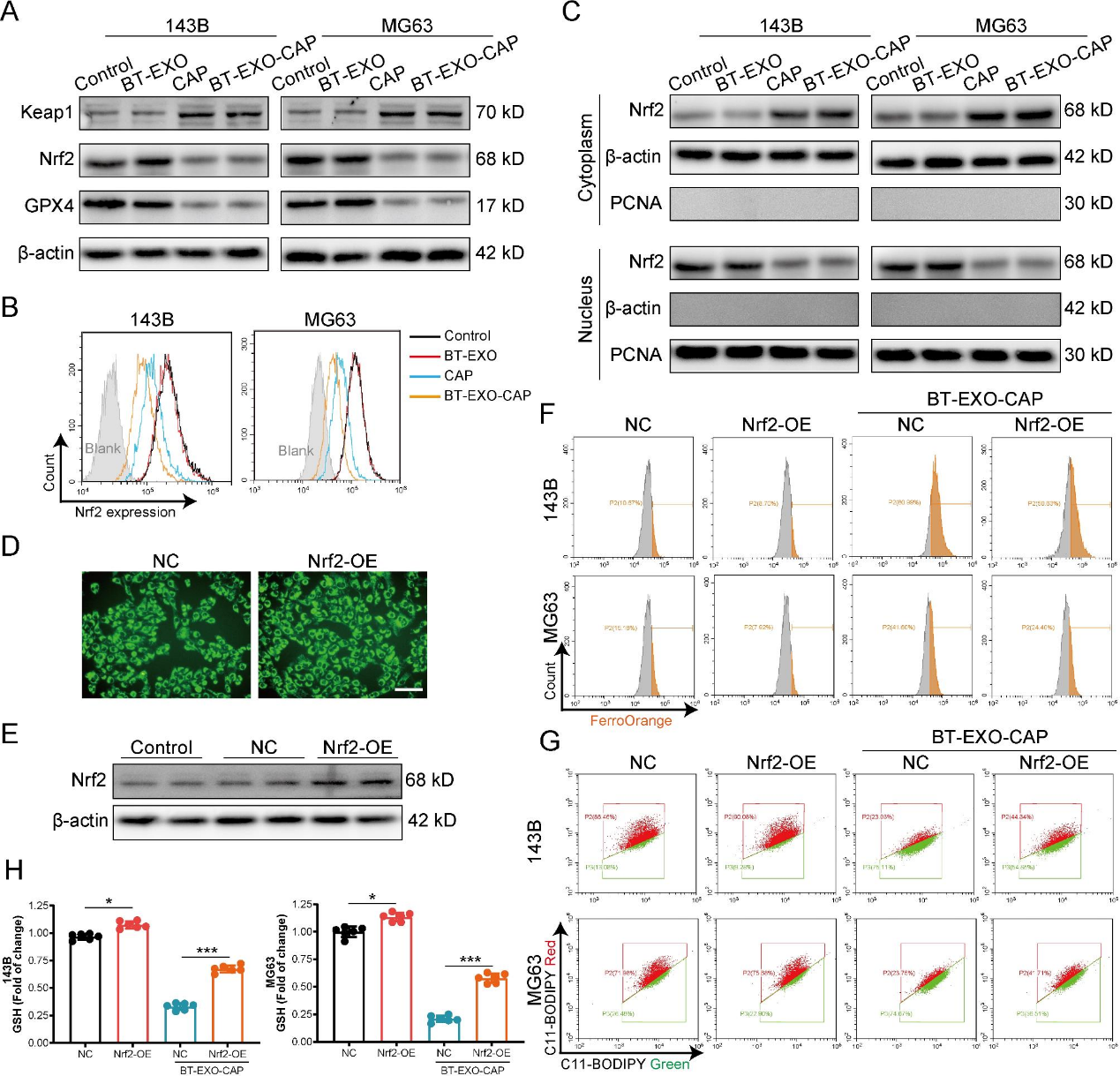
5)BT-EXO-CAP激活Keap1/Nrf2/GPX4信号通路导致OS细胞铁死亡
Nrf2是调控GPX4表达的重要上游转录因子。BT-EXO-CAP上调Nrf2拮抗剂Keap1的表达,下调Nrf2和GPX4的表达(图6A-6B)。此外,发现BT-EXO-CAP抑制Nrf2从细胞质进入细胞核(图6C)。我们利用慢病毒构建了Nrf2过表达的143B细胞系(图6D-6E),发现Nrf2过表达有效地逆转了BT-EXO-CAP诱导的Fe2 +聚集(图6F)、脂质过氧化(图6G)和GSH减少(图6H)。
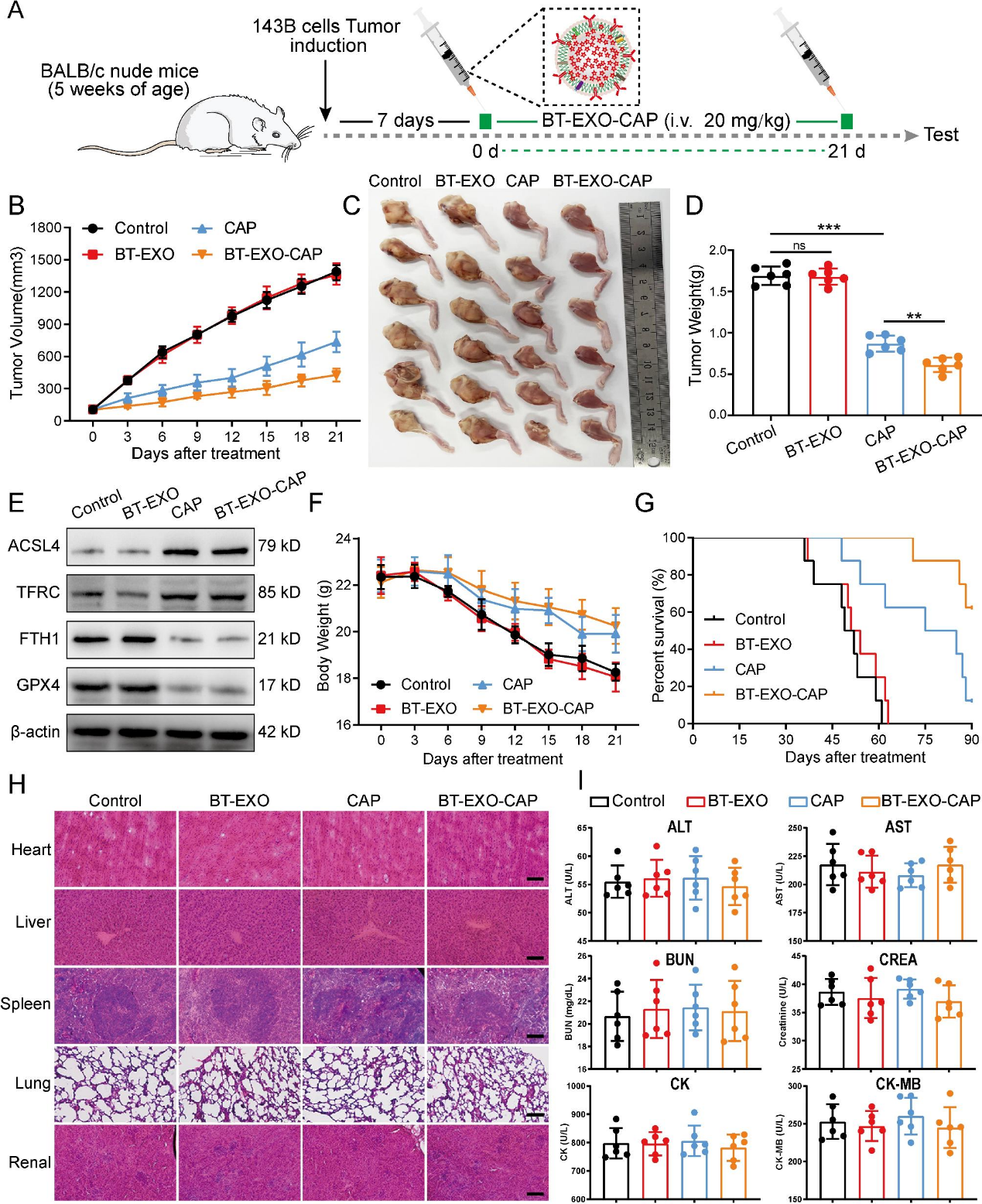
6)BT-EXO-CAP抗OS的体内疗效
本研究从5周龄裸鼠143B肿瘤细胞植入7天后开始,连续给药BT-EXO-CAP 21天(图7A)。结果显示,BT-EXO-CAP对OS生长的抑制作用明显高于CAP(图7B-7D)。BT-EXO-CAP和CAP处理组表现出FTH1和GPX4抑制,ASCL4和TFRC过表达,提示促进铁死亡(图7E)。与对照组相比,给予BT-EXO-CAP和CAP的小鼠表现出显著的体重减轻(图7F),并表现出延长的生存时间。BT-EXO-CAP组的存活率最高(图7G)。HE染色结果显示,BT-EXO-CAP治疗后器官组织未见明显病理改变。此外,ALT、AST、BUN、CREA、CK和CK-MB的表达水平与对照组相比无显著差异(图7H-7I)。因此,BT-EXO-CAP和CAP没有表现出明显的毒性水平。
结论
我们成功构建了一个新兴的纳米颗粒,通过用骨靶向肽修饰BMSCs来源的EXO来获得OS靶向能力。该纳米颗粒可实现体内OS呈现,抑制肿瘤生长,提高生存率,无明显副作用。该纳米颗粒激活Keap1/Nrf2/GPX4信号通路可诱导OS中的铁死亡。
实验方法
骨靶向外泌体纳米颗粒构建,药物释放试验,流式,细胞毒性试验,集落形成,伤口愈合试验,Transwell,RNA测序,ROS测量,WB,Nrf2过表达慢病毒转染,动物实验,细胞毒性评价。
参考文献
Chen W, Li Z, Yu N, Zhang L, Li H, Chen Y, Gong F, Lin W, He X, Wang S, Wu Y, Ji G. Bone-targeting exosome nanoparticles activate Keap1 / Nrf2 / GPX4 signaling pathway to induce ferroptosis in osteosarcoma cells. J Nanobiotechnology. 2023 Sep 30;21(1):355. doi: 10.1186/s12951-023-02129-1.