IGF2BP3促进鼻咽癌肿瘤转移
转移仍然是鼻咽癌(NPC)患者治疗失败的主要原因,其中Notch信号的持续激活起着关键作用。m6A介导的转录后调控参与Notch信号输出的微调;然而,鼻咽癌转移的转录后机制仍然知之甚少。在本研究中,我们报道了IGF2BP3在鼻咽癌中是一个关键的m6A阅读器。IGF2BP3在转移性鼻咽癌中表达显著上调,并与鼻咽癌患者预后不良相关。IGF2BP3过表达促进了,而IGF2BP3下调抑制了鼻咽癌细胞的肿瘤转移和鼻咽癌细胞的干性表型。机制上,IGF2BP3以m6A依赖的方式通过抑制CCR4-NOT复合物介导的去腺苷酸化来维持NOTCH3 mRNA的稳定性,从而维持NOTCH3信号的激活并增加干性相关下游基因的转录,最终促进肿瘤转移。我们的研究结果强调了IGF2BP3/Notch3轴的促转移功能,并揭示了IGF2BP3在Notch3转录后调控中的确切作用,提示IGF2BP3是一种新的预后生物标志物和潜在的鼻咽癌转移治疗靶点。本文于2023年10月发表于Oncogene(IF=8)上。
技术路线
结果
1)IGF2BP3在鼻咽癌中表达上调,与转移和不良预后相关
我们探索了NPC中关键的m6A阅读器。对13例鼻咽癌和5例正常鼻咽上皮样本进行RNA测序分析。针对这些m6A阅读器,IGF2BP3 mRNA水平在NPC中显著上调(图1A)。值得注意的是,我们额外收集了13个冷冻组织检测IGF2BP3 mRNA和蛋白水平,与正常组织相比,IGF2BP3在NPC组织中的表达水平明显升高。特别是在转移性鼻咽癌组织中(图1B)。在183个石蜡包埋的鼻咽癌标本中,使用免疫组织化学(IHC)评估IGF2BP3表达的临床意义(图1C)。183例NPC患者中IGF2BP3高表达104例。相关分析显示,IGF2BP3高表达与鼻咽癌远处转移显著相关(图1D)。Kaplan-Meier生存曲线显示,IGF2BP3高表达与鼻咽癌患者较短的总生存期(OS)和远端无转移生存期(DMFS)相关(图1 E)。多因素Cox回归分析显示,IGF2BP3表达水平被确定为鼻咽癌患者OS和DMFS的独立预后因素(图1F)。总的来说,这些发现表明IGF2BP3上调与鼻咽癌转移相关。

2)IGF2BP3调节鼻咽癌的肿瘤转移
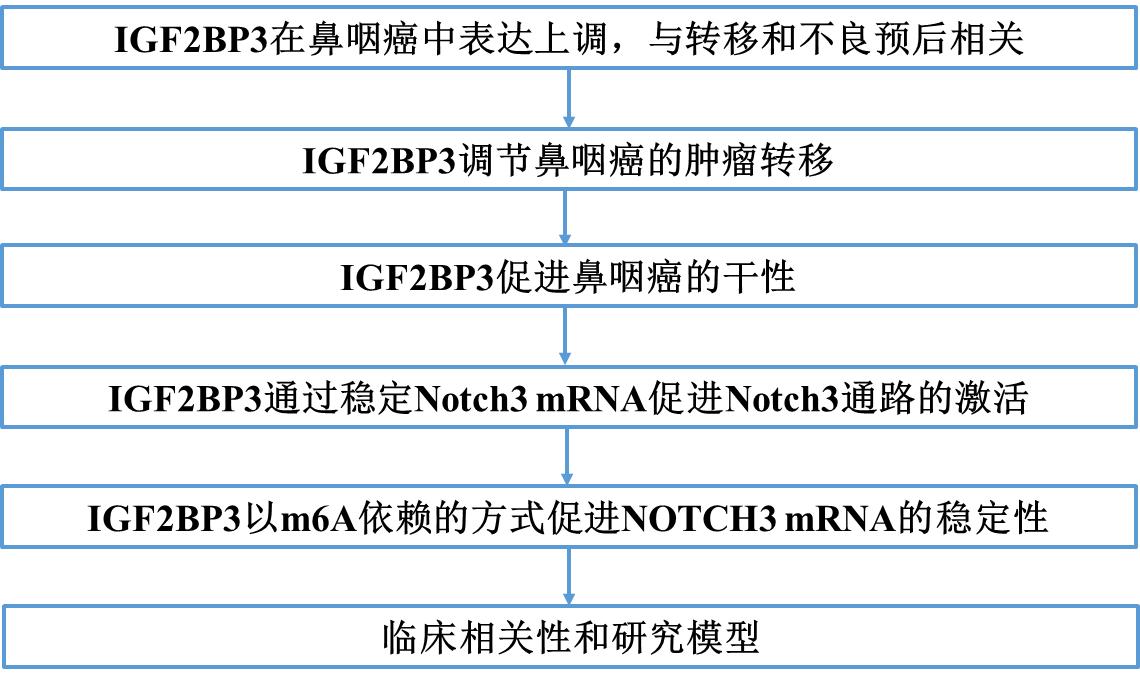
在肿瘤转移过程中,大量癌细胞从原发肿瘤扩散,但只有一小部分DTC通过浸润远端器官存活。为了探索IGF2BP3是否影响这一低效率过程,我们选择了IGF2BP3表达水平中等的HONE1和SUNE1细胞系,过表达或敲低IGF2BP3(图2A)。引人注意的是,IGF2BP3的上调显著促进了鼻咽癌细胞的体外非锚定生长,而IGF2BP3的沉默抑制了鼻咽癌细胞的体外非锚定生长(图2B, 2C)。此外,我们构建了裸鼠肺转移异种移植模型。将指定的荧光素酶表达细胞(SUNE1-Vector、SUNE1-IGF2BP3、SUNE1-Scramble、SUNE1-shIGF2BP3#1、SUNE1-shIGF2BP3#2)静脉注射到裸鼠尾静脉。与对照组相比,IGF2BP3过表达显著增强,而IGF2BP3沉默使肺内生物发光强度降低(图2D、2E)。注射后6周切除肺后,IGF2BP3过表达组小鼠肺表面肿瘤淋巴结比对照组多。相比之下,IGF2BP3沉默显著减少了肺内弥散性肿瘤结节的数量(图2F, 2G)。此外,Ki67染色证实IGF2BP3过表达组小鼠的肿瘤具有更好的增殖潜力(图2F–2H)。提示IGF2BP3促进鼻咽癌远处转移。
3)IGF2BP3促进鼻咽癌的干性
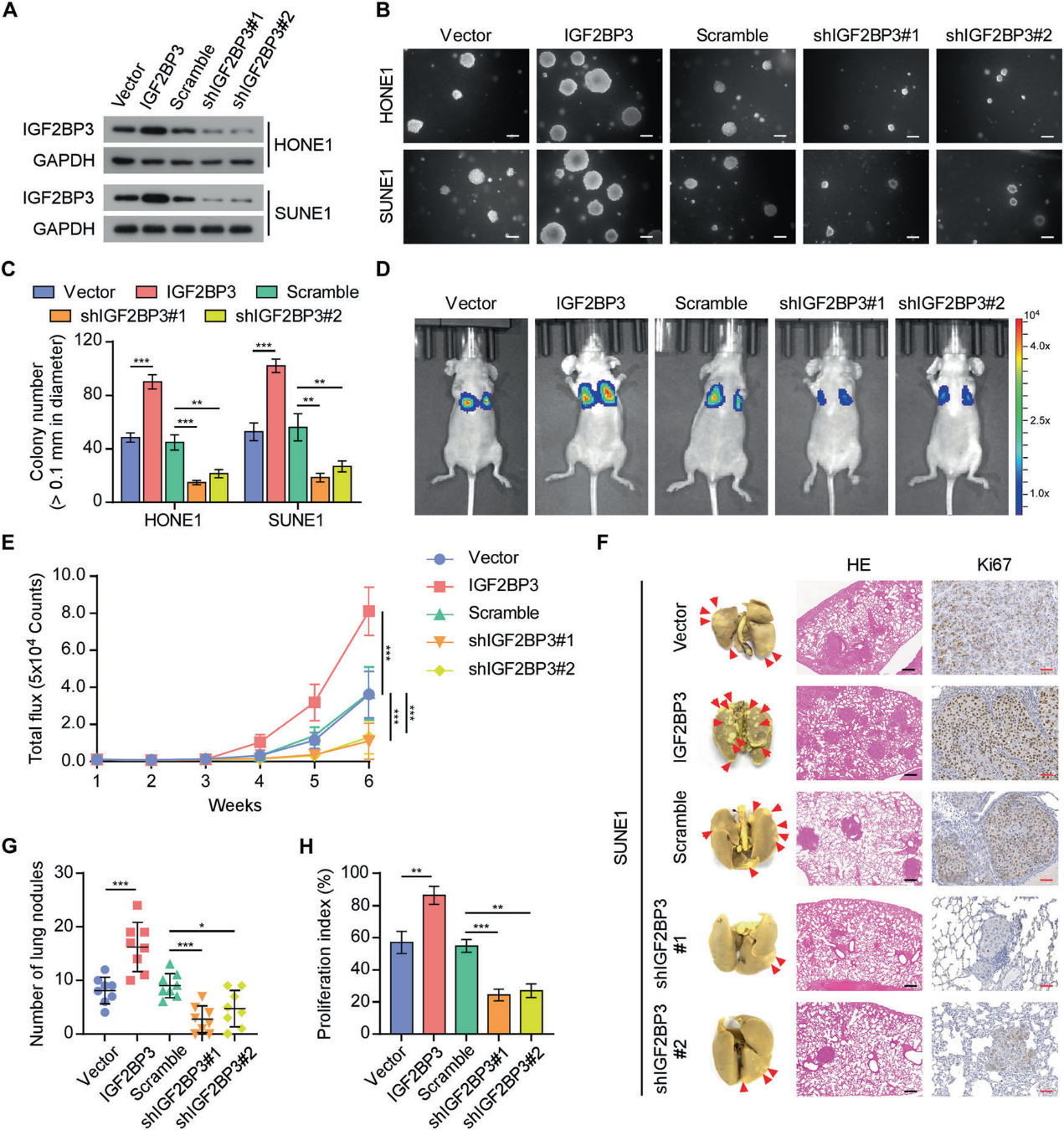
DTC的生存和肿瘤启动活性在转移性定植中起着重要作用。成球实验显示,IGF2BP3过表达后,与载体对照组相比,形成了更多更大的球体。与scramble组相比,IGF2BP3沉默导致的球体更少、更小(图3A)。此外,IGF2BP3过表达组的侧群(SP)细胞比例增加,而IGF2BP3敲低组的侧群(SP)细胞比例减少(图3B)。同样,IGF2BP3过表达显著增加了细胞干性标志物NANOG、OCT4和CD44的水平,但在IGF2BP3沉默的细胞中却降低了(图3C)。IGF2BP3的上调导致肿瘤发生率显著升高和异种移植物生长加快。相反,IGF2BP3沉默的细胞表现出较低的肿瘤发生率和较慢的异种移植物生长(图3D-3F)。IGF2BP3过表达会增加肿瘤起始细胞(TIC)频率,而IGF2BP3沉默则会产生相反的效果(图E)。这些结果表明,IGF2BP3在维持NPC肿瘤的干性中起着至关重要的作用。
4)IGF2BP3通过稳定Notch3 mRNA促进Notch3通路的激活
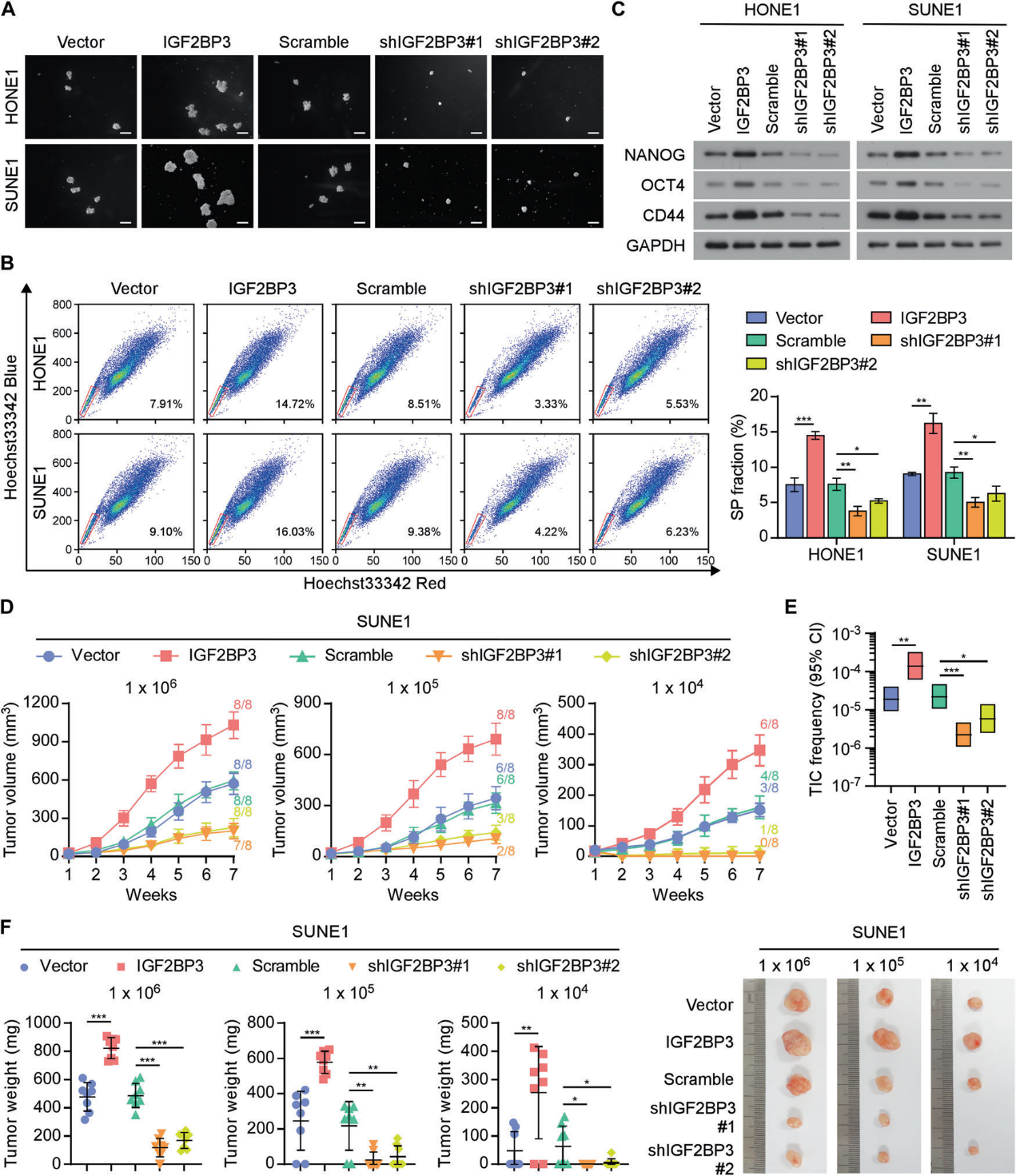
为了确定IGF2BP3影响CSC特性和鼻咽癌转移的分子机制,我们检测了几种经典的干细胞相关信号通路的活性,包括Hedgehog, Hippo, Notch, STAT3和Wnt/β-catenin通路。IGF2BP3在HONE1和SUNE1细胞中的过表达显著增加了Notch信号通路的转录活性,但没有引起其他信号通路的显著变化(图4A)。我们分析了RNA-seq数据,发现IGF2BP3和NOTCH3的mRNA水平之间存在显著的正相关,而其他Notch家族成员的mRNA水平之间没有显著的正相关(图4B)。TCGA HNSC数据集也证实了这种正相关(图4C)。此外,IGF2BP3的上调显著促进了NOTCH3的表达,而IGF2BP3的下调则大大降低了NOTCH3的mRNA和蛋白水平,而不影响NOTCH3的转录(图4D、4E)。与此一致的是,IGF2BP3过表达增加了Notch信号靶基因HES1和MYC的表达(图D)。荧光素酶报告基因检测显示,IGF2BP3过表达促进了,而IGF2BP3沉默显著削弱了HES1和MYC启动子的荧光素酶活性(图4E)。同样,IGF2BP3的异位表达可以有效促进,而IGF2BP3的下调会损害肿瘤中NOTCH3的mRNA水平和NOTCH3信号的激活(图4F)。接下来,我们研究了Dactinomycin处理不同时间NOTCH3 mRNA的稳定性。IGF2BP3的敲低显著降低,而IGF2BP3的过表达显著增加了NOTCH3 mRNA的稳定性和半衰期(图4G)。GSI治疗和沉默NOTCH3显著削弱了IGF2BP3介导的肿瘤启动能力(图4H, 4I)。抑制NOTCH3导致IGF2BP3诱导的鼻咽癌细胞转移显著减少(图4J)。这些结果表明,IGF2BP3稳定NOTCH3 mRNA,维持NOTCH3通路激活,促进鼻咽癌肿瘤转移。
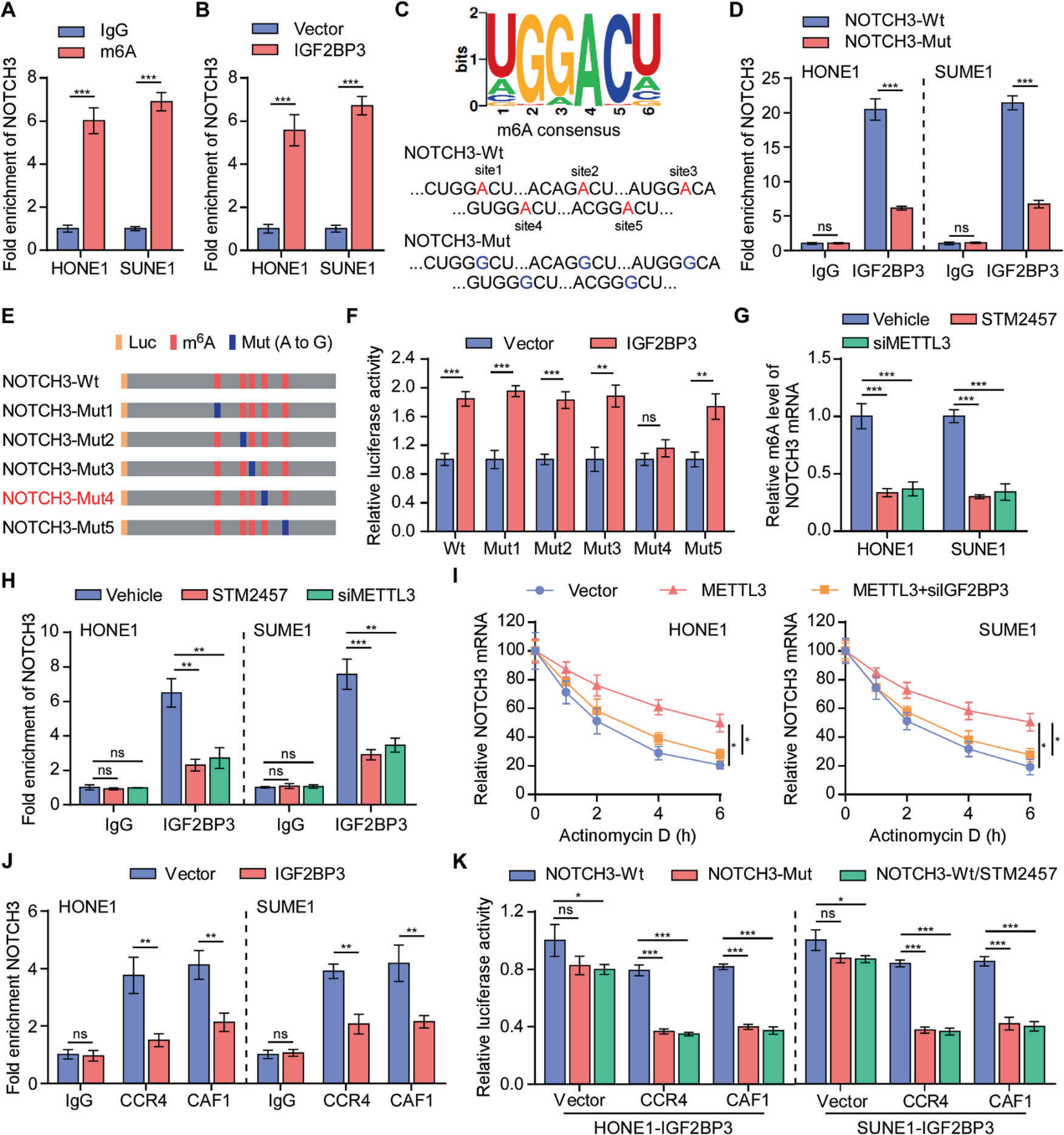
5)IGF2BP3以m6A依赖的方式促进NOTCH3 mRNA的稳定性
随后,我们发现NOTCH3 mRNA序列在鼻咽癌细胞中富集了m6A修饰(图5A)。在鼻咽癌细胞中进行的内源性RNA免疫沉淀(RIP)试验证实,IGF2BP3持续与NOTCH3转录本相互作用(图5B)。在线RNA修饰网站(SRAMP)预测了NOTCH3 CDS内的5个高置信度m6A位点。NOTCH3 mRNA与IGF2BP3之间的直接结合也被所有推测m6A位点的突变所破坏(图5C, 5D)。为了研究哪个m6A位点负责m6A介导的NOTCH3稳定,设计了5个NOTCH3突变体,并进行双荧光素酶报告基因检测(图5E)。IGF2BP3的过表达促进了除NOTCH3-mut4外所有NOTCH3突变体的荧光素酶表达,表明位点4 (' GUGGACU ')参与调节NOTCH3的稳定性(图5F)。我们发现使用METTL3的特异性siRNA或抑制剂降低了NOTCH3的m6A修饰,最终降低了NOTCH3在鼻咽癌细胞中的表达(图5G)。此外,RIP实验结果表明,METTL3的缺失显著抑制了IGF2BP3上NOTCH3的富集(图5H)。mRNA稳定性分析表明,即使NOTCH3具有高水平的m6A修饰,IGF2BP3的缺失也会显著降低NOTCH3 mRNA的半衰期(图5I)。总体而言,这些发现表明IGF2BP3以依赖于m6A的方式促进NOTCH3 mRNA的稳定性。
为了研究IGF2BP3介导的NOTCH3的增加是否与CCR4-NOT复合物介导的去腺苷酸化有关,我们进行了外源性RIP实验。结果表明,过表达IGF2BP3显著损害了NOTCH3与CCR4或CCR4相关因子1 (CAF1)之间的结合(图5J)。此外,在IGF2BP3过表达的细胞中,过表达CCR4和CAF1会略微加速NOTCH3-wt报告基因的去腺苷酸化,而这种加速在NOTCH3-mut报告基因中或通过添加METTL3特异性抑制剂而增强,这表明m6A修饰可以保护NOTCH3免受CCR4-NOT复合物介导的去腺苷酸化(图5K)。综上所述,这些结果表明IGF2BP3通过以m6A依赖的方式抑制CCR4-NOT复合物介导的去腺苷酸化,促进了NOTCH3 mRNA的稳定性。
6)临床相关性和研究模型
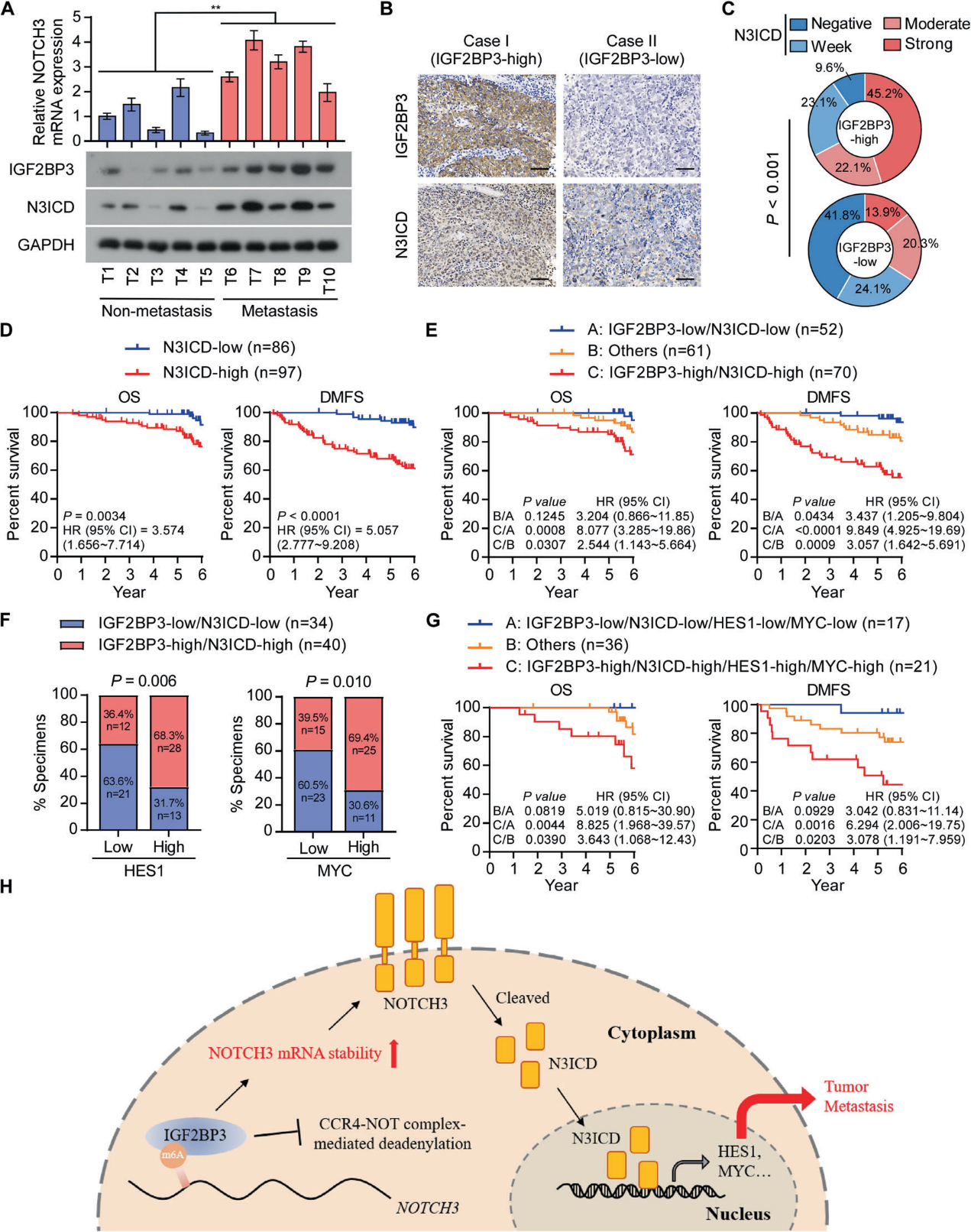
最后,我们研究了IGF2BP3/Notch3轴是否与鼻咽癌的临床相关。与未发生转移的鼻咽癌患者相比,来自转移性鼻咽癌患者的鼻咽癌原发肿瘤样本中IGF2BP3和N3ICD水平显著上调(图6A)。免疫组化染色和相关分析显示,临床样本中IGF2BP3与N3ICD水平呈正相关(图6B、6C)。高N3ICD水平与NPC患者较短的OS和DMFS相关(图6D)。重要的是,IGF2BP3和N3ICD水平较高的患者的OS和DMFS更差(图6E)。HES1和MYC的高mRNA水平与IGF2BP3和N3ICD的高共表达显著相关(图6F)。IGF2BP3和N3ICD高共表达并且HES1和MYC高mRNA水平的患者表现出更短的OS和DMFS(图6G),进一步表明IGF2BP3/Notch3轴确实与鼻咽癌的不良临床结局相关。
结论
我们的研究结果强调了IGF2BP3在鼻咽癌转移中的重要作用,并阐明了IGF2BP3介导的NOTCH3转录后调控的确切机制,确定了IGF2BP3是一种新的预后生物标志物和潜在的鼻咽癌转移治疗靶点。
实验方法
实时定量PCR,IHC,RIP,Western blotting,荧光素酶报告基因实验,异种移植肿瘤模型,RNA稳定性测定。
参考文献
Chen B, Huang R, Xia T, Wang C, Xiao X, Lu S, Chen X, Ouyang Y, Deng X, Miao J, Zhao C, Wang L. The m6A reader IGF2BP3 preserves NOTCH3 mRNA stability to sustain Notch3 signaling and promote tumor metastasis in nasopharyngeal carcinoma. Oncogene. 2023 Oct 18. doi: 10.1038/s41388-023-02865-6.






