FTO通过消除TNIP1的m6A甲基化,促进糖尿病诱导的血管内皮与炎症相关的功能障碍
内皮功能障碍是糖尿病血管并发症的关键和起始因素。炎症在表观遗传修饰调控的内皮功能障碍中起重要作用。N6-甲基腺苷(m6A)是真核细胞中最普遍的表观遗传修饰之一。在本研究中,作者鉴定了去m6A修饰酶,质量及肥胖相关蛋白(FTO),在糖尿病诱导的血管上皮细胞紊乱中一种极其重要的表观转录组学的调控子。作者发现增强的FTO降低了高血糖患者m6A的整体水平。内皮细胞(EC)中FTO敲低导致炎症减少,迁移和管形成能力增强。与ECFTOfl/fl糖尿病小鼠相比,EC-specific FTO-deficient(ECFTOΔ/Δ)糖尿病小鼠展示了视网膜血管渗透少,非细胞性毛细血管生成减少。进一步,甲基化RNA immunoprecipitation sequencing (MeRIP-Seq) 结合RNA-seq表明Tnip1是FTO的下游靶点。双荧光素酶实验和RNA pull-down实验说明FTO通过消除m6A甲基化抑制TNIP1 mRNA的表达。此外,TNIP1消耗激活NF-κB和其他炎症因子,加强了视网膜血管渗透和非细胞型毛细血管形成,而通过玻璃体内注射显像管病毒持续表达TNIP1可减轻内皮损伤。这些发现表明FTO-TNIP1-NF-κB网络为治疗糖尿病血管并发症提供了潜在的靶点。本研究于2023年10月发表在《Journal of Clinical Investigation》上,IF:15.9。
技术路线
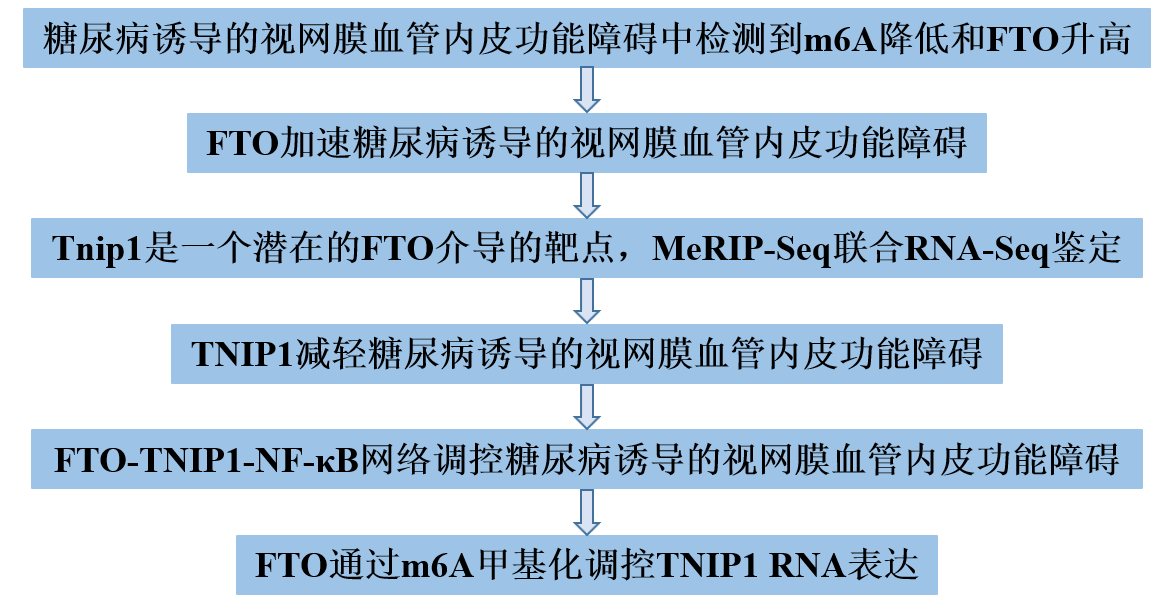
主要研究内容
1、 在糖尿病诱导的视网膜血管内皮功能障碍中检测到m6A降低和FTO升高
为诱导糖尿病诱导的视网膜损伤疾病中m6A的作用,作者首先通过点阵图探索了1型或2型糖尿病患者视网膜纤维血管膜的m6A水平。与特发性视网膜阡陌患者相比,糖尿病视网膜病变患者的m6A水平较低,与糖尿病类型无关(图1A)。腹腔注射streptozotocin(STZ)构建糖尿病模型。RNA-seq检测糖尿病视网膜中差异表达基因。热图显示了糖尿病视网膜中m6A相关基因的概述。糖尿病小鼠FTO持续升高(图1B)。qRT-PCR检测m6A相关基因(包括FTO和ALKBH5等)的mRNA水平。结果证实,1型(图1C)和2型(图1D)糖尿病视网膜病变患者FTO明显升高。糖尿病患者视网膜纤维血管膜FTO水平升高近1.8~2.3倍(1型糖尿病,图1E;2型糖尿病,图1F)。
为确定FTO在糖尿病诱导的视网膜血管内皮功能障碍中的作用,作者通过玻璃体内注射含有过表达质粒或siRNA的腺相关病毒(AAV)载体来调节其表达。过表达FTO显著加重糖尿病患者视网膜血管渗漏(图1G),增加脱细胞毛细血管的数量(图1H),而FTO敲低则会减轻这些微血管损伤。这些数据表明糖尿病诱导的视网膜血管内皮功能障碍的特征是m6A修饰减少,可能是通过调节FTO的增强。
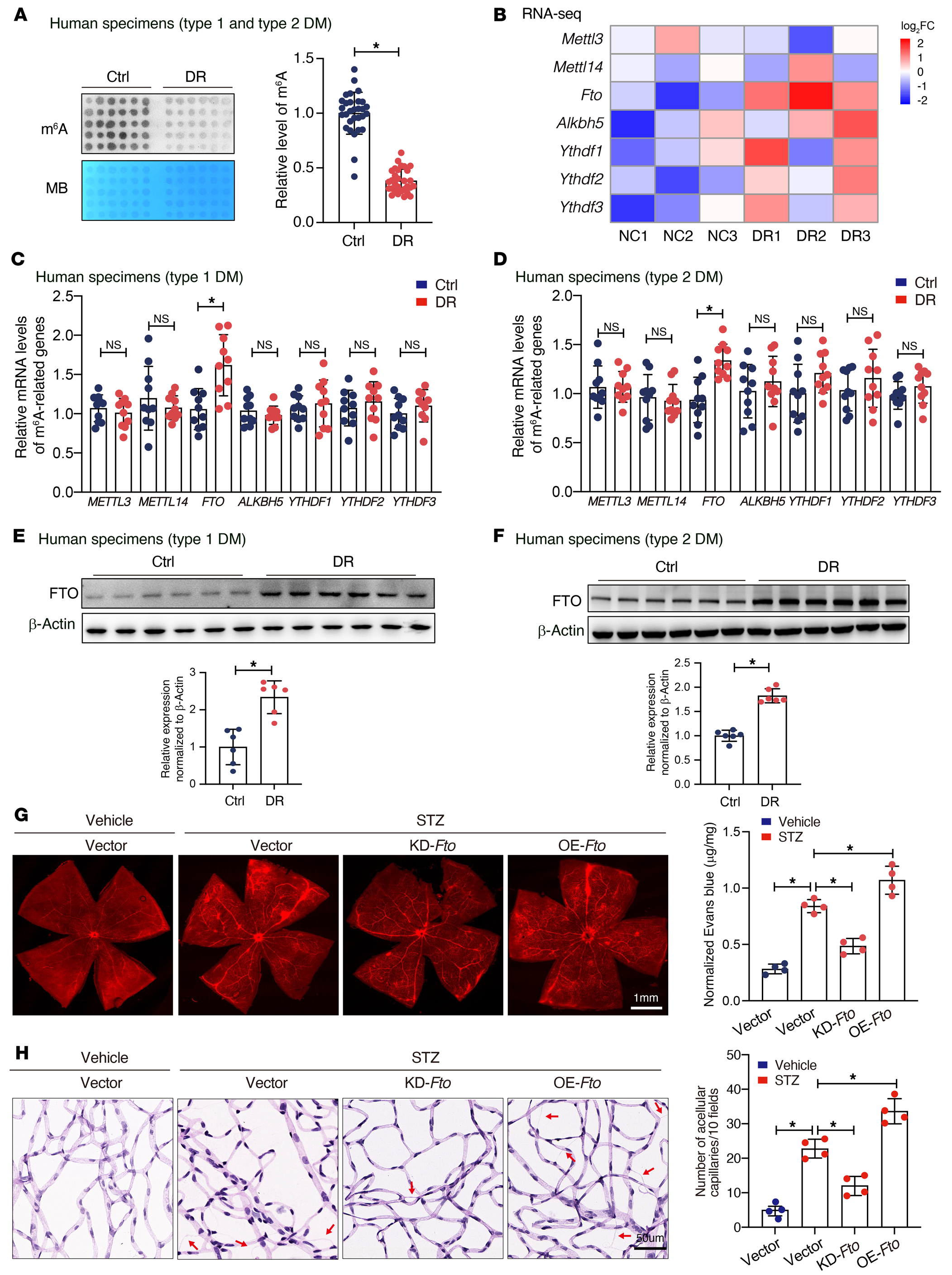
图1-糖尿病在人和小鼠中诱导m6A修饰降低和FTO表达增加
2、FTO加速糖尿病诱导的视网膜血管内皮功能障碍
为系统地阐明FTO在糖尿病诱导的视网膜血管内皮功能障碍中的功能,作者制造了EC-specific FTO-deficient(ECFTOΔ/Δ)小鼠(图2A)。为了验证成功敲除FTO,使用抗FTO抗体对小鼠视网膜血管进行免疫染色,结果证实内皮细胞FTO蛋白完全敲除(图2B)。此外,研究提取原代小鼠视网膜ECs的基因组DNA并进行PCR分析,结果证实ECFTOΔ/Δ小鼠的FTO位点成功发生cre介导的重组(图2C)。进一步的Western blotting验证了FTO蛋白在ECFTOΔ/Δ小鼠ECs中的缺失(图2D)。此外,斑点杂交实验显示ECFTOΔ/Δ小鼠中m6A水平增加(图2E)。作者探讨了FTO在糖尿病诱导的视网膜血管内皮功能障碍中的功能作用。Evans blue leakage assays显示,内皮缺失FTO缓解了糖尿病诱导的视网膜血管渗漏(图2F)。与此一致,ECFTOΔ/Δ小鼠视网膜中显示较少的脱细胞毛细血管(图2G)。
在体外,高糖可增强HRMECs炎症细胞因子(IL-1β、IL-18)分泌、迁移能力(图2H)、成管能力(图2I)、增殖和凋亡;然而,这些趋势能够被敲低FTO所逆转。综上所述,FTO在体内和体外都加重了糖尿病相关的视网膜血管功能障碍和炎症。
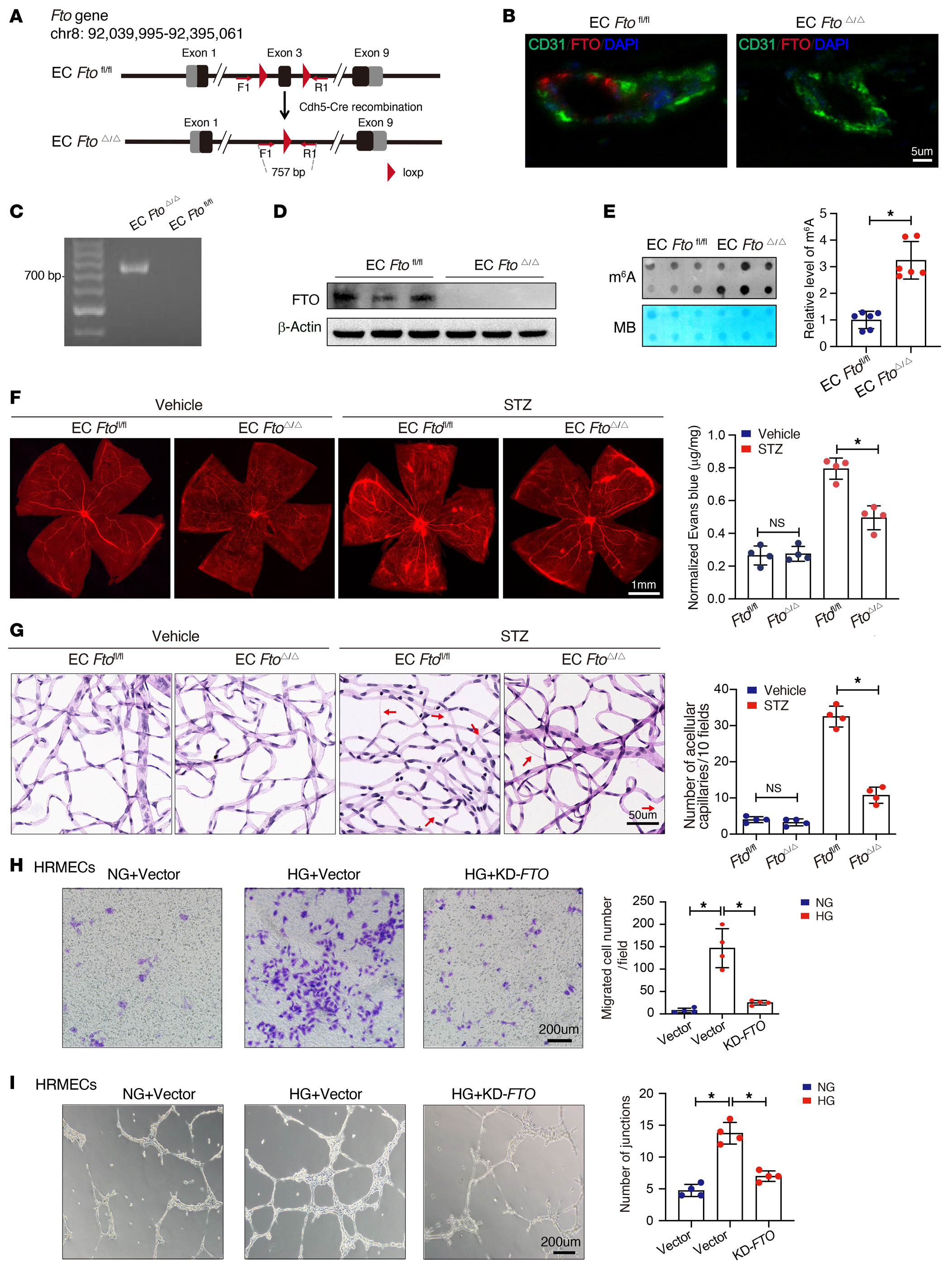
图2-FTO引起糖尿病小鼠视网膜血管内皮功能障碍
3、MeRIP-Seq联合RNA-Seq鉴定Tnip1是一个潜在的FTO介导的靶点
采用甲基化RNA免疫沉淀测序(MeRIP-Seq)结合RNA Seq,进行3个独立的生物重复预测糖尿病中m6A修饰的靶标。在MeRIP-Seq中,在典型RRACH基序中检测到m6A峰(图3A),并在靠近停止密码子的3’-UTR富集(图3B)。不同m6A位点数量的基因分布如图4B所示。与正常的视网膜相比,在糖尿病条件下,313个转录本具有较少富集的m6A修饰,176个转录本具有增加的m6A峰值富集(图3C)。基因本体(GO)分析表明,差异表达基因主要富集于几种信号通路,包括胰岛素应答、血管EC增殖正向调控、葡萄糖代谢过程等(图3D)。
联合RNA-Seq和MeRIP-Seq预测了糖尿病中43个差异表达基因,其中12个是FTO的直接效应子。Tnip1,mRNA水平显著降低和m6A峰值,被确定为糖尿病应激下m6A修饰的靶标(图3E)。与正常视网膜相比,糖尿病样本在TNIP1 mRNA的3’-UTR中显示出更少的reads(图3F)和m6A峰(图3G)。因此,作者推测FTO可能通过RNA去甲基化Tnip1导致糖尿病视网膜血管内皮功能障碍。

图3- MeRIP-Seq联合RNA-Seq鉴定Tnip1是一个潜在的FTO介导的靶点
4、TNIP1减轻糖尿病诱导的视网膜血管内皮功能障碍
为证实测序结果,作者证明在糖尿病视网膜病变患者(图4A)、糖尿病小鼠视网膜(图4B)和高糖治疗的HRMECs的视网膜纤维血管膜中,TNIP1蛋白水平降低,并伴有FTO上调(图4C)。RIP-qPCR发现糖尿病患者视网膜纤维血管膜(图4D)、小鼠视网膜(图4E)和HRMECs(图4F)中TNIP1 mRNA的m6A修饰减少。作者进一步确定了TNIP1在糖尿病诱导的视网膜血管功能障碍中的作用。在视网膜中持续表达Tnip1可显著减少视网膜血管渗漏(图5A)和脱细胞毛细血管的数量(图5B)。
体外实验表明TNIP1在高糖培养的HRMECs中显著抑制迁移(图5C)和管形成(图5D)。TNIP1增强显著改善了高糖诱导的IL-1β和IL-18的富集、增殖和凋亡。总之,这些结果表明,TNIP1在体内外均可减轻糖尿病相关的视网膜血管功能障碍和炎症。

图4-糖尿病患者TNIP1及其m6A修饰水平降低

图5-Tnip1减轻糖尿病小鼠视网膜血管内皮功能障碍
5、FTO-TNIP1-NF-κB网络调控糖尿病诱导的视网膜血管内皮功能障碍
TNIP1是NF-κB通路的抑制因子,参与抗炎反应和自身免疫。作者假设FTO调节TNIP1-NF-κB通路,激活炎症细胞因子,最终导致内皮损伤。为验证此机制,作者首先验证了ECFTOfl/fl和ECFTOΔ/Δ小鼠中FTO、TNIP1和NF-κB水平。在糖尿病ECFTOfl/fl小鼠中,FTO上调,TNIP1降低,NF-κB(p105/p50)水平升高,而在ECFTOΔ/Δ小鼠中,TNIP1上调,NF-κB抑制(图6A)。通过转染siRNA或过表达质粒在HRMES中调节FTO表达,TNIP1蛋白(图6B)和mRNA水平与FTO表达呈负相关,而NF-κB则与FTO呈正相关。在ECFTOΔ/Δ小鼠中,通过玻璃体内注射AAV载体沉默Tnip1会加剧视网膜血管渗漏(图6C)和脱细胞毛细血管形成(图6D)。同样,敲低TNIP1在抑制HRMES中FTO后,会增加IL-1β和IL-18的炎症水平、管形成和凋亡率。此外,免疫荧光分析显示,受抑制的FTO可下调高糖组织中NF-κB的表达,而这种效应在敲低TNIP1后变得不显著(图6E)。
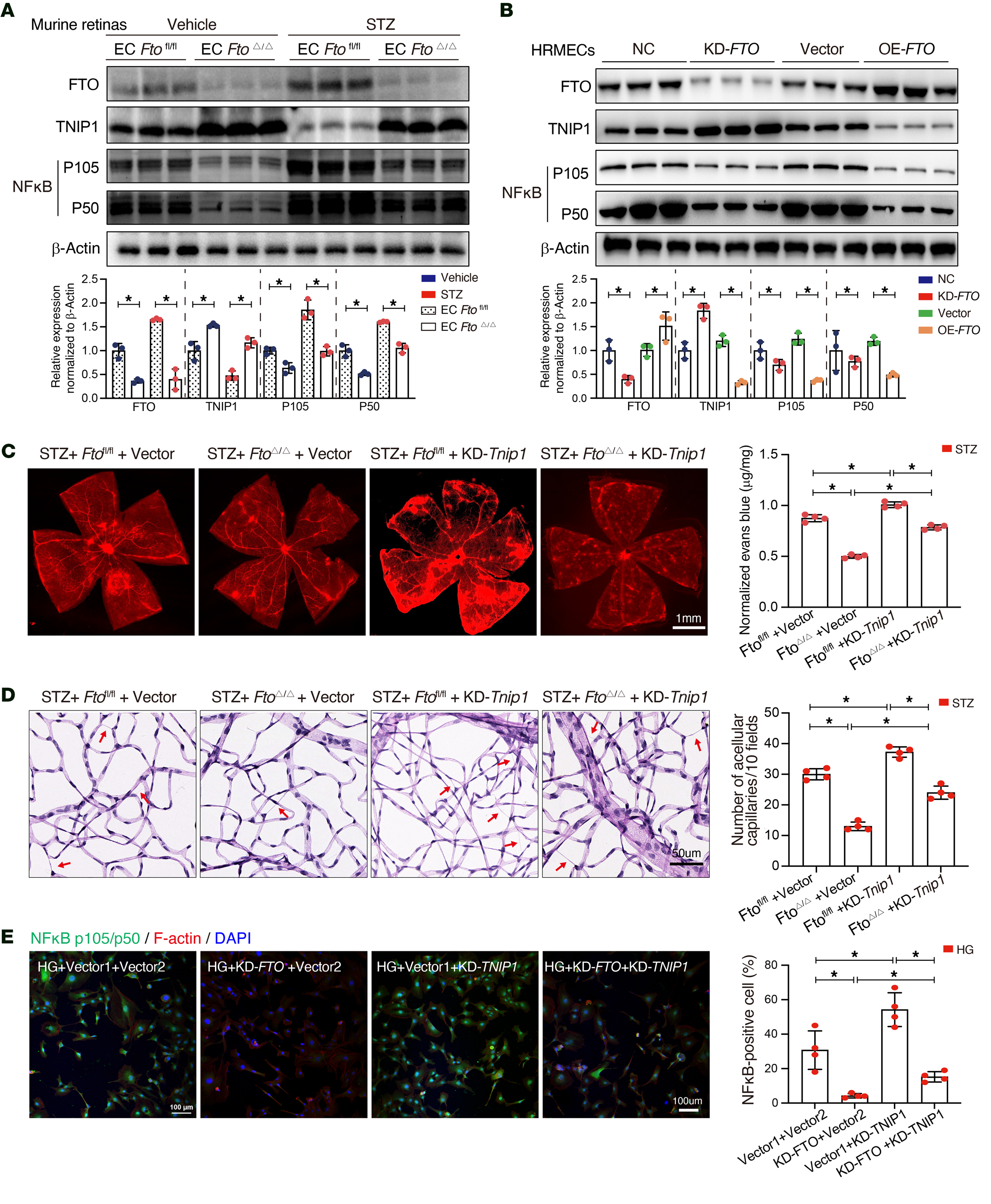
图6-FTO-TNIP1-NF-κB网络调控糖尿病诱导的视网膜血管内皮功能障碍
6、FTO通过m6A甲基化调控TNIP1 RNA表达
为了研究FTO介导的m6A修饰TNIP1的机制,作者进行了RIP实验,结果显示,与ECFTOfl/fl小鼠相比,ECFTOΔ/Δ小鼠丰富了TNIP1 mRNA的m6A修饰(图7A)。沉默FTO后,HRMES中TNIP1 mRNA的m6A水平显著升高(图7B)。此外,在给药Dactinomycin后,研究了TNIP1 mRNA的稳定性。qRT-PCR结果显示,TNIP1的半衰期约为10小时,沉默FTO可延长半衰期,增强FTO可缩短半衰期(图7C)。利用TNIP1 3’-UTR或m6A位点的8个突变(MT)序列构建了Reporters,MT3-MT8位于人类、小鼠和大鼠基因组中的高度保守区域(图7D)。在所研究的8个TNIP1错义突变中,MT4(403A>403T)失去了抑制TNIP1转录的能力,另外7个突变与野生型保持不变(图7E)。此外,RNA pull-down实验证实,FTO选择性识别动态m6A修饰,以YTHDF1为阳性参考,调节TNIP1 mRNA的寿命(图7F)。

图7-FTO通过m6A修饰调控Tnip1的表达
结论
综上所述,作者从体外、体内和翻译水平证明了FTO-TNIP1-NF-κB通路在调节糖尿病引起的内皮功能障碍中的关键作用。FTO介导的TNIP1的RNA去甲基化激活NF-κB,从而加速糖尿病诱导的血管内皮功能障碍。作者的数据为靶向该通路的关键元件来预防糖尿病的内皮损伤提供了重要的转化意义。然而,需要进一步的研究和临床试验来充分验证其潜在的机制,FTO介导的糖尿病和随后血管并发症的的益处。
实验方法
ECFTOfl/fl糖尿病小鼠,ECFTOΔ/Δ糖尿病小鼠,RNA m6A dot blot,细胞培养和转染,RNA分离和qRT-PCR,Western blot,免疫共沉淀,细胞增殖、迁移和凋亡,免疫荧光,管形成实验,RNA pull-down,荧光素酶报告基因,RIP-qPCR,RNA半衰期检测,RNA提取、建库 Illumina sequencing,GO分析,MeRIP-Seq
参考文献
Zhou C, She X, Gu C, Hu Y, Ma M, Qiu Q, Sun T, Xu X, Chen H, Zheng Z. FTO fuels diabetes-induced vascular endothelial dysfunction associated with inflammation by erasing m6A methylation of TNIP1. J Clin Invest. 2023 Oct 2;133(19):e160517. doi: 10.1172/JCI160517. PMID: 37781923; PMCID: PMC10541204.






