组学前沿——m5C修饰摘要分享
长期以来,m5C作为DNA中的表观遗传修饰被研究。已知m5C在真核生物的mRNA存在,但直到最近,它在mRNA中的分布和功能尚未被明确。采用最初用于DNA中m5C检测的亚硫酸氢盐处理方法,tRNA和rRNA中的几个m5C位点被鉴定出来,随后报道了mRNA中m5C的高分辨率图谱。继酵母中tRNA甲基转移酶4(Trm4)是tRNA 5-胞嘧啶甲基转移酶的报道之后,tRNA天冬氨酸甲基转移酶1(也称为Dnmt2)在一些真核生物物种中被报道为tRNA m5C writer,并显示出对应激诱导的tRNA切割具有保护作用。另一个tRNA甲基转移酶,NOP2/Sun RNA甲基转移酶家族成员2(NSUN2,酵母Trm4同源物),也被报道在mRNA和各种非编码RNA中甲基化5-胞嘧啶。
最近相关文章摘要
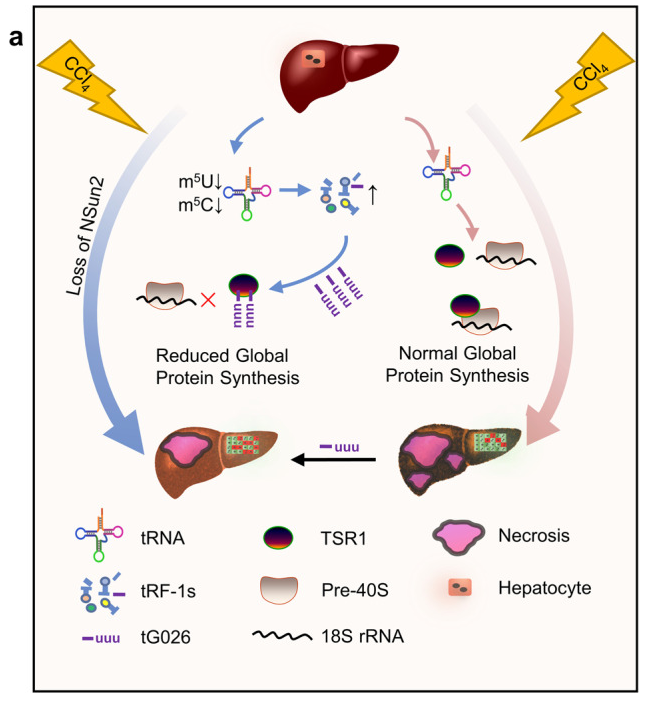
1.tRF-Gln-CTG-026 通过减少全局蛋白质合成改善肝损伤

tsRNA(tRNA衍生的小RNA)作为应激反应的产物,对应激反应和损伤调控有相当大的影响。然而,tsRNA 是否能减轻肝损伤,目前仍不清楚。在这里,我们利用 NSun2(NOP2/Sun 结构域家族成员2)的缺失作为tsRNA的产生模型,证明了tsRNA 在减轻肝损伤中的作用。从机理上讲,NSun2的缺失会减少tRNA的甲基尿苷-U5(m5U)和胞嘧啶-C5(m5C),继而产生各种 tsRNA,尤其是I类tsRNA(tRF-1s)。通过进一步筛选,我们发现tRF-Gln-CTG-026(tG026)是最佳的tRF-1,它通过削弱TSR1(前体rRNA处理蛋白TSR1同源物)与pre-40S核糖体之间的联系,抑制全局蛋白质合成,从而改善肝损伤。这项研究表明,tsRNA 可减少肝损伤和修复过程中的全局蛋白质合成,为肝损伤提供了一种潜在的治疗策略。
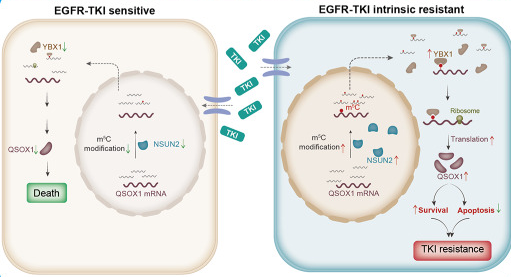
2. 在EGFR突变型非小细胞肺癌中,异常m5C高甲基化通过NSUN2/YBX1/QSOX1轴介导对吉非替尼的固有耐药性

背景
RNA 5-甲基胞嘧啶(m5C)修饰在各种肿瘤的发病机制中起着关键作用。然而,RNA m5C修饰在肿瘤耐药性中的功能和分子机制仍不清楚。
方法
研究人员测定了非小细胞肺癌(NSCLC)细胞系和患者样本中RNA m5C甲基化、m5C writer NOP2/Sun RNA甲基转移酶家族成员2(NSUN2)与EGFR-TKI耐药之间的相关性。通过体外和体内功能获得和功能缺失实验研究了NSUN2对EGFR-TKI耐药性的影响。通过RNA测序(RNA-seq)、亚硫酸盐RNA测序(RNA-BisSeq)和m5C甲基化RNA免疫沉淀-qPCR(MeRIP-qPCR)鉴定了NSUN2参与EGFR-TKI耐药的靶基因。此外,通过功能拯救和嘌呤霉素掺入实验研究了NSUN2对靶基因表达的调控机制。
结果
RNA m5C高甲基化和NSUN2与EGFR-TKI的固有耐药性显著相关。NSUN2过表达导致吉非替尼耐药和肿瘤复发,而NSUN2基因干扰导致肿瘤消退,并在体外和体内克服了对吉非替尼的固有耐药性。整合RNA-seq和m5C-BisSeq分析结果发现,喹呤巯基氧化酶1(QSOX1)是m5C异常修饰的潜在靶点。NSUN2甲基化QSOX1编码序列区域,通过m5C reader Y-box结合蛋白1(YBX1)增强QSOX1翻译。
结论
我们的研究揭示了在EGFR突变型NSCLC 中异常 RNA m5C 修饰通过 NSUN2-YBX1-QSOX1 轴介导对吉非替尼固有耐药性的关键作用。
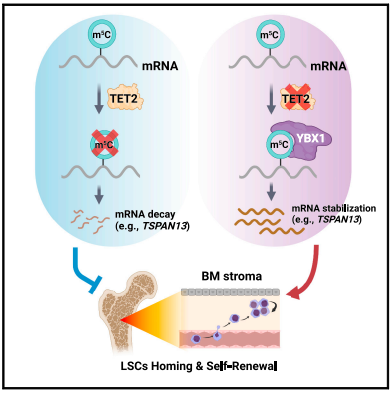
3.TET2介导的 mRNA 去甲基化调节白血病干细胞的归巢和自我更新

TET2在急性髓系白血病(AML)中反复发生突变,其缺乏会促进白血病的发生(由侵袭性致癌突变驱动),并增强白血病干细胞(LSC)的自我更新。然而,潜在的细胞/分子机制尚未完全明了。在这里,我们发现在各种急性髓系白血病模型中(由侵袭性或侵袭性较低的突变介导),TET2的缺乏会通过促进白血病干细胞归巢到骨髓(BM)微环境来增加其自我更新/增殖,从而显著促进白血病的发生。急性髓系白血病母细胞中TET2的缺乏会增加四跨膜蛋白13(TSPAN13)的表达,从而激活CXCR4/CXCL12信号传导,导致 LSC向骨髓微环境的归巢/迁移增加。从机制上讲,TET2的缺乏导致TSPAN13 mRNA中甲基-5-胞嘧啶(m5C)修饰的积累;YBX1特异性识别m5C修饰,并增加TSPAN13 转录本的稳定性和表达。总之,我们的研究揭示了TET2 作为 mRNA m5C 去甲基化酶在白血病发生、白血病母细胞迁移/归巢和 LSC自我更新中的重要功能。
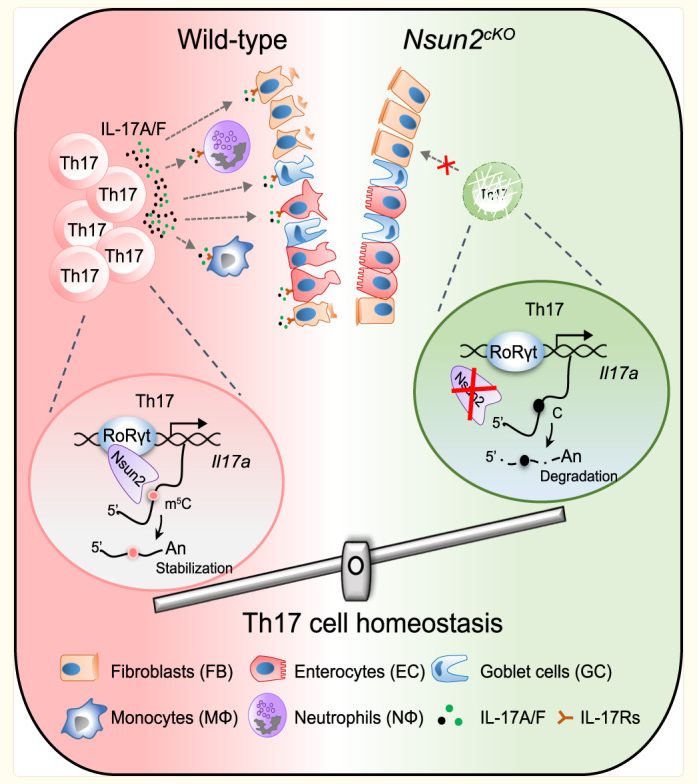
4. Nsun2偶联RoRγt调控Th17细胞命运并促进结肠炎的发生

辅助性T细胞17(Th17)是 CD4+辅助T细胞的一个亚群,参与自身免疫中的炎症反应。Th17细胞分泌Th17特异性细胞因子,如IL-17A和IL17-F,它们受主转录因子RoRγt的调控。然而,Th17细胞功能的表观遗传调控机制仍未完全明了。在这里,我们发现在小鼠 CD4+ T细胞中缺失RNA 5-甲基胞嘧啶(m5C)甲基转移酶Nsun2能特异性地抑制 Th17 细胞分化并减轻 Th17 细胞诱导的结肠炎发病。从机理上讲,RoRγt能将Nsun2招募到其靶标(包括Il17a和Il17f)的染色质区域,导致转录偶联的m5C形成,从而增强mRNA的稳定性。我们的研究证明了Th17细胞中m5C介导的细胞内在功能,并提示Nsun2是治疗自身免疫性疾病的潜在靶点。
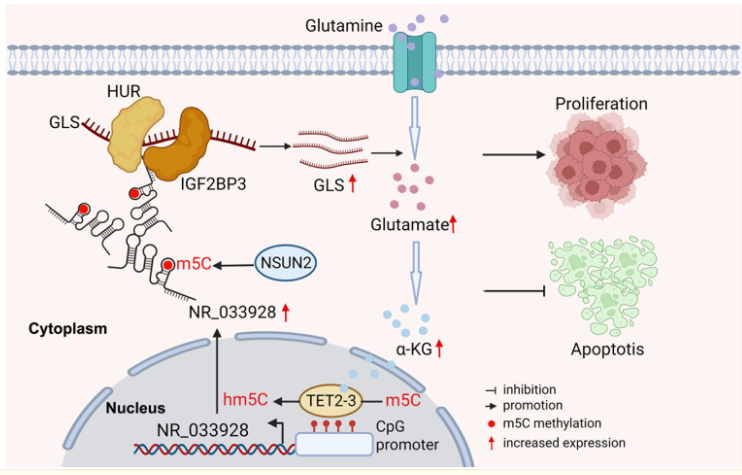
5. m5C甲基化lncRNA NR_033928通过稳定GLS mRNA促进谷氨酰胺代谢重编程,从而促进胃癌增殖

异常的5-甲基胞嘧啶(m5C)甲基化已被证实与胃癌的发生、发展和预后密切相关。失调的长非编码 RNA(lncRNA)参与了癌症的多种生物学过程。然而,迄今为止,m5C甲基化的lncRNA在胃癌(GC)中很少被研究。在这里,我们发现RNA 5-甲基胞嘧啶(m5C)甲基转移酶NSUN2在胃癌中上调,而NSUN2的高表达与预后不良有关。NR_033928被鉴定为GC中NSUN2甲基化和上调的lncRNA。在功能上,NR_033928通过与IGF2BP3/HUR复合物相互作用促进GLS mRNA的稳定性,从而上调谷氨酰胺酶(GLS)的表达。谷氨酰胺代谢产物α-KG的增加通过增强启动子5-羟甲基胞嘧啶(hm5C)的去甲基化而上调NR_033928的表达。总之,我们的研究结果表明,NSUN2甲基化的NR_033928促进了GC的进展,可能是GC潜在的预后和治疗靶点。