CircXRN2通过激活Hippo通路抑制由组蛋白乳酸化驱动的人膀胱癌肿瘤进展
膀胱癌(BCa)是世界上第四大最常见的预后不良的恶性肿瘤。需要进一步的探索和研究来揭示circRNA的潜在作用和分子机制。在目前的研究中,我们的研究结果表明,circXRN2通过激活人类膀胱癌中的Hippo通路,抑制由组蛋白乳酸化驱动的肿瘤进展。在本研究中,CircXRN2在膀胱癌组织和细胞系中异常下调。CircXRN2在体内和体外均能抑制肿瘤细胞的增殖和迁移。此外,circXRN2作为糖酵解和乳酸生成的负调节因子。从机制上讲,circXRN2通过与SPOP降解因子结合,阻止LATS1进行SPOP介导的降解,进而激活Hippo信号通路,发挥多种生物学功能。circXRN2-Hippo通路调节轴通过抑制H3K18乳酸化和LCN2的表达进一步调节肿瘤进展。我们的研究结果为人类膀胱癌的临床干预提供了新的治疗靶点和有希望的策略。本文于2023年9月发表于“Molecular Cancer”(IF=37.3)上。
技术路线

结果
1)LATS1在膀胱癌中下调,并与circXRN2相互作用
LATS1是Hippo信号通路中重要的促进分子,在多种恶性肿瘤中发挥重要作用。如图1a所示,组织芯片和临床样本显示,与邻近正常组织相比,膀胱癌组织中LATS1异常下调。通过RNA免疫沉淀(RIP)和高通量测序,我们获得了一个可能与LATS1蛋白相互作用的circRNAs数据库(图1b)。为了进一步发现可能参与肿瘤发生和进展的特异性circRNAs,我们验证了数据库中circRNAs在永生化人正常尿道上皮细胞(SV-HUC-1)和膀胱癌细胞系(5637、T24、EJ、TCCSUP和UM-UC-3)中的表达水平。结果,我们在膀胱癌细胞系中鉴定出14种表达水平非常低的circRNA(图1c)。此外,我们使用RIP实验验证了LATS1与上述circRNAs之间的亲和力,其中circXRN2 (hsa_circ_0001134)对LATS1蛋白的结合效率和亲和力最高(图1d)。此外,我们通过qRT-PCR验证了circXRN2在临床肿瘤组织中的失调(图1e)。值得注意的是,肿瘤细胞系中circXRN2的表达水平在一定程度上与Hippo通路关键分子TAZ和YAP的激活相关(图1f和g)。这些发现表明,circXRN2可能参与了LATS1和Hippo信号通路的调节。
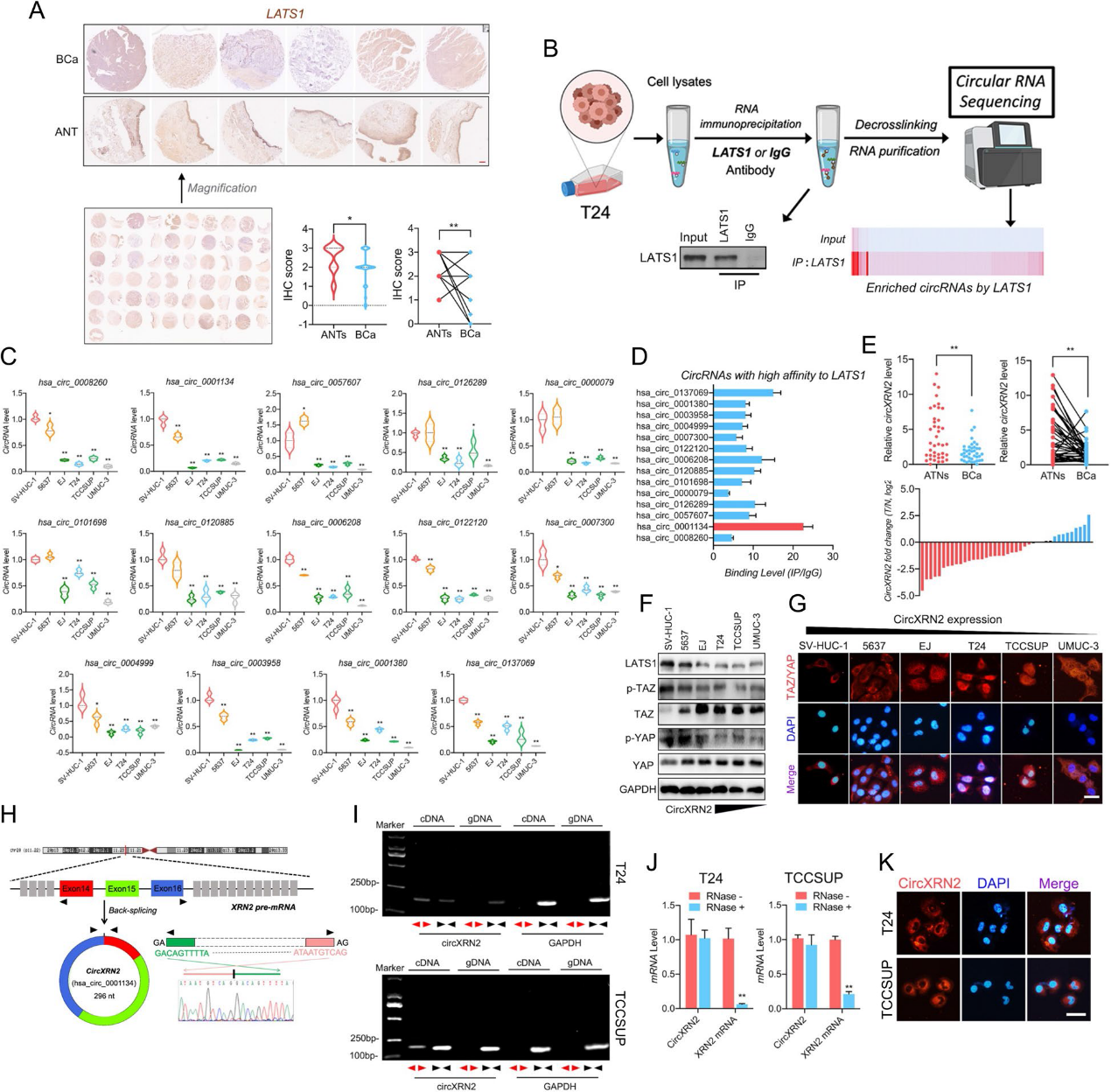
2)CircXRN2在体外和体内抑制膀胱癌细胞的增殖和迁移
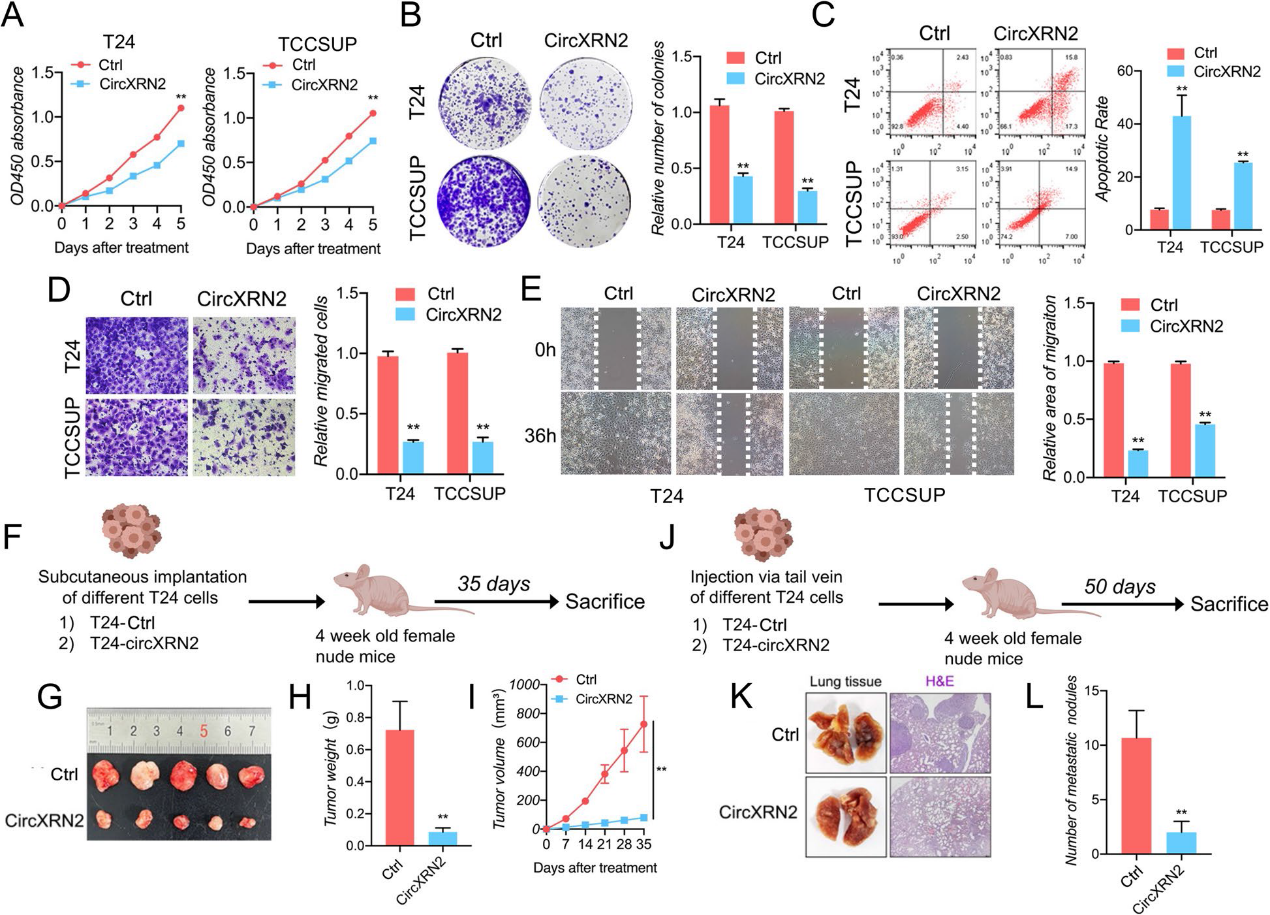
根据Sanger测序,我们确定了circXRN2的连接位点序列(图1)。然后,我们使用发散引物和收敛引物进行qRT-PCR。图1i的结果表明,circXRN2只能被cDNA中的发散引物扩增,这证实了circXRN2的环状结构,而不是线性结构。与线性RNA相比,circRNA在内源性环境中更加稳定,因此不易降解。由于这一特性,我们用RNase R处理样品,发现circXRN2可以耐受RNase R的消化,而线性XRN2 mRNA几乎完全被降解(图1j)。最后,RNA FISH显示circXRN2主要定位于膀胱癌细胞的细胞质中(图1k)。在体外实验中,我们进行了CCK8测定来评估细胞活力,结果证明了circXRN2的抑制作用(图2a)。同样,我们通过集落形成实验来测试circXRN2在细胞增殖中的生物学功能,结果与之前的实验结果一致(图2b)。此外,circXRN2的过表达也会引发细胞凋亡(图2c)。在细胞迁移能力方面,如图2d和e所示,circXRN2也降低了细胞迁移能力。在体内实验中,我们建立了裸鼠皮下移植瘤发生模型和尾静脉肺转移模型。结果表明,circXRN2可以降低皮下肿瘤的生长速度和重量(图2f-i)。同样,circXRN2过表达组的转移淋巴结数量远低于阴性对照组(图2j-l)。综上所述,我们的研究结果表明circXRN2在体外和体内抑制膀胱癌细胞的增殖和迁移。
3)CircXRN2阻止SPOP介导的LATS1降解
为了揭示circXRN2和LATS1之间的相互作用,我们构建了表达LATS1不同片段的质粒,并将其转染到293T细胞中(图3a)。RIP实验显示,在293T细胞和BCa细胞中,LATS1蛋白的片段2 (279 aa-525 aa)可与circXRN2相互作用(图3b)。接下来,我们发现过表达circXRN2上调LATS1蛋白水平(图3c和d)。根据上述结果,我们假设circXRN2可能通过翻译后修饰调节LATS1蛋白水平。为了证实这一猜想,我们用环己亚胺处理阴性对照和过表达circXRN2的细胞,结果表明circXRN2可以延长LATS1蛋白的半衰期(图3e)。此外,硼替佐米(一种蛋白酶体抑制剂)恢复了circXRN2缺乏肿瘤细胞中LATS1蛋白的表达水平(图3f)。接下来,我们通过IP检测不同细胞中LATS1蛋白的泛素化。如图3g所示,在硼替佐米和N-乙基马来酰亚胺治疗下,在circXRN2过表达的细胞中,较少的LATS1蛋白泛素化。综上所述,这些结果证实了circXRN2通过调节转录后泛素化调节膀胱癌细胞中的LATS1蛋白水平。
最近的一项研究报道,LATS1是斑点型POZ (SPOP)的潜在底物,SPOP促进LATS1的泛素化和降解。如图3h所示,在膀胱癌细胞中,LATS1与SPOP蛋白相互作用。接下来,我们将不同浓度的HA标记的SPOP转染到膀胱癌细胞中。结果显示,SPOP以剂量依赖的方式下调LATS1蛋白(图3i)。有趣的是,SPOP敲除显著消除了circXRN2缺乏诱导的LATS1蛋白下调(图3j)。此外,IP分析显示,SPOP敲低显著降低了LATS1蛋白的泛素化(图3k)。如图31所示,在LATS1蛋白的N端存在两个推测的SPOP结合基序或“degrons”(SBC1: 327- MQSSS- 341;Sbc2: 429- pqsss - 443)。在我们之前的结果中,circXRN2与LATS1的片段2 (279 aa-525 aa)相互作用,其中包含SBC1和SBC2。因此,我们推测circXRN2和SPOP可能竞争性地与LATS1蛋白相互作用以调节其降解。为了进一步验证,我们将野生型或突变型LATS1质粒转染到293T或膀胱癌细胞中,证实了SBC1突变导致SPOP介导的LATS1降解被显著阻断,而SBC2的耗尽几乎没有影响(图3m)。同时,co-IP结果显示,野生型LATS1可以结合SPOP,但SBC1突变体LATS1与SPOP的相互作用几乎完全减弱(图3n)。最后,如图3o所示,我们发现circXRN2的敲低促进了膀胱癌细胞中SPOP和LATS1的相互作用。综上所述,我们的研究结果表明circXRN2阻止了LATS1由SPOP介导的降解。

4)CircXRN2在膀胱癌中作为糖酵解和乳酸生成的抑制因子
许多研究报道了Hippo通路在细胞糖酵解代谢中的调节作用。鉴于circXRN2、LATS1和Hippo通路之间的密切关系,我们假设circXRN2在膀胱癌细胞的糖酵解中起关键作用。为了验证这一推测,我们过表达circXRN2,并进行了2-NBDG摄取检测、葡萄糖摄取试验和乳酸生成测定。上述实验证明,circXRN2降低了T24和TCCSUP细胞的葡萄糖摄取和乳酸生成(图4a-c)。海马糖酵解率分析结果显示,过表达circXRN2的膀胱癌细胞中glycoPER、基础糖酵解和代偿性糖酵解均低于正常肿瘤细胞(图4d)。综上所述,circXRN2在T24和TCCSUP细胞的糖酵解和乳酸代谢中起负作用。

5)CircXRN2通过稳定LATS1激活Hippo通路,调节膀胱癌进展、糖酵解和乳酸生成
为了证实circXRN2/LATS1轴调控膀胱肿瘤细胞的多种生物学功能和葡萄糖代谢,我们在过表达circXRN2的细胞中敲低了LATS1蛋白。免疫印迹分析显示了LATS1、TAZ和YAP的蛋白水平(图5a),免疫荧光证实了TAZ/YAP在细胞内的位置(图5b)。CCK-8实验和集落形成实验的结果显示,LATS1的缺失逆转了circXRN2诱导的对细胞活力和增殖的抑制作用(图5c和d)。同时,通过Transwell实验和伤口愈合实验确定了细胞迁移。与circXRN2过表达的细胞相比,转染shLATS1的细胞迁移能力更强(图5e和f)。此外,通过2-NBDG摄取测定、葡萄糖摄取测定和乳酸生成检测,分别测定对照组、circXRN2过表达组和circXRN2 + shLATS1组的葡萄糖摄取能力和乳酸生成。图5g-i显示shLATS1减轻了circXRN2对糖酵解代谢的抑制。随后,通过海马代谢分析仪对不同细胞的glycoPER、基础糖酵解率和代偿糖酵解率进行分析计算,结果也支持上述结论(图5j)。

6)circXRN2调控组蛋白乳酸化促进膀胱癌的发生
我们利用2-脱氧-D-葡萄糖(2-DG,一种糖酵解抑制剂)和草氨酸盐(一种乳酸脱氢酶抑制剂)来证实膀胱癌细胞中糖酵解、整体乳酸化和组蛋白乳酸化之间的关系。如图6b-d所示,2-DG和草氨酸盐以剂量依赖的方式降低了全局乳酸化修饰和H3K18乳酸化修饰,并被LDH耗尽完全抑制。考虑到circXRN2对糖酵解和乳酸生成的影响,我们假设circXRN2可能参与了膀胱癌中组蛋白的乳酸化。正如我们假设的那样,图6e中的结果显示circXRN2显著降低了全局乳酸化和H3K18乳酸化水平。值得注意的是,在膀胱癌细胞系中,全局乳酸化和H3K18乳酸化是异常的,这表明它们在肿瘤发生中的潜在作用(图6f)。此外,为了验证组蛋白乳酸化在膀胱癌中的生物学功能,我们消除了内源性LDHA和LDHB,以降低整体乳酸化和H3K18乳酸化水平,并补充乳酸钠进行拯救实验。CCK-8和集落形成实验表明,组蛋白乳酸化在细胞增殖和集落形成能力中起着至关重要的作用(图6g和h)。此外,同时消除LDHA和LDHB也会损害T24和TCCSUP细胞的细胞迁移能力(图6i和j)。乳酸钠可以减弱LDHA/B缺乏诱导的肿瘤细胞增殖(图6g和h)和迁移(图6i和j)的抑制。综上所述,这些结果表明组蛋白H3K18乳酸化是由circXRN2调节的,并参与了膀胱癌的肿瘤发生。

7)LCN2是H3K18乳酸化的靶点,是膀胱癌的致癌基因
为了揭示H3K18乳酸化的调控机制,我们在T24细胞中使用ChIP级H3K18la抗体和IgG进行了CUT&Tag。如图7a所示,H3K18la可以在许多基因的启动子区域富集。同时,KEGG数据库分析显示,在我们的CUT&Tag测序中,H3K18la相关基因在调节肿瘤发生的多种信号通路中富集(图7b),表明H3K18la在人类膀胱癌进展中起着关键作用。然后,我们对circXRN2过表达或不过表达的T24和TCCSUP细胞进行转录组测序,并将这些结果与CUT&Tag数据和PubMed数据库相结合,选择LCN2、NARP和KRT80作为候选基因(图7c和d)。LCN2、NARP和KRT80启动子区域富集H3K18la或IgG的信号如图7e所示。接下来,我们在circXRN2过表达的细胞中验证了上述靶点在mRNA水平上的表达,结果表明,circXRN2可以显著调节LCN2。然后,在过表达circXRN2的T24和TCCSUP细胞中验证LCN2 mRNA和LCN2蛋白的表达水平。结果显示,LCN2被circXRN2显著下调(图7f)。此外,糖酵解抑制剂也在蛋白水平上调节LCN2的表达(图7g)。我们在TCGA数据库和Kaplan-Meier Plotter数据库中发现,与正常组织相比,LCN2在膀胱癌组织中表达上调,且与膀胱癌进展密切相关(图7h)。基于以上证据,我们选择LCN2进行下面的研究。根据我们之前的CUT&Tag测序,我们设计了针对LCN2启动子不同区域的特异性引物,ChIP实验显示H3K18la富集在LCN2启动子中。值得注意的是,H3K18la与LCN2启动子之间的相互作用可以被糖酵解抑制剂和circXRN2减少,进一步表明H3K18la在LCN2转录中的关键作用(图7i, j)。最后,我们探讨了LCN2在LCN2缺失的T24和TCCSUP细胞中的生物学功能。如图7k-n所示,LCN2的缺失显著降低了肿瘤细胞的增殖、集落形成和迁移。综上所述,我们的研究结果表明LCN2直接受H3K18乳酸化调控,并在人类膀胱癌中发挥致癌基因的作用。

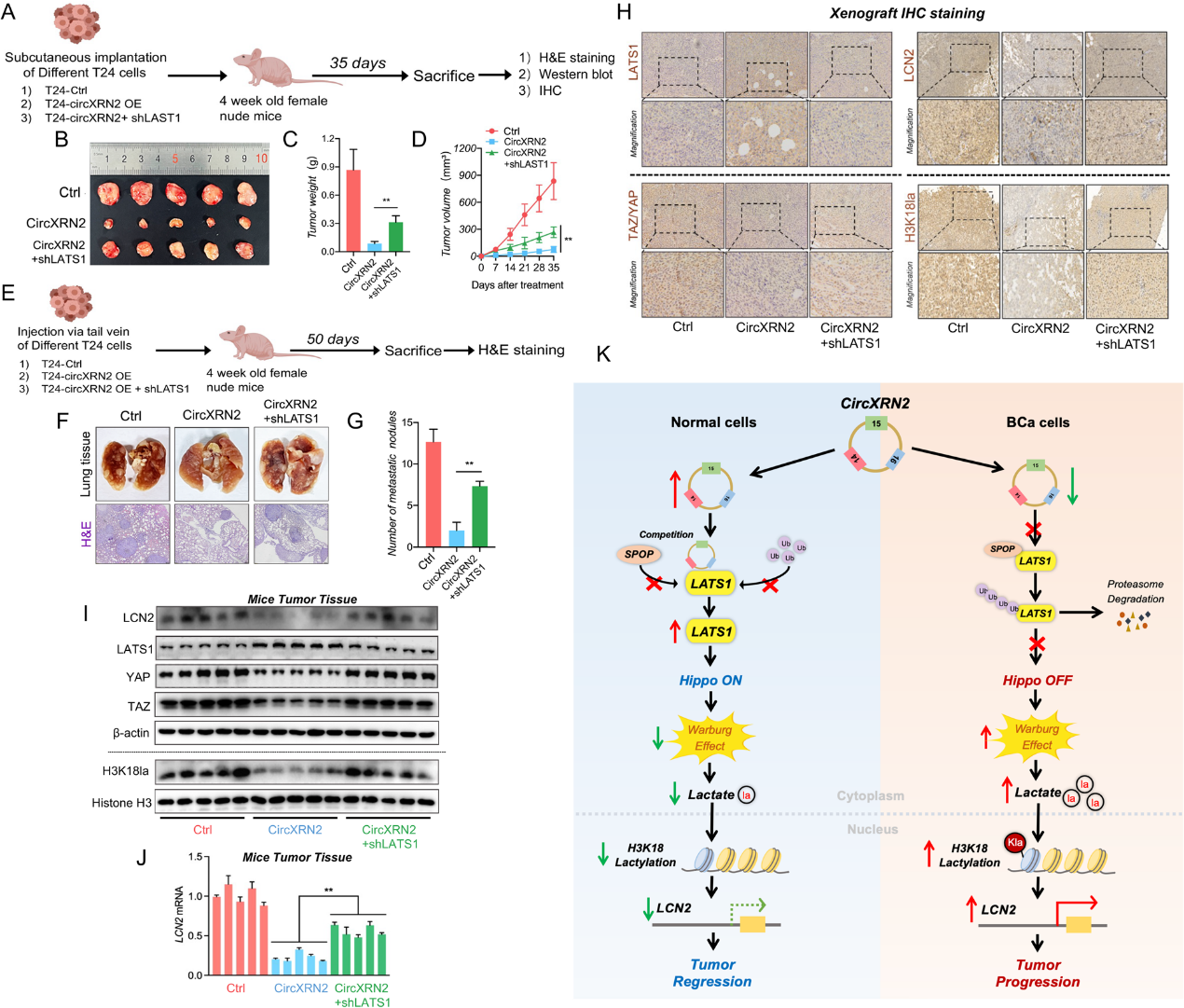
8)circXRN2‑LATS1轴在体内抑制膀胱癌细胞的肿瘤生长和转移
为了验证circXRN2-LATS1轴是否在体内抑制膀胱癌细胞的肿瘤生长和转移,我们将不同处理(对照、circXRN2过表达、circXRN2 + shLATS1)的细胞皮下注射到裸鼠体内。与体外细胞实验类似,过表达circXRN2可显著降低肿瘤生长速率,敲低LATS1显著减弱了circXRN2引起的抑制作用(图8a-d)。我们还通过向裸鼠尾静脉注射不同的T24细胞,建立裸鼠肺转移模型,评估细胞在体内的转移能力。如图8eg所示,与正常对照组相比,过表达circXRN2显著减少了肺转移结节,而在circXRN2过表达并敲低LATS1的细胞中,肿瘤结节显著增加。此外,我们通过免疫组织化学和western blotting检测不同治疗组肿瘤中LATS1、TAZ/YAP、LCN2和H3K18la的表达水平,结果与之前的实验结果一致(图8h-i)。同时,我们评估了LCN2 mRNA在不同肿瘤中的表达水平(图8j)。总之,我们的研究结果表明,circXRN2通过激活Hippo信号通路抑制人类膀胱癌中由H3K18乳酸化介导的肿瘤进展。
结论
我们证实circXRN2通过调节H3K18乳酸化抑制膀胱癌的进展。从机制上讲,circXRN2与LAST1蛋白结合,保护其免受SPOP介导的泛素化和降解,从而激活Hippo信号通路,抑制H3K18的乳酸化。我们的发现将有助于发现新的分子靶点和治疗人类膀胱癌的策略。
实验方法
RIP,CUT&Tag,FISH,糖酵解率测定,qRT-PCR,ChIP,IP,CCK-8,克隆形成实验,transwell,伤口愈合试验,流式,WB,免疫荧光。
参考文献
Xie B, Lin J, Chen X, Zhou X, Zhang Y, Fan M, Xiang J, He N, Hu Z, Wang F. CircXRN2 suppresses tumor progression driven by histone lactylation through activating the Hippo pathway in human bladder cancer. Mol Cancer. 2023 Sep 8;22(1):151. doi: 10.1186/s12943-023-01856-1.






