乳酸化修饰研究摘要汇总
乳酸化是一种新的乳酸衍生的组蛋白翻译后修饰(PTM),是由芝加哥大学赵英明教授课题组首先发现的,该研究揭示了乳酸在表观遗传学途径中的作用,首次报道乳酸可以修饰组蛋白,调控基因的转录表达,拓展了大家对乳酸的认识。
乳酸(lactate)是细胞糖酵解途径重要的含碳代谢产物,已成为一种能量底物和有价值的信号分子。细胞代谢过程中,乳酸的积累促进了组蛋白赖氨酸发生乳酸化修饰。乳酸化修饰来源于细胞葡萄糖代谢产生的乳酸,并受到糖酵解和线粒体氧化代谢的调控。
由于 Warburg 效应(有氧糖酵解)是癌症的标志之一,即使在有氧条件下,癌细胞也倾向于将葡萄糖转化成乳酸来产生能量,与正常细胞相比,葡萄糖代谢的乳酸更多。因此,肿瘤中的组蛋白乳酸化很可能是异常的。
乳酸的生物学功能也因肿瘤细胞中Warburg效应的存在,得到了广泛关注。
相关最近研究文章
1.小胶质细胞中YY1乳酸化通过转录激活介导的FGF2上调促进血管生成

摘要
背景:眼部新生血管是致盲的主要原因。视网膜小胶质细胞与缺氧诱导的血管生成和血管病变有关,但其潜在机制尚不完全清楚。乳酸化是一种新的乳酸衍生的翻译后修饰,在多种细胞过程中起关键作用。缺血性视网膜病变缺氧是视网膜新生血管形成的促发因素,因此乳酸化很可能参与了这一过程。本研究旨在探讨乳酸化在视网膜新生血管形成中的作用,并为视网膜新生血管疾病寻找新的治疗靶点。
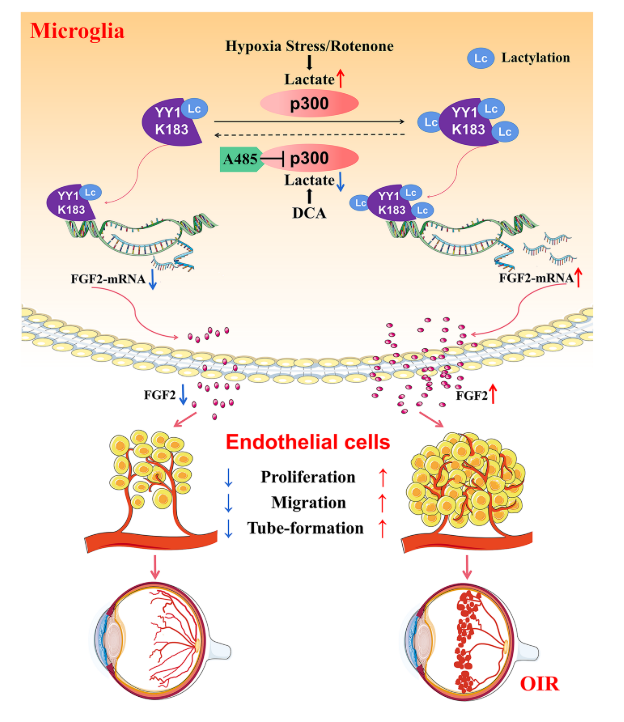
结果:通过集落刺激因子1受体(CSF1R)抑制剂PLX 3397去除小胶质细胞抑制氧诱导的视网膜病变中的视网膜新生血管形成。缺氧增加小胶质细胞中的乳酸化并加速FGF2表达,促进视网膜新生血管形成。确定了67个蛋白质的77个位点在缺氧条件下乳酸增加的背景下具有增加的乳酸化。研究结果表明,转录因子非组蛋白Yin Yang-1(YY 1)在第183位赖氨酸(K183)发生了乳酸化,该位点受组蛋白乙酰转移酶p300的调控。高乳酸化YY 1直接增强FGF2转录并促进血管生成。K183的YY1突变消除了这些影响。p300的过表达增加YY1乳糖化并增强体外血管生成,并且施用p300抑制剂A485极大地抑制体内和体外血管生成。
结论:上述研究结果表明,YY1乳糖化在小胶质细胞中起着重要的作用,通过上调FGF2的表达在视网膜新生血管。靶向乳酸/p300/YY1乳酸化/FGF2轴可为增殖性视网膜病提供新的治疗靶标。
2.己糖激酶2通过组蛋白乳酸化介导的基因表达是肝星状细胞活化和肝纤维化所必需的

摘要
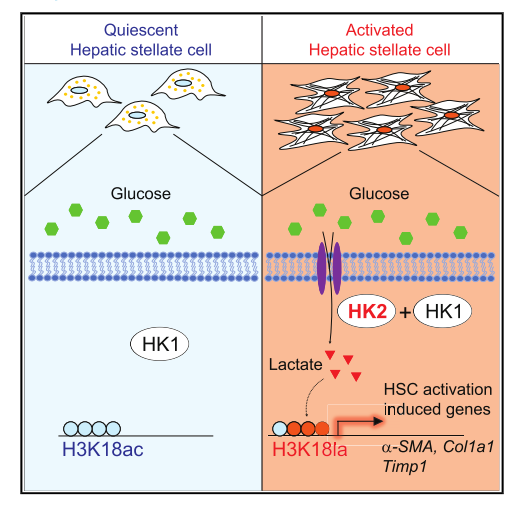
乳酸与肝星状细胞(HSC)的活化有关。然而,乳酸发挥其作用的机制仍然难以捉摸。使用RNA-seq和CUT&Tag染色质分析,我们发现在活化的HSC中诱导己糖激酶2(HK 2)表达是通过组蛋白乳酸化而不是组蛋白乙酰化。通过Hk2缺失抑制组蛋白乳酸化或乳酸盐产生的药理学抑制减少HSC活化,而外源性乳酸盐而非乙酸盐补充挽救活化表型。因此,由活化的HSC产生的乳酸盐通过组蛋白乳酸化决定HSC的命运。研究发现组蛋白乙酰化与组蛋白乳酸化竞争,这可以解释为什么I类HDAC(组蛋白脱乙酰酶)抑制剂阻碍HSC活化。最后,HSC特异性或全身性缺失HK2抑制HSC活化和体内肝纤维化。因此,本研究提供证据表明HK2可能是肝纤维化的有效治疗靶点。
3.ULK1介导的代谢重编程通过其乳酸化调节Vps34脂质激酶活性

摘要
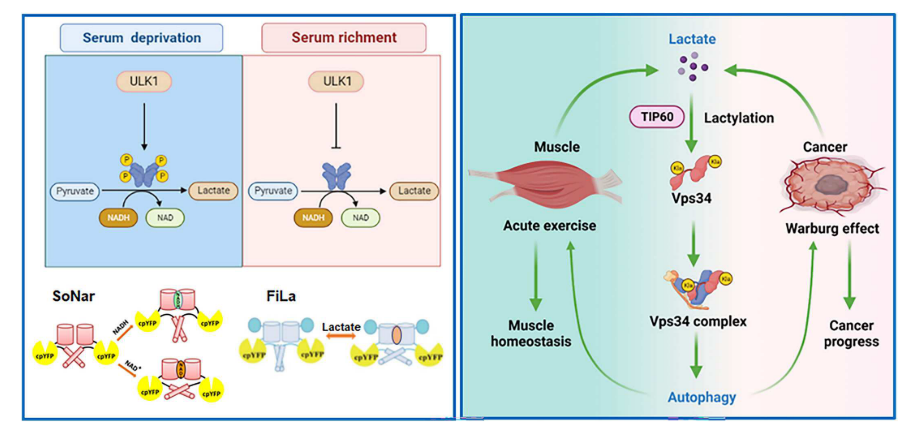
自噬和糖酵解是涉及生理和病理细胞程序的高度保守的生物过程,但这些过程之间的相互作用知之甚少。在这里,表明了糖酵解酶乳酸脱氢酶A(LDHA)被激活后UNC-51样激酶1(ULK1)激活营养剥夺。具体而言,ULK 1直接与LDHA相互作用,在营养缺乏时磷酸化丝氨酸-196并促进乳酸产生。乳酸通过酰基转移酶KAT5/TIP 60介导Vps34乳酸化(在赖氨酸-356和赖氨酸-781处),从而连接自噬和糖酵解。Vps 34乳酸化增强了Vps34与Beclin1、Atg14 L和UVRAG的结合,然后增加了Vps34脂质激酶活性。Vps34乳酸化促进自噬通量和内溶酶体运输。剧烈运动期间骨骼肌中的Vps 34乳酸化维持肌细胞稳态,并通过诱导细胞自噬与癌症进展相关。本研究结果描述了自噬的调控机制,并将细胞自噬和糖酵解结合起来。
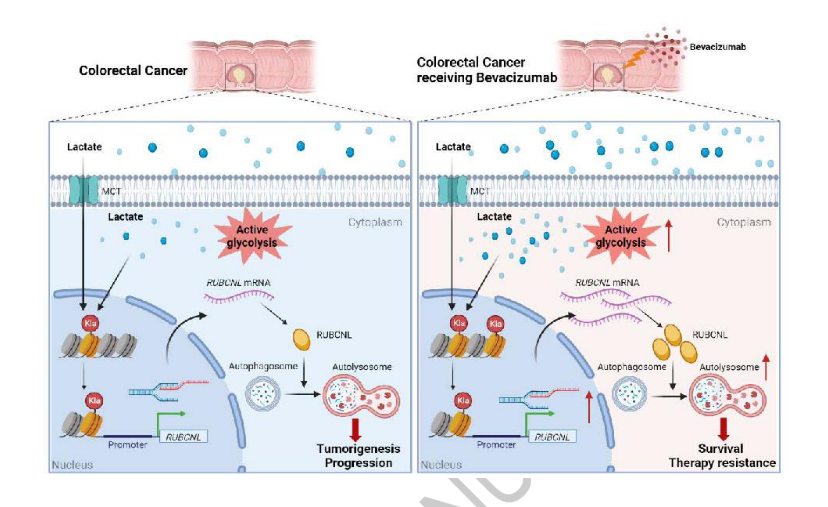
4.肿瘤来源的乳酸盐通过组蛋白H3赖氨酸18乳酰化(H3K18la)促进结直肠癌中自噬增强蛋白RUBCNL表达来促进对贝伐单抗治疗的抗性

摘要
贝伐单抗在转移性结直肠癌(CRC)的一线和二线治疗中起重要作用。缺氧的诱导和肿瘤对缺氧的反应在决定抗血管生成治疗的疗效方面起着重要的作用,但两者之间的联系尚不清楚。在这里,发现乳酸积累在肿瘤环境的CRC和作为底物的组蛋白乳酸酰化,这一过程进一步诱导细胞增强糖酵解缺氧。对贝伐单抗治疗具有抗性的CRC患者呈现升高的组蛋白乳酸化水平,并且组蛋白乳酸化的抑制有效地抑制CRC肿瘤发生、进展和在缺氧中的存活。组蛋白乳酸化促进RUBCNL/Pacer的转录,通过与BECN 1(beclin 1)相互作用促进自噬体成熟,并介导III类磷脂酰肌醇3-激酶复合物的募集和功能,其在缺氧癌细胞增殖和存活中起关键作用。此外,在贝伐珠单抗抗性患者衍生的临床前模型中,将组蛋白乳酸化和巨自噬/自噬的抑制与贝伐珠单抗治疗组合显示出显著的治疗功效。这些发现为代谢重编程-表观遗传调控提供了新的探索和重要补充,并为通过抑制组蛋白乳酸化提高贝伐珠单抗在结直肠癌中的临床疗效提供了新的策略。
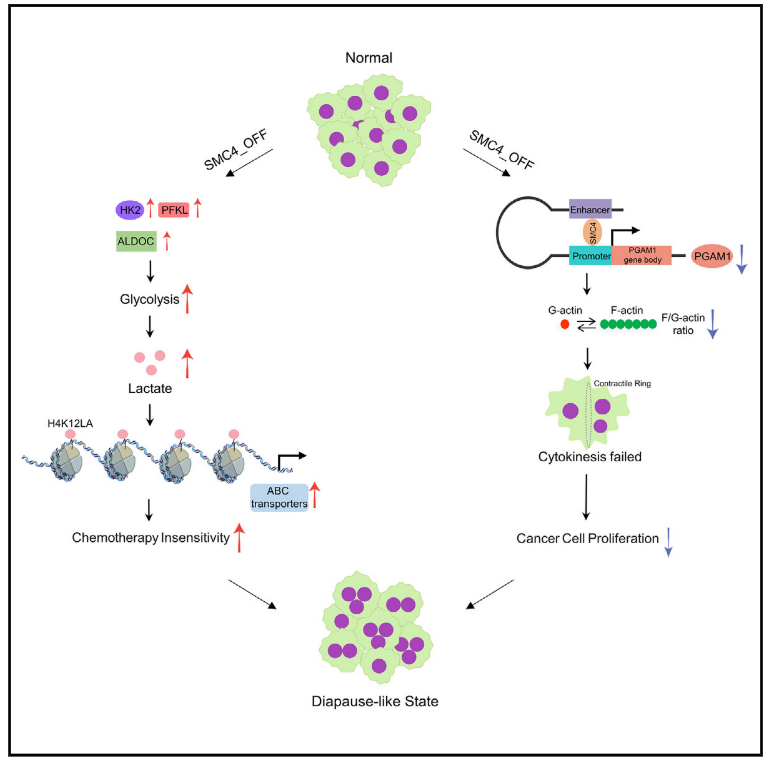
5.SMC4减少诱导的滞育样结直肠癌细胞具有低增殖和化疗不敏感的特征

摘要
为了应对不利的环境条件,胚胎发育可能会可逆地停止,这一过程称为滞育。最近的报道将这一现象与肿瘤对化疗的非遗传反应联系起来,但所涉及的机制知之甚少。在这里,建立了4号染色体结构维持(SMC4)在结肠直肠癌细胞向滞育样状态转换中的多种作用。SMC4减弱促进三种投资期糖酵解酶的表达,增加乳酸产生,同时还抑制磷酸甘油酸变位酶1(PGAM1)。所得的高乳酸水平通过组蛋白乳酰化增加ABC转运蛋白表达,使得肿瘤细胞对化疗不敏感。SMC 4充当PGAM 1转录的共激活因子,并且SMC4和PGAM 1的协调丢失影响F-肌动蛋白组装,诱导胞质分裂失败和多倍体,从而抑制细胞增殖。这些对非遗传性化疗耐药性机制的见解可能对该领域具有重大意义,推进对肿瘤中有氧糖酵解功能的理解,并可能为未来的治疗策略提供信息。