FAT4过表达在宫颈癌中促进抗肿瘤免疫的复杂机制——调节β-catenin/STT3/PD-L1轴
FAT4(FAT非典型钙粘蛋白4)是钙粘蛋白相关蛋白家族的一员,已被证明通过抑制增殖和转移而发挥肿瘤抑制作用。Wnt/β-catenin通路激活与PD - L1相关的肿瘤免疫逃逸高度相关。在这里,作者报告FAT4过表达通过β-catenin依赖的方式抑制PD-L1 N-糖基化和细胞膜定位来调节宫颈癌抗肿瘤免疫的机制。首次在宫颈癌组织和细胞系中检测到FAT4的表达。通过细胞增殖、克隆形成和免疫荧光测定体外FAT4过表达对肿瘤的抑制作用,并在免疫缺陷和免疫完整小鼠异种移植物中证实这一发现。通过体内和体外功能和机制实验,作者研究FAT4过表达如何通过β-catenin/STT3/PD-L1轴影响抗肿瘤免疫。FAT4在宫颈癌组织和细胞系中下调。作者确定FAT4与β-catenin结合并拮抗其核定位,通过降解配合物(AXIN1,APC,GSK3β,CK1)促进β-catenin的磷酸化和降解。FAT4过表达在转录水平上降低程序性死亡配体1(PD-L1)mRNA的表达,并在翻译后修饰(PTMs)水平上通过STT3A导致PD-L1异常糖基化,导致其内质网(ER)积累和多泛素化依赖性降解。作者发现,在免疫反应性小鼠模型中,FAT4过表达以β-catenin依赖的方式促进PD-L1异常糖基化和降解,从而增加细胞毒性T淋巴细胞(CTL)活性。这些发现解决Wnt/β-catenin通路在宫颈癌中激活的基础,并提供针对FAT4/β-catenin/STT3/PD-L1轴的联合免疫治疗方案。本文于2023年9月发表于《Journal of Experiment and Clinical Cancer Research》 IF:11.3期刊上。
技术路线
主要实验结果
1、FAT4在宫颈癌组织和宫颈癌细胞中下调
人类FAT4基因编码4924-aa蛋白,具有细胞外34个Cadherin重复序列,4个EGF样结构域和2个层粘连蛋白G样结构域(图1A)。使用cBioPortal在线工具对TCGA数据库进行分析并且FAT4在人类肿瘤,尤其是鳞状细胞癌中经常发生突变或缺失,这意味着FAT4失调是人类实体肿瘤中普遍存在的改变。对宫颈鳞状细胞癌和宫颈内腺癌(CESC)数据集的进一步分析显示,肿瘤样本中的FAT4 mRNA水平显著低于正常组织(图1B)。随后,在12组人宫颈癌组织和子宫颈癌周组织(PT)中检测FAT4的表达,结果显示,宫颈癌组织中的FAT4蛋白水平显著低于癌周组织(图1C)。为进一步证实这些结果,作者对50例宫颈癌患者和20例正常宫颈标本进行免疫组织化学分析。在正常鳞状上皮组织和癌旁组织中,细胞质和细胞膜中均可见较强的FAT4免疫信号(图1D),而在宫颈癌组织中,FAT4低表达(78%对22%,图1F)。根据免疫组化评分(IRS)将FAT4的表达分为低表达组(IRS≤3)和高表达组(IRS≥4)。Kaplan-Meier生存分析结果显示,FAT4低表达的宫颈癌患者预后较差(Logrank P=0.0036,图1G)。本研究还研究FAT4表达与临床病理特征之间的关系,认为低FAT4表达与侵袭性和转移性特征有关,包括宫颈浸润深度、淋巴血管浸润和局部淋巴结转移。
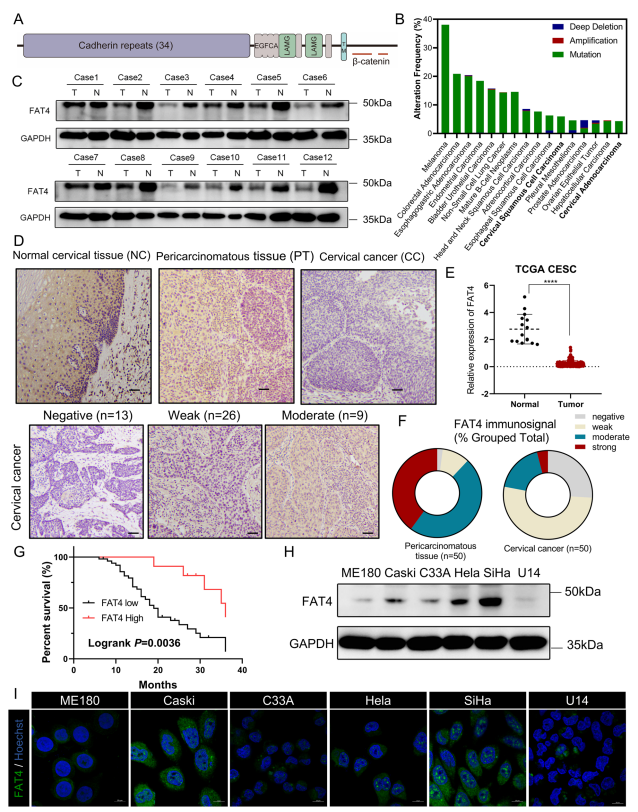
图1 FAT4在宫颈癌中下调并与预后不良相关
2、FAT4过表达抑制宫颈癌细胞和免疫缺陷小鼠的增殖
已有研究表明FAT4可抑制肿瘤细胞增殖,但其在宫颈癌中的作用尚不清楚。利用免疫荧光和免疫印迹技术检测6种宫颈癌细胞系中FAT4的表达,在ME180、C33A和U14细胞中FAT4的表达较低,在SiHa、Caski和Hela细胞中表达较高(图1H),但在上述细胞系中均未观察到FAT4的细胞膜定位(图1I)。由于FAT4全长蛋白分子量为543 kDa,作者采用缺陷cas9协同激活介质(dCas9-SAM)技术,利用短向导RNA (sgRNA)靶向FAT4启动子区,反式作用ME180宫颈癌细胞系,内源性促进FAT4的表达。作为对照,转染dCas9质粒和非靶向sgRNA序列(CTRL)。同样的方法促进U14小鼠宫颈癌细胞系中FAT4的内源性过表达(图2A和B)。由于FAT4是调节细胞粘附的钙粘蛋白超家族的成员,免疫荧光证实细胞膜上FAT4的表达增加(图2D),特别是在细胞与细胞接触的部位,这与FAT原钙粘蛋白家族对细胞间接触的调节有关。在ME180和U14宫颈细胞系中,FAT4过表达可显著抑制细胞增殖和集落形成效率,且具有时间依赖性(图2C、E和F)。
在体内研究中,作者选择sgFAT4单克隆(#H1),并将ME180宫颈癌细胞接种到免疫缺陷(BALB/c裸)小鼠中。与杂乱阴性对照组(CTRL、Cas9质粒和非靶向引导序列)相比,转染sgFAT4组的肿瘤体积明显减小(图2G和H)。此外,与CTRL组相比,sgFAT4组的生存时间更长(图2I)。作者在小鼠宫颈癌细胞系U14上重复上述实验,发现过表达FAT4可以抑制肿瘤生长(图2J和K),延长小鼠生存期(图2L)。这些数据表明,FAT4过表达抑制免疫缺陷小鼠的肿瘤增殖。
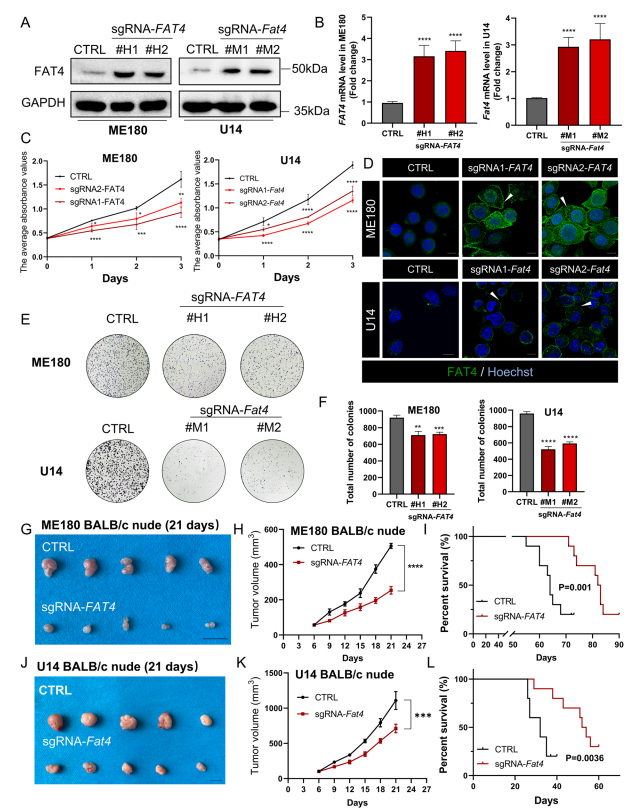
图2 在体外和体内,FAT4过表达均能抑制宫颈癌的增殖
3、在免疫能力小鼠中,FAT4增加CTL活性并改变肿瘤浸润淋巴细胞的特征
直观地,免疫缺陷BALB/c裸鼠中FAT4过表达可减小肿瘤大小,延长生存期(图2G-L)。然而,当将sgFat4细胞注射到同基因小鼠(C57BL/6)中时,sgFat4组的肿瘤生长和存活差异比免疫缺陷小鼠更明显。与CTRL组相比,注射后第3周左右,sgFat4组肿瘤体积明显缩小(图3A和B),sgFat4组存活时间比CTRL组延长(图3C)。此外,在注射sgFat4 U14细胞的同基因小鼠中,肿瘤生长缓慢。令人惊讶的是,注射后第四周左右,肿瘤从注射部位消退,表明FAT4过表达激活抗肿瘤免疫(图3D)。接下来,作者用免疫荧光证实,sgFat4组中ki67阳性细胞的比例明显低于CTRL组(图3E)。
为研究FAT4过表达激活抗肿瘤免疫的机制,作者在免疫正常的C57BL/6小鼠中构建皮下移植肿瘤,并在肿瘤消退前收集肿瘤进行进一步分析(局部注射后2周,图3F)。细胞毒性T淋巴细胞(CTLs)分泌高水平的穿孔素、颗粒酶B (GZMB)和干扰素-γ(IFN-γ),它们是抗肿瘤免疫的主要效应物。作者使用免疫荧光技术评估GZMB的释放,发现sgFat4组的GZMB+区域明显多于CTRL组(图3G - I)。由于GZMB在进入肿瘤细胞后靶向caspase-3和裂解caspase诱导凋亡,作者比较裂解caspase-3(CCA3)的水平,在CTRL小鼠的肿瘤组织中只有少数细胞发生凋亡,而在sgFat4小鼠中广泛观察到强烈的凋亡聚集信号(图3J和K)。
荧光活化细胞分选(FACS)显示,在sgFat4组中CD8+的比例更高(图4 A和B),CD8+CTL活性(CD8+ GZMB+和CD+ IFN-γ+)群体显著更高(图4 A和D)。同样地,作者发现CD4+CTL释放GZMB和IFN-γ水平相当高(图4 C和E)。由于癌细胞通过免疫检查点抑制CTL活性,作者继续研究FAT4过表达是否改善PD - L1介导的免疫逃逸。免疫荧光显示,在sgFat4组中,PD-L1的膜定位明显降低(图4F和G)。免疫组化(IHC)也支持上述发现,显示sgFat4组中CCA3蛋白水平显著升高,PD-L1蛋白水平显著降低(图4H和I)。实时定量PCR (RT-qPCR)证实,Cd274 mRNA水平在sgFat4组中较低(图4J)。PD-L1表达降低与活化肿瘤浸润CD8+ T细胞显著增加相关。在本节中,作者证明FAT4过表达阻止免疫缺陷小鼠的肿瘤进展,增加CTL活性,甚至促进C57BL/6免疫活性小鼠的肿瘤退化,这表明完整的免疫系统增强FAT4过表达的抗肿瘤效果。

图3 体内FAT4过表达促进抗肿瘤免疫
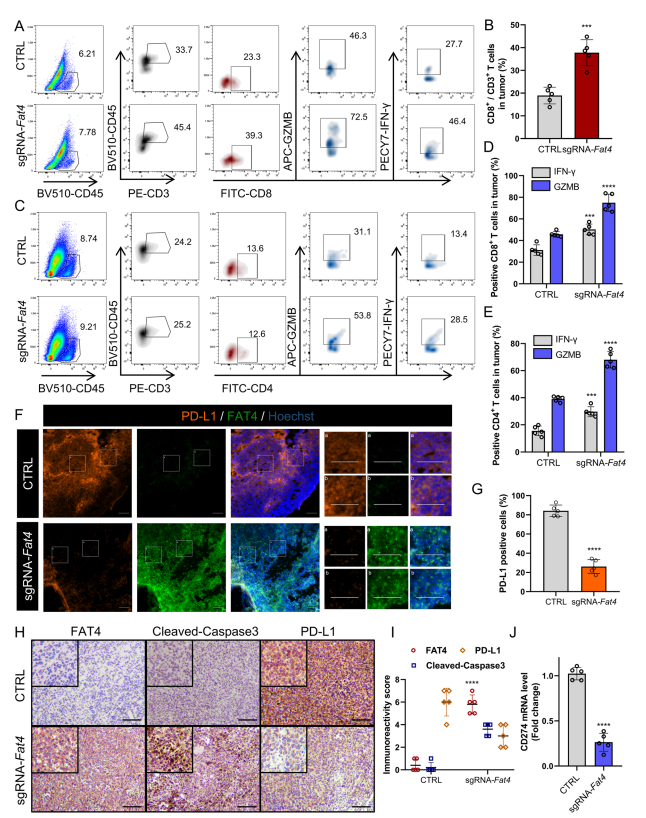
图4 在免疫反应小鼠模型中,FAT4过表达激活CTL并抑制PD-L1表达
4、FAT4结合β -catenin并促进其在宫颈癌细胞中的降解
为确定FAT4介导的肿瘤抑制的下游信号通路,作者对C33A和ME180人宫颈癌细胞系的sgFAT4和非靶向sgRNA序列(CTRL)进行RNA测序。根据KGEE富集分析,差异改变主要包括淋巴细胞活化、细胞外基质相关粘附途径、N-聚糖生物合成和淋巴细胞受体途径(图5A)。有证据表明,FAT4同源物原钙粘蛋白家族FAT1在内皮损伤修复和人肿瘤细胞中与β-catenin结合。但FAT4和β-catenin之间是否存在这种相互作用尚不清楚。作者首先证实在ME180(图5B)中,FAT4过表达与细胞膜上的β-catenin结合。通过共免疫沉淀证实内源性FAT4在ME180和U14宫颈癌细胞中与β-catenin结合(图5C)。
降解复合物(AXIN,GSK3β,CK1α,APC)介导细胞质中β-catenin的磷酸化,促进其泛素化和随后的蛋白酶体降解。通过免疫沉淀,作者发现FAT4过表达组与CTRL组相比,降解复合物与β-catenin的结合明显增强(图5D)。类似地,活性β-catenin的表达显著降低,这对于β-catenin通过典型Wnt信号介导转录活性至关重要。相应地,总β-catenin、磷酸化依赖性GSK3β稳定以及Wnt靶基因MMP9、C-Myc和cyclin D1的表达均被显著抑制(图5E)。由于β-catenin的核定位明显减少,作者使用TOPFlash/FOPFlash荧光素酶报告基因法评估β-catenin的转录活性,在sgFAT4组中,β-catenin介导的转录明显减少(图5F)。这些发现在C57BL/6免疫反应性小鼠移植肿瘤中也得到证实,其中免疫组织化学染色显示细胞核中活性β-catenin阳性信号显著减少,同时总β-catenin染色减少(图5G和H)。这些数据表明FAT4作为Wnt/β-catenin信号的抑制因子,在细胞膜上“捕获”β-catenin并促进其降解。
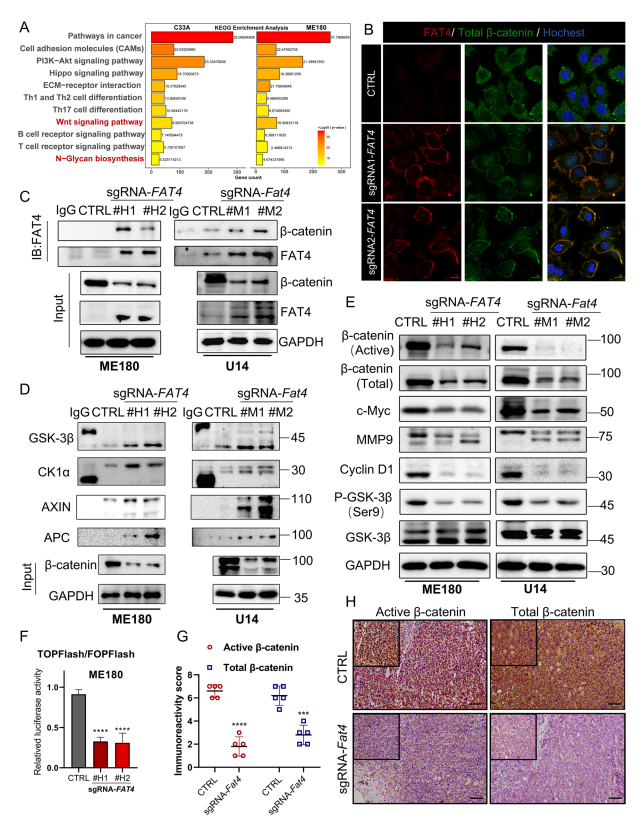
图5 FAT4过表达抑制宫颈癌细胞中Wnt/β-catenin通路
5、FAT4过表达抑制PD‑L1表达和细胞膜定位
Wnt/β-catenin通路被异常激活,促进免疫抑制的肿瘤微环境,同时促进免疫检查点PD-L1的表达和细胞膜定位,导致T细胞最终衰竭,失去关键功能。具体来说,β-catenin穿梭到细胞核,促进CD274和N糖基转移酶STT3的转录,从而促进PD-L1糖基化和ER-高尔基转运和成熟。
最近的研究表明,PD-L1在肿瘤细胞的膜上高度糖基化,并且PD-L1的N-糖基化,免疫印迹上的分子量约为45 kDa,这对于通过阻断PD-L1的泛素/蛋白酶体介导的破坏来稳定PD-L1蛋白至关重要。作者发现FAT4过表达降低N-糖基化PD-L1(45 kDa,黑点),而增加非糖基化PD-L1(33 kDa,黑色箭头,图6A)。基于体内实验结果,作者同样发现FAT4过表达在蛋白和mRNA水平上显著降低STT3A和PD-L1的表达(图6A、C和D)。
由于PD-L1的活性形式定位于细胞膜上,作者试图证明FAT4如何影响PD-L1的亚细胞定位。免疫荧光证实CTRL PD-L1主要位于细胞膜上(图6B,白色箭头),相反,sgFAT4 PD-L1信号在细胞质检测到(图6B,红色箭头),膜上信号减少。流式细胞术显示,FAT4过表达显著降低PD-L1细胞膜表达(图6E)。作者进一步研究FAT4过表达在体外以β-catenin依赖的方式降低PD-L1的表达。组成型活性β-catenin突变体(active β-catenin)的表达[28]增加PD-L1总蛋白表达和CD274 mRNA表达(图6F和G),促进PD-L1糖基化成熟(45 kDa,图6F)。值得注意的是,活跃的β-catenin表达消除FAT4过表达对CD274 mRNA的抑制作用(图6G)。这些发现表明,FAT4诱导的β-catenin失活导致肿瘤细胞中PD-L1的下调。在功能上,作者证明细胞膜上PD-L1表达的减少导致PD-1结合的显著减少(图6H和I)。总的来说,这些结果表明,FAT4过表达以β-catenin依赖的方式降低癌细胞中PD-L1的水平。

图6 FAT4过表达抑制PD-L1表达和细胞膜定位
6、FAT4过表达诱导PD - L1异常糖基化并阻止其ER-to-Golgi易位
内质网(ER)管腔在细胞内运输过程中膜糖蛋白的特殊糖基化与高尔基转运密切相关。糖基化的PD-L1增加蛋白质的稳定性,蛋白质的半衰期比未糖基化的PD-L1至少长4倍。接下来,作者进行半衰期分析,正如预期的那样,PD-L1的半衰期在FAT4过表达的细胞中缩短(图7A)。PD-L1与高尔基标记物(TGN38)和内质网标记物(Calregulin,CALR)共染色显示,CTRL而非sgFAT4 PD-L1 与高尔基标记物共定位,sgFAT4而非CTRL PD-L1与内质网标记物共定位(图7B和C)。这表明FAT4阻断PD-L1的ER-高尔基转运,从而诱导PD-L1在内质网中的积累。寡糖转移酶复合物(OST)催化亚基STT3是PD-L1糖基化和蛋白质稳定所必需的,而β-catenin与转录因子TCF7L2结合是诱导STT3A/B转录所必需的。糖基化稳定PD-L1并保护PD-L1免受GSK3Β介导的26S蛋白酶体依赖性泛素化降解。正如预期的那样,在FAT4过表达细胞中,内源性PD-L1泛素化显著增加(图7D)。作者发现FAT4过表达降低STT3A-PD-L1相互作用,同时增加GSK3β-PD-L1相互作用,表明FAT4以β-catenin依赖的方式抑制PD-L1的起始糖基化(图7E)。这些数据表明,FAT4导致内质网中非糖基化的PD-L1经历GSK3 Β介导的蛋白酶体泛素化降解。

图7 FAT4过表达诱导PD-L1异常糖基化并阻止其ER-to-Golgi易位
结论
在本研究中,作者证明FAT4过表达以β-catenin依赖的方式抑制PD-L1转录和进一步的糖基化修饰。RNA-seq数据表明,FAT4调控N -聚糖的生物合成。具体来说,FAT4可以通过ER相关的N -糖基转移酶STT3A引起PD-L1的异常N -链糖基化和ER保留,阻止PD-L1转运到膜上。作者证实FAT4能够促进GSK3β与PD-L1的相互作用和进一步的泛素化依赖性降解。功能上,通过T细胞介导的癌细胞杀伤实验和PD-L1/PD-1结合实验,作者证明FAT4在肿瘤细胞中的过表达通过下调PD-L1水平显著激活CTL活性。因此,这项研究揭示肿瘤PD-L1调控的分子机制。最后,作者在宫颈癌中发现一个新的FAT4蛋白表达谱,并表明FAT4调节免疫编辑,这表明FAT4/β-catenin/STT3/PD-L1信号轴可能是宫颈癌的潜在靶点。
实验方法
生物信息学分析;细胞培养;FAT4过表达细胞系的建立;CTL谱的FACS分析;免疫荧光;蛋白提取;WB;共免疫沉淀;T细胞介导的肿瘤细胞杀伤试验;PD-1和PD-L1结合试验;免疫组化;Kaplan - Meier生存分析;RNA分离和qRT - PCR;细胞增殖和集落形成;细胞增殖试验;质粒转染及荧光素酶活性测定。
参考文献
Wang D, Wu S, He J, Sun L, Zhu H, Zhang Y, Liu S, Duan X, Wang Y, Xu T. FAT4 overexpression promotes antitumor immunity by regulating the β-catenin/STT3/PD-L1 axis in cervical cancer. J Exp Clin Cancer Res. 2023 Sep 1;42(1):222. doi: 10.1186/s13046-023-02758-2.






