STING独立于其天然免疫功能的新功能——作为代谢检查点促进抗肿瘤免疫

逃避抗肿瘤免疫是癌症的标志。STING是公认的固有免疫信号转导接头,通过协调髓系细胞的固有感知和适应性免疫监视,在增强抗肿瘤免疫中发挥关键作用。STING在多种人类恶性肿瘤中显著沉默,并作为细胞内在的肿瘤抑制因子发挥作用。然而,STING如何发挥内在抗肿瘤活性尚不清楚。本研究中作者发现STING限制有氧糖酵解,而不依赖于其固有免疫功能。机制上,STING靶向己糖激酶II(HK2),阻断其己糖激酶活性。因此,STING通过抑制HK2抑制肿瘤有氧糖酵解,促进体内抗肿瘤免疫。该研究于2023年7月发表在《Nature Cell Biology》,IF:21.3。
技术路线
主要研究结果
1. STING抑制有氧糖酵解
在研究STING的功能时,作者发现,与野生型(WT)细胞相比,STING缺失的L929细胞培养液变黄的速度要快得多。作者推测STING可能调节有氧糖酵解。敲除L929细胞中的STING(图1a),发现与对照组相比,STING敲除细胞分泌的乳酸更多(图1b)。用HT-DNA和单纯疱疹病毒(HSV-1)感染细胞导致乳酸生成增加。值得注意的是,与对照组相比,STING缺失的L929细胞产生了更多的乳酸,但是HT-DNA刺激和HSV-1感染不能进一步促进乳酸生成(图1c,d)。用HSV-1刺激人单核细胞系THP-1,证实HSV-1感染后乳酸生成增加(图1e)。为了进一步验证这些结果,作者进行了STING的挽救实验(图1f),发现抑制了乳酸产生(图1g)。同样,HT-DNA刺激或HSV-1感染细胞,导致重新表达STING的细胞中乳酸生成增加(图1h,i)。这些数据都表明,STING抑制乳酸生产。Seahorse分析显示,WT和STING缺失细胞的胞外酸化率(ECAR)相似。加入葡萄糖和寡霉素后,STING缺失细胞的ECAR提高(图1j),表明STING缺失的L929细胞的糖酵解能力上调。又进行STING挽救实验,发现STING缺失细胞中STING的重建又抑制ECAR,再次证实STING抑制有氧糖酵解(图1k)。这些数据表明STING抑制有氧糖酵解和乳酸生成。

图1. STING抑制有氧糖酵解
2. STING独立于其固有作用限制糖酵解
在STING缺失的细胞中,转染两种明确定义的STING突变体(S366A和R238A),S366A突变会阻止IRF3的募集,而R238A突变会破坏cGAMP的结合(图2a,d)。检测细胞乳酸含量,发现S366A和R238A突变体的重新表达与WT STING一样有效地抑制乳酸生成(图2b,e),这个结果暗示STING的固有免疫功能对于其限制糖酵解活性来说不是必要的。HT-DNA刺激或HSV-1感染细胞,发现S366A突变体细胞中乳酸产生增加(图2c)。R238A突变由于破坏了cGAMP结合,因此HT-DNA刺激或HSV-1感染不能促进STING(R238A)重建细胞的乳酸生成(图2f)。这些数据表明,STING的固有免疫功能对于抑制糖酵解不是必要的。对敲除Cgas的L929细胞进行挽救实验,用HT-DNA刺激或HSV-1感染细胞,发现乳酸产量增高(图2h,i)。进一步证明STING抑制有氧糖酵解独立于其固有免疫功能。
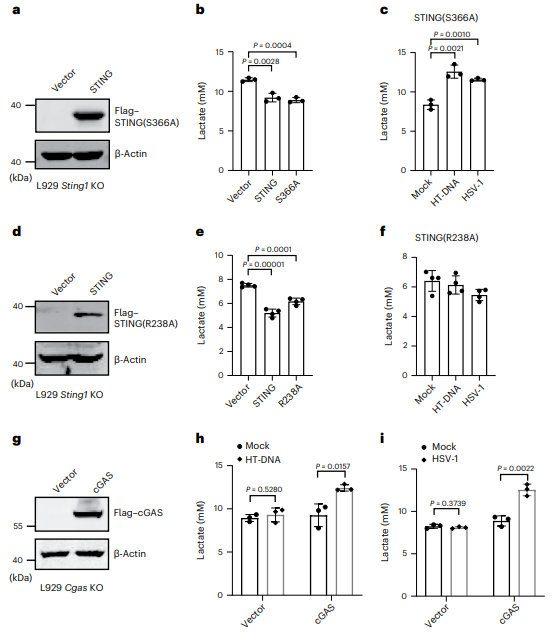
图2. STING独立于其固有作用限制糖酵解
3. STING通过靶向HK2抑制有氧糖酵解
为全面了解STING对代谢的影响,在L929细胞中敲除STING并进行代谢组学分析。发现敲除STING导致糖酵解途径出现显著富集(图3a)。并且,STING缺失导致细胞内糖酵解代谢物数量增加,包括果糖-6-磷酸、丙酮酸、果糖-1,6-二磷酸、甘油-3-磷酸(G3P)、磷酸二羟丙酮和乳酸(图3b)。用同位素标记的[U-13C]葡萄糖喂养对照和STING 1敲除的L929细胞,并监测碳通量。发现STING缺失导致糖酵解中间产物的标记增强(图3c)。这些结果证实STING抑制糖酵解。进行亲和纯化和蛋白质组学分析。发现STING结合蛋白中包括HK2,HK2在糖酵解过程中催化葡萄糖磷酸化产生葡萄糖6-磷酸的限速步骤(图3d)。通过免疫共沉淀和WB证实HK2和STING能形成复合体(图3e)。进行体外GST pull-down,并通过考马斯亮蓝染色证明纯化的STING与GST-HK2相关,而与GST无关,表明STING与HK2直接结合(图3f)。使用邻近连接实验(PLA)进一步证实内源性STING和HK2之间密切相关(图3g)。HK2通过n -末端线粒体结合基序与线粒体外膜结合,因此检测STING敲除细胞中线粒体代己糖激酶HK活性,发现在STING敲除的细胞中HK活性显著增加(图3h)。在STING缺失细胞中表达STING或STING(S366A)或STING(R238A)突变体,发现有效抑制HK活性,表明STING抑制HK2活性独立于它的先天免疫功能(图3i)。此外,用HT-DNA刺激或HSV-1感染细胞,发现HK2活性显著升高,而这些处理不能进一步上调STING敲除细胞中的HK活性(图3j,k)。这些数据表明STING与HK2相互作用并抑制HK2活性以限制有氧糖酵解。
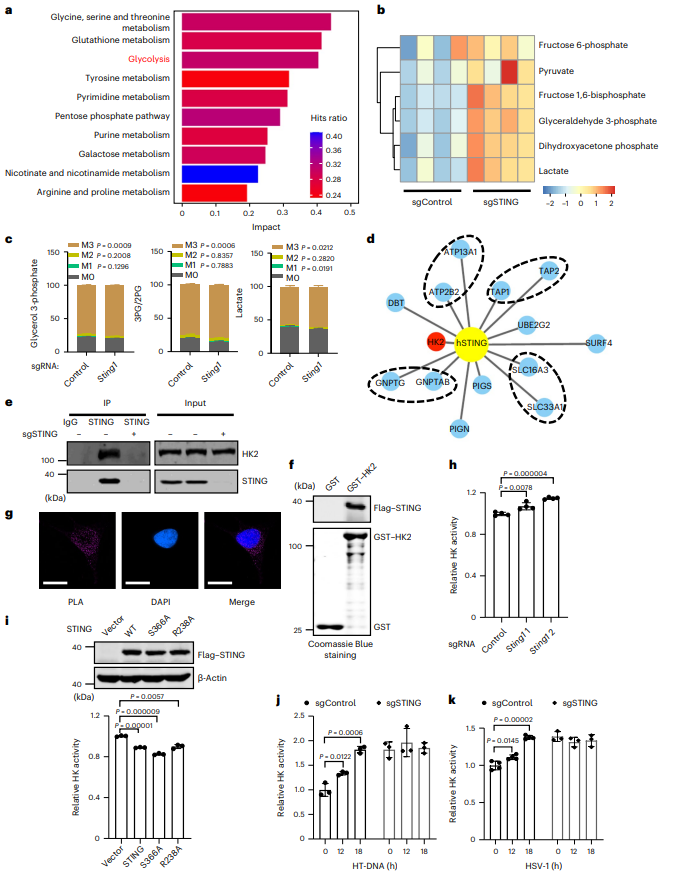
图3. STING通过靶向HK2抑制有氧糖酵解
4. STING抑制HK2的线粒体定位和活性
HK2的激活需要其线粒体定位。假设位于ER的STING抑制HK2并促进HK2从线粒体释放。为验证这一假设,分离线粒体和细胞质,发现STING的缺失确实导致HK2在线粒体中的分布增加和细胞质中HK2的分布减少(图4a)。免疫荧光染色发现在对照组细胞中约28%的HK2与线粒体相关;相比之下,在STING缺失细胞中约63%的HK2显示线粒体定位(图4b)。这些结果表明STING损害HK2的线粒体定位。此外,野生型STING、STING(S366A)或STIN(R238A)的恢复扰乱HK2的线粒体定位,并增加细胞质的HK2水平,表明抑制HK2的线粒体定位并不需要STING的固有免疫功能(图4c)。HK2通过与电压依赖性阴离子通道1(VDAC1)的相互作用与线粒体外膜结合。免疫共沉淀观察到HK2有效结合VDAC1。并且,STING的表达几乎消除了HK2和VDAC1之间的相互作用,表明STING破坏HK2 - VDAC1的关联,从而损害HK2的线粒体定位和活性(图4d)。将ΔN(1-14)突变体和P2A突变体重新导入STING缺失细胞,发现并没有抑制HK2的活性,作为对照,野生型STING、P8A和I10A/P11A突变体均能有效抑制HK2活性(图4f)。此外,在STING缺失细胞中重建WT STING、STING(P8A)或STING(I10A/ P11A)会损害HK2的线粒体定位,而STING(P2A)或STING(ΔN(1-14))的重新表达并未使HK2从线粒体室分离到细胞质部分(图4g)。这些数据表明STING的P2与HK2结合阻断HK2的线粒体定位和活性。

图4. STING抑制HK2的线粒体定位和活性
5. STING靶向HK2促进体内抗肿瘤免疫
STING是否在体内限制有氧糖酵解,作者转向两个广泛使用的MC38和CT26结直肠癌同系小鼠肿瘤模型。在MC38细胞中稳定表达STING可显著下调乳酸生成(图5a)。在MC38肿瘤模型中,STING的引入显著减缓肿瘤的生长(图5b,c),并下调肿瘤中乳酸的生成(图5d)。作者还发现在表达STING的肿瘤中,肿瘤浸润的CD8+T细胞的百分比增强,此外,在表达STING的MC38肿瘤中,约5%的CD8+T细胞为PD1和TIM3双阳性,而对照组中约为16%,表明T细胞群严重耗竭(图5e)。在严重免疫缺失且无法产生抗肿瘤免疫反应的NSG小鼠中进行了MC38肿瘤形成实验。STING表达并未抑制肿瘤生长(图5f,g),但在表达STING的肿瘤中,乳酸生成减少(图5h)。这些数据表明STING的免疫调节功能是其抗肿瘤活性的核心。在CT26细胞中敲除STING,乳酸的产生增加约20%(图5i,j)。并且STING缺失导致肿瘤负荷增加,肿瘤提取物中的乳酸增加(图5k,l)。与对照组相比,在STING缺失的肿瘤中,肿瘤内CD8+T细胞的丰度降低,而严重耗竭的CD8+T细胞群增加(图5m),表明STING缺失抑制抗肿瘤免疫。这些数据表明,STING在体内限制有氧糖酵解并增强抗肿瘤免疫。接下来,作者试图在体内建立STING对HK2的限制和STING的内在肿瘤抑制活性之间的因果关系。为验证这一点,作者转向两个不能结合并抑制HK2的STING突变体(ΔN(1-14)和P2A)。在MC38肿瘤模型中,WT STING延迟肿瘤的生长,而ΔN(1-14)和P2A突变没有延迟(图5n-p)。一致,ΔN(1 - 14)和P2A STING突变体失去MC38肿瘤中抑制乳酸生产的能力(图5q)。与WT STING相比,ΔN(1-14)和P2A突变没有增加肿瘤中淋巴细胞和CD8+T细胞的浸润(图5r)。这些数据表明STING靶向HK2抑制有氧糖酵解从而促进抗肿瘤免疫。

图5. STING靶向HK2促进体内抗肿瘤免疫
6. STING在已确诊的肿瘤中限制有氧糖酵解
构建MC38稳定细胞系,该细胞系能够表达多西环素诱导的STING(图6a)。将细胞移植到C57BL/6J小鼠皮下(n = 6)。植入后第8天,当肿瘤新生血管形成时,开始诱导STING表达。结果表明STING诱导表达显著抑制肿瘤生长,减少乳酸生产(图6b,c)。此外,STING诱导表达促进淋巴细胞和CD8+T细胞的浸润(图6d,e)。相比而言,STING(ΔN(1-14))和STING(P2A)突变体的诱导表达(图6f)并未抑制肿瘤生长,减少乳酸生成或促进抗肿瘤免疫(图6g-i)。为证实这些结果,构建CT26稳定细胞系,该细胞系可实现多西环素诱导的STING敲低(图6j)。对葡萄糖进行同位素标记,发现糖酵解中间体的同位素标记增强(图6l),肿瘤生长增强(图6k)。这些数据表明,在已建立的肿瘤中,STING限制有氧糖酵解以促进抗肿瘤免疫。

图6. STING在已确诊的肿瘤中限制有氧糖酵解
7. HK2是STING肿瘤抑制活性所必需的
耗尽HK2,如预期Hk2缺失大大降低乳酸分泌(图7a,b)。并且,与对照细胞相比,敲除STING不能增强HK2缺失细胞的乳酸生成,这表明STING限制依赖于HK2的糖酵解(图7c,d)。在CT26细胞中敲除STING,导致肿瘤负荷增强和乳酸水平升高,而敲除HK2延迟肿瘤生长并显著下调肿瘤中的乳酸水平。表明HK2基因敲除抑制STING基因敲除带来的的糖酵解和促肿瘤活性(图7e-h)。此外,STING的缺失降低肿瘤内CD8+T细胞的丰度,敲除HK2时,STING的免疫调节作用消失(图7i)。在这些组中,肿瘤内CD4+T细胞的分布没有显著变化(图7j)。这些数据表明,HK2对细胞内在的糖酵解限制和STING的肿瘤抑制活性是必需的。

图7. HK2是STING肿瘤抑制活性所必需的
8. STING调节人结直肠癌中的有氧糖酵解
为证实研究结果与临床相关性,作者分析了一组人类结直肠癌(CRC)样本。免疫组化和HE染色表明,与STING低表达的样本相比,STING高表达的样本显示出更高的T细胞和CD8+T细胞浸润(图8a)。并且发现结直肠癌样本中STING的表达与乳酸水平呈显著负相关,乳酸与CD8+T细胞浸润呈负相关,STING表达与CD8+T细胞浸润呈正相关(图8b)。这些结果与STING在限制有氧糖酵解和促进抗肿瘤反应方面的作用一致。
9. SNV(单核苷酸位点变异)STING(P2S)不能限制糖酵解
作者研究了天然存在的STING(P2S)突变体对糖酵解的影响。发现P2S突变体不能与HK2结合,在STING敲除的细胞中转染P2S,也不能抑制乳酸活性和HK活性(图8c-f)。在STING敲除细胞中转染P2S也不能将HK2从线粒体转移到细胞质中(图8g)。这些数据表明,天然存在的STING(P2S)突变失去靶向HK2和限制糖酵解的能力。

图8. 人结直肠癌中的乳酸水平与STING的表达和抗肿瘤免疫呈负相关,并且天然存在的STING(P2S)SNV失去限制HK2和糖酵解的能力
结论
综上所述,本研究发现,STING具有独立于其天然免疫功能的新功能,即作为细胞内在代谢检查点,通过靶向HK2阻断其己糖激酶活性,从而限制肿瘤的有氧糖酵解,促进体内抗肿瘤免疫。这一发现对开发基于STING的疗法来改善抗肿瘤免疫治疗具有重要意义。
实验方法
小鼠培养,细胞培养,质粒和载体构建,免疫沉淀和免疫印迹,小鼠肿瘤单细胞悬液的制备,流式细胞术,代谢组学和同位素示踪代谢组学,ECAR的测定,HK活性测定,乳酸测定,蛋白纯化,体外HK酶活性测定,GST pull-down实验,RNA提取和RT-qPCR,RNA-seq,荧光素酶报告实验,免疫荧光染色,PLA分析,免疫组化
参考文献
Zhang L, Jiang C, Zhong Y, Sun K, Jing H, Song J, Xie J, Zhou Y, Tian M, Zhang C, Sun X, Wang S, Cheng X, Zhang Y, Wei W, Li X, Fu B, Feng P, Wu B, Shu HB, Zhang J. STING is a cell-intrinsic metabolic checkpoint restricting aerobic glycolysis by targeting HK2. Nat Cell Biol. 2023 Aug;25(8):1208-1222. doi: 10.1038/s41556-023-01185-x. Epub 2023 Jul 13. PMID: 37443289.






