MiR-297通过靶向PTBP3抑制肝癌肿瘤进展
尽管越来越多的证据表明miR-297有助于肿瘤的发生和进展,但miR-297在肝细胞癌(HCC)中的作用及其潜在的分子机制仍不清楚。在这里,我们报道了在人羊膜上皮细胞(hAECs)条件培养基处理后,miR-297在hepG2细胞中的表达显著增加。而过表达miR-297在体外可抑制HCC细胞系的细胞增殖、迁移和侵袭,在体内可抑制HCC的发生。PTBP3在HCC细胞系中被鉴定为miR-297的直接靶基因,并介导miR-297在HCC细胞中的功能。临床样本中miR-297水平有降低的趋势。体外细胞实验证实,过表达miR-297可通过下调PTBP3表达抑制PI3K/AKT信号通路,从而抑制HCC细胞的增殖、迁移和侵袭。综上所述,我们的研究结果表明,miR-297可以下调PTBP3的表达,抑制PI3K/AKT信号通路的激活,从而阻止HCC的生长、迁移和侵袭。本文于2023年8月发表于“Cell Death Disease”(IF=9.0)上。
技术路线

结果
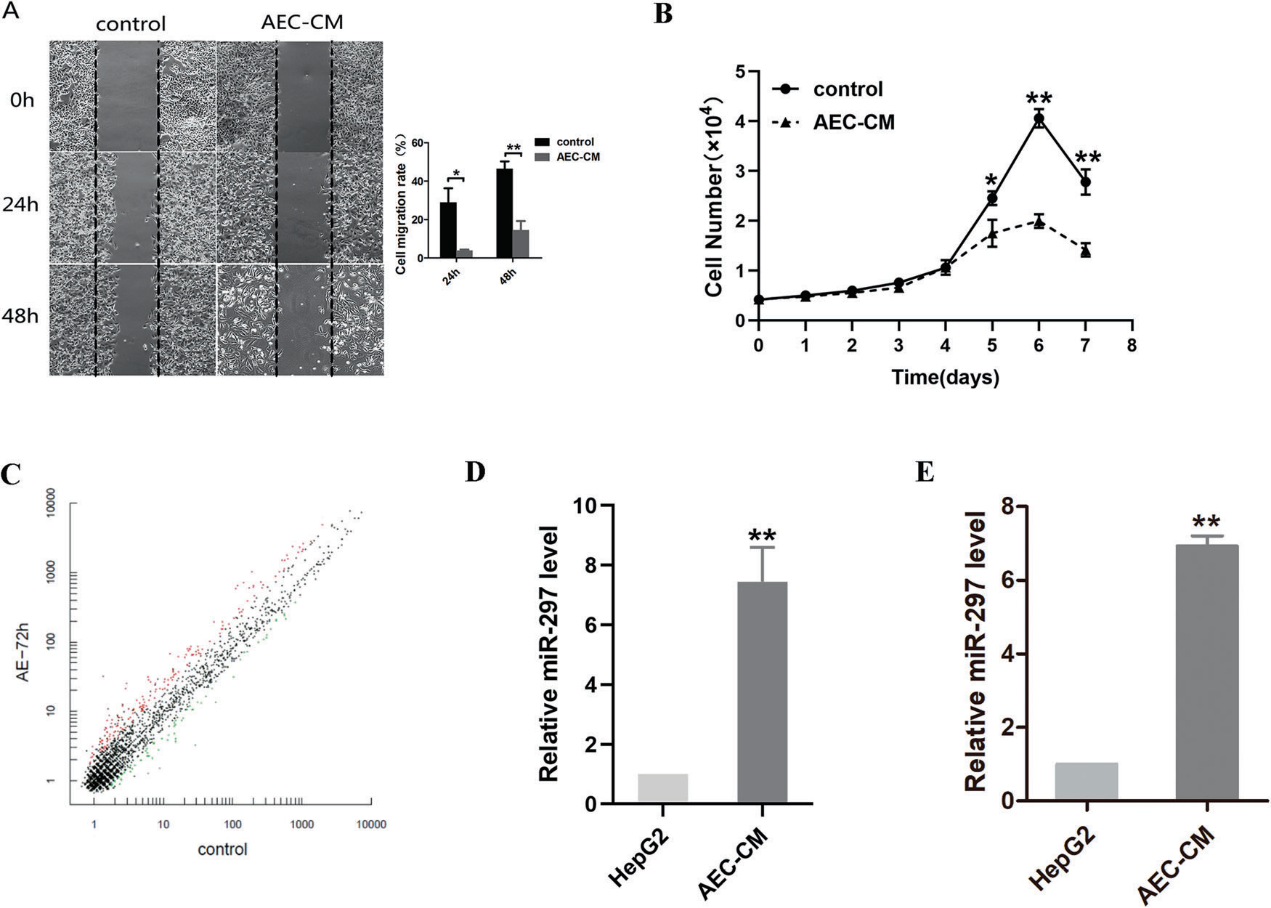
1)经hAEC-CM处理后,HepG2细胞中miR-297的表达升高
通过CCK-8和创伤愈合试验评估细胞增殖和迁移能力。用hAEC-CM处理可显著抑制HepG2细胞的生长和迁移(图1A, B)。为了确定生长抑制的机制,我们通过miRNA阵列和RT-qPCR验证了miRNA的差异表达(图1C)。通过miRNA阵列(图1D)和RT-qPCR(图1E)分别检测和验证了miR-297在hepG2中的表达,miRNA阵列的结果显示,miR-297的表达与对照组相比明显增加(图1D),我们通过RT-qPCR验证了hAEC-CM处理72 h后,miR-297在hepG2中的差异表达。RT-qPCR结果显示,hAEC-CM处理HepG2细胞72 h后,miR297的表达显著升高(图1E)。
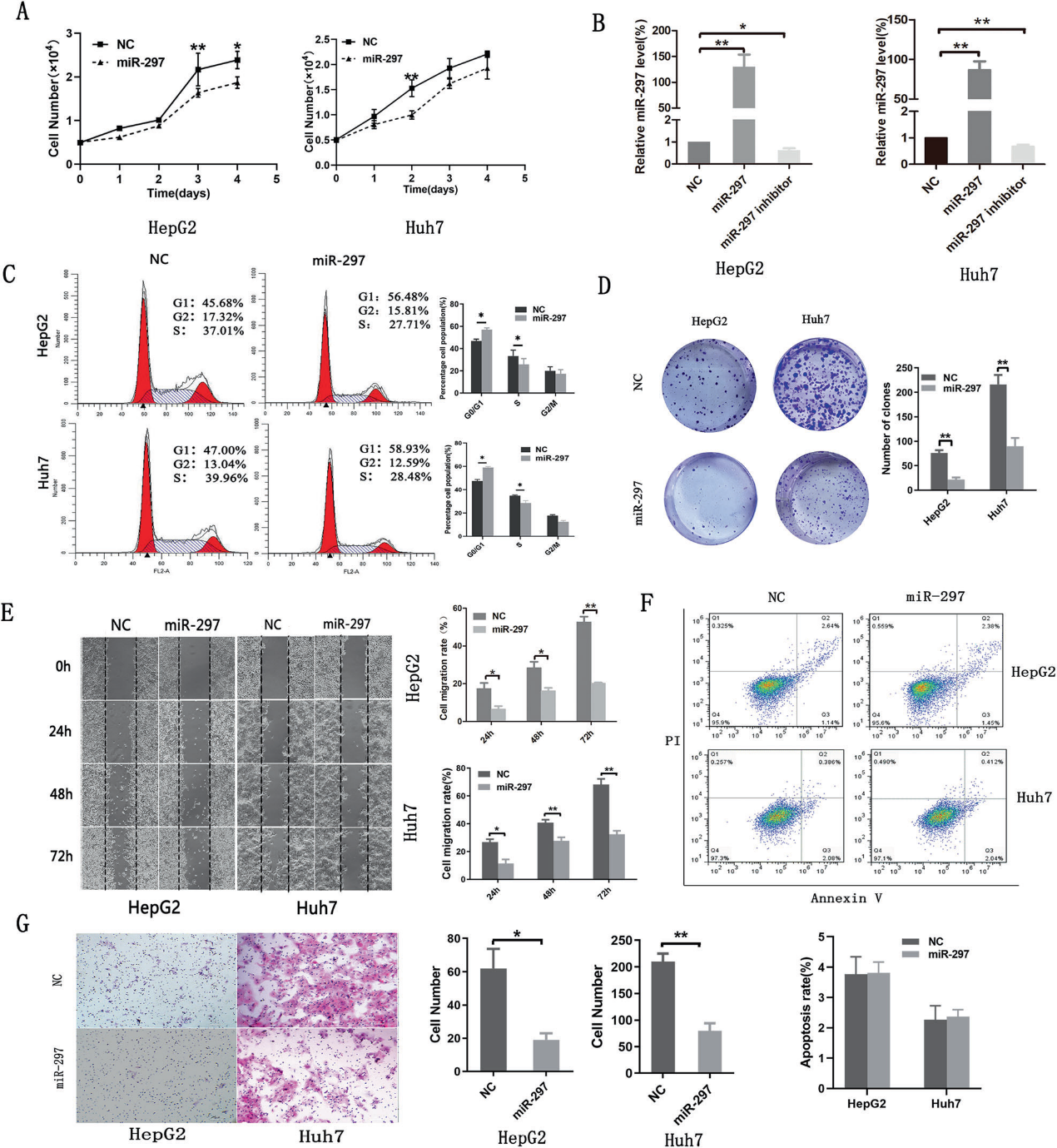
2)MiR-297在体外抑制HCC细胞系的增殖、迁移和侵袭
为了确定miR-297对肝癌细胞体外生长的影响,我们将miR-297模拟物、抑制剂和阴性对照引入肝癌细胞,包括HepG2和Huh7细胞。与阴性对照组相比,转染miR-297模拟物后,肝癌细胞系中miR-297的表达显著升高,而抑制剂处理的肝癌细胞中miR-297的表达显著降低(图2B)。细胞增殖能力通过CCK-8、菌落形成、细胞周期和细胞凋亡检测进行评价。过表达miR-297显著抑制了HepG2和Huh7细胞的生长(图2A)。转染miR-297的细胞在G0/G1期的比例显著高于对照组(图2C),表明miR-297通过抑制G2到S细胞周期的转变,在G0/G2期阻滞了细胞周期。此外,与对照组相比,转染组形成的菌落数量显著减少(图2D)。我们的结果显示,转染组(miR-297 mimic)和阴性对照组(miR-NC)之间的细胞凋亡没有显著差异(图2F)。转染后,HepG2和Huh7细胞的迁移和侵袭能力降低(图2E, G)。这些结果证实了miR-297在体外抑制肝癌细胞的增殖、迁移和侵袭。
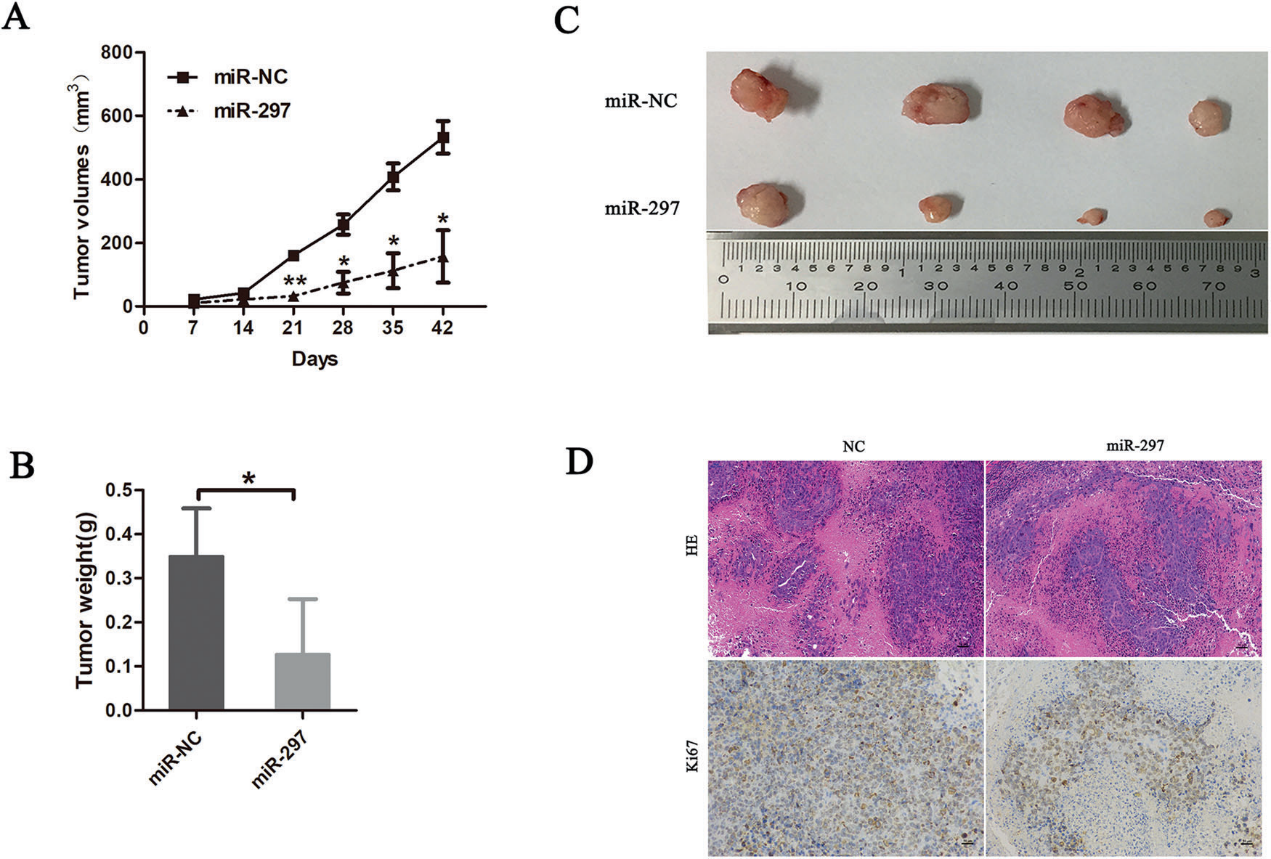
3)过表达miR-297可抑制HepG2细胞的体内肿瘤生长
由于miR-297在体外抑制HepG2和Huh7细胞的生长,我们进行了体内肿瘤形成实验。我们通过裸鼠皮下注射HepG2-miR-297细胞和对照细胞来评估miR-297的体内抗肿瘤功效。每周测量肿瘤体积,肿瘤植入后6周处死小鼠。从第21天开始,miR-297组的肿瘤体积明显低于对照组(图3A)。实验结束时,miR-297组的肿瘤平均重量明显低于对照组(图3B、C)。Ki67的表达弱于对照组的肿瘤(图3D)。这些结果表明miR-397在体内显著抑制肿瘤发生。
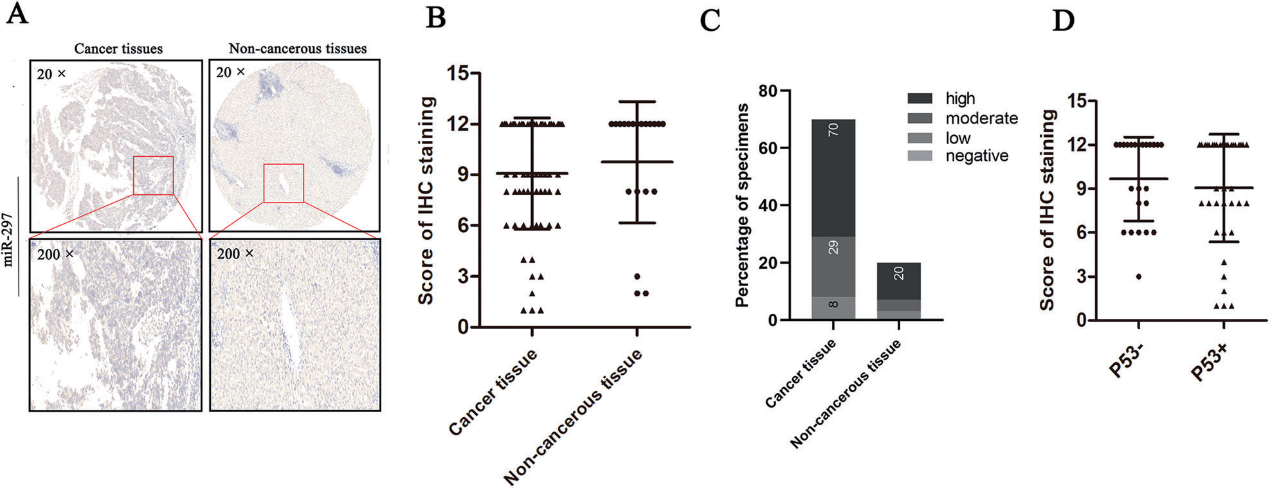
4)miR-297在人肝癌患者组织中的表达
为了研究miR-297在肝癌患者组织中的表达模式,我们进行了组织微阵列。结果显示,miR-297水平在癌组织中与非癌组织相比有降低的趋势,但差异无统计学意义(图4A, B)。并比较四组miR-297表达比例。结果显示四组癌变组织与非癌变组织的比例无显著差异(图4C)。根据p53的表达水平,将70例肝癌患者样本分为p53阳性组和p53阴性组。我们比较了两组,发现阳性组的miR-297水平较低(图4D)。
5)MiR-297靶向并下调PTBP3,抑制PI3K/AKT信号通路
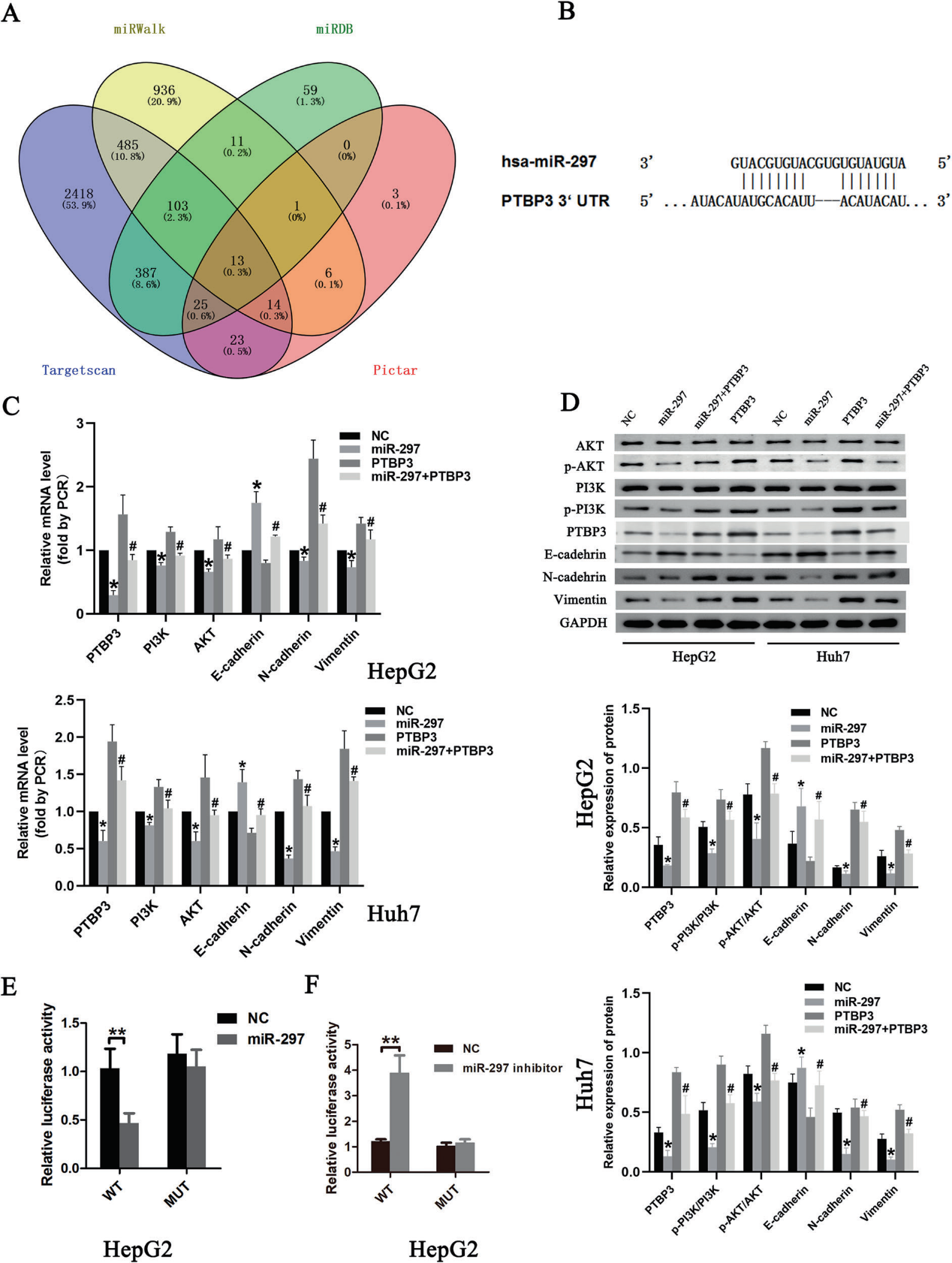
接下来,我们检索了四个在线miRNA靶点生物信息学预测数据库(TargetScan、PicTar、miRWalk和miRanda),以确定miR-297的候选靶基因。最初,在所有四个数据库中预测了miR-297的13个潜在基因(图5A)。所有四个数据库都预测PTBP3是miR-297的直接靶点。在PTBP3 mRNA的3 ' -UTR中发现了一个互补的miR-297序列(图5B)。过表达miR-297可下调HepG2细胞中PTBP3 mRNA和蛋白水平(图5C, D)。为了验证PTBP3是miR-297的真正下游靶点,我们进行了双荧光素酶报告基因实验。结果表明,转染miR-297模拟物显著降低PTBP3荧光素酶报告基因活性(图5E),而miR-297抑制剂具有相反的效果(图5F)。然而,当与突变的PTBP3报告基因共转染时,miR-297模拟物并没有抑制PTBP3的荧光素酶活性。结果强调了miR-297与PTBP3-3 ' -UTR的结合。
先前的报道表明,PTBP3在HCC中的作用很可能与Akt的磷酸化有关。为了验证,通过western blotting检测AKT、p-AKT、PI3K、p-PI3K的表达。我们发现miR-297模拟处理导致miR-297升高,但降低PTBP3、p-PI3K、AKT和p-AKT的表达以及p-AKT/ AKT比值;转染PTBP3质粒后,PTBP3、p-PI3K、AKT、p-AKT表达增加,p-AKT/AKT比值增加。相对于miR-297 mimic处理,miR-297 mimic+PTBP3质粒处理对miR-297的表达没有影响,但增加了PTBP3、p-PI3K和p-AKT的表达以及p-AKT/AKT比值(图5D)。这些结果表明miR-297可以特异性结合PTBP3-3 ' -UTR下调PTBP3表达,从而抑制PI3K/AKT信号通路。我们还对EMT相关基因进行了western-blot分析。我们发现miR-297过表达下调PTBP3、间质标记物(N-cadherin和Vimentin),但增强上皮标记物(E-cadherin),而PTBP3质粒转染导致PTBP3、N-cadherin和Vimentin表达增加,但降低E-cadherin表达(图5D)。MiR-297模拟物+PTBP3质粒处理恢复了EMT相关水平。综上所述,PTBP3过表达诱导HepG2和Huh7细胞发生EMT。miR-297在HCC细胞中的过表达可以通过下调PTBP3的表达来抑制EMT。
6)PTBP3表达降低可阻断PI3K/AKT信号通路,抑制肝癌细胞系体外增殖、迁移和侵袭
在确认PTBP3是HepG2细胞中miR-297的直接靶点后,我们进一步探讨了miR-297介导的PTBP3在HCC生物学功能中与PI3K/AKT信号通路的关系。我们首先将si-PTBP3和阴性对照(si-NC)转染HepG2细胞,以确定PTBP3的减少是否能抑制肿瘤细胞的增殖、迁移和侵袭。结果表明,转染si-PTBP3可抑制HepG2细胞的增殖(图6A)、迁移(图6C)和侵袭(图6D)。细胞周期阻滞在G0/G1期(图6B)。为了进一步证实PTBP3在miR-297对HepG2细胞抑制作用中的作用,我们将miR-297模拟物和PTBP3质粒共转染到HepG2细胞中,以确定PTBP3过表达是否可以逆转miR-297过表达对HepG2细胞进展的抑制作用。结果表明,PTBP3过表达逆转了miR-297过表达对HepG2细胞增殖(图6E)、迁移(图6G)和侵袭(图6H)以及细胞周期阻滞效应(图6F)的抑制作用。
此外,miR-297 mimic处理后,HepG2和Huh7细胞中p-PI3K、p-AKT和PTBP3的表达以及p-AKT/AKT比值均降低,而在miR-297抑制剂处理的HCC细胞中观察到相反的趋势。此外,相对于miR-297抑制剂治疗,进一步LY294002治疗不影响PTBP3表达,但导致HepG2和Huh7细胞中p-PI3K和p-AKT表达以及pAKT/AKT比值下降,而miR-297抑制剂+ si-PTBP3治疗导致p-PI3K、p-AKT和PTBP3表达降低(图6I)。CCK-8检测发现,在第3天和第4天,miR-297抑制剂诱导细胞生长,而LY294002或miR-297模拟治疗导致相反的趋势;与抑制剂处理相比,miR-297抑制剂+ si-PTBP3或miR-297抑制剂+ LY294002处理抑制了HCC细胞系的细胞增殖(图6J)。此外,miR-297抑制剂诱导HCC细胞的侵袭和迁移,而LY294002或miR-297 mimic转染则导致相反的趋势;相对于miR-297抑制剂治疗,miR-297抑制剂+ si-PTBP3或miR-297抑制剂+ LY294002治疗抑制HCC细胞的侵袭和迁移(图6K, L)。综上所述,这些结果支持miR-297过表达通过降低PTBP3,抑制PI3K/AKT信号通路,从而抑制HCC细胞的增殖、迁移和侵袭。

结论
我们证明过表达miR-297在体外抑制肝癌细胞的增殖、迁移和侵袭,在体内抑制肝癌细胞的肿瘤发生。在肝癌细胞中发现PTBP3是miR-297的直接靶基因。MiR-297可直接靶向PTBP3,灭活PI3K/AKT信号通路,抑制HCC细胞系的生长、迁移和侵袭。因此,miR-297可能是一个有效的潜在肝癌治疗靶点。
实验方法
RT-qPCR,Western blotting,荧光素酶报告试验,CCK-8,克隆形成实验,流式,伤口愈合及侵袭试验,裸鼠体内肿瘤发生实验,miR-297原位杂交,免疫组织化学染色,miRNA芯片分析。
参考文献
Lu N, Min J, Peng L, Huang S, Chai X, Wang S, Wang J. MiR-297 inhibits tumour progression of liver cancer by targeting PTBP3. Cell Death Dis. 2023 Aug 26;14(8):564. doi: 10.1038/s41419-023-06097-0.






