IKK1通过促进效应T细胞的分化加重肾缺血再灌注损伤
缺血再灌注损伤(IRI)是急性肾损伤(AKI)的主要原因之一,实验工作揭示了肾脏炎症反应的详细情况。T细胞和NFκB通路在IRI中起重要作用。因此,我们在IRI实验模型中研究了IKK1在CD4+T淋巴细胞中的调节作用和机制。CD4cre和CD4IKK1Δ小鼠诱导IRI。与对照组小鼠相比,CD4+T淋巴细胞中IKK1的条件缺失显著降低了血清肌酐、血尿素氮(BUN)水平和肾小管损伤评分。在机制上,CD4+T淋巴细胞中IKK1的缺失降低了CD4淋巴细胞向Th1/Th17细胞分化的能力。与IKK1基因消融类似,IKK的药理抑制也能保护小鼠免受IRI。总之,淋巴细胞IKK1通过促进T细胞分化为Th1/Th17在IRI中发挥关键作用,靶向淋巴细胞IKK1可能是IRI的一种新的治疗策略。本文于2023年4月发表于“Cellular and Molecular Life Sciences”(IF=9.207)上。
技术路线

结果:
1)IRI后肾脏中NFκB通路的激活
为了验证IRI期间肾脏中NFκB通路的激活,我们查询了在IRI后2h、4h、24h、48h、72h、7d、14d和28d时间点收集的小鼠肾脏大量RNA数据集(GSE98622)以及相应的假手术小鼠肾脏对照RNA,以检测9种NFκB激活基因的表达水平(NFκB激活评分)。与假手术组相比,IRI诱导后超过2h的所有时间点NFκB激活评分均上调(图1A, B)。此外,当我们对IRI后肾脏中Nfkb1、Nfkb2和Relb的表达进行RT-PCR分析时,这些基因的表达在IRI诱导后也显著增加(图1C)。
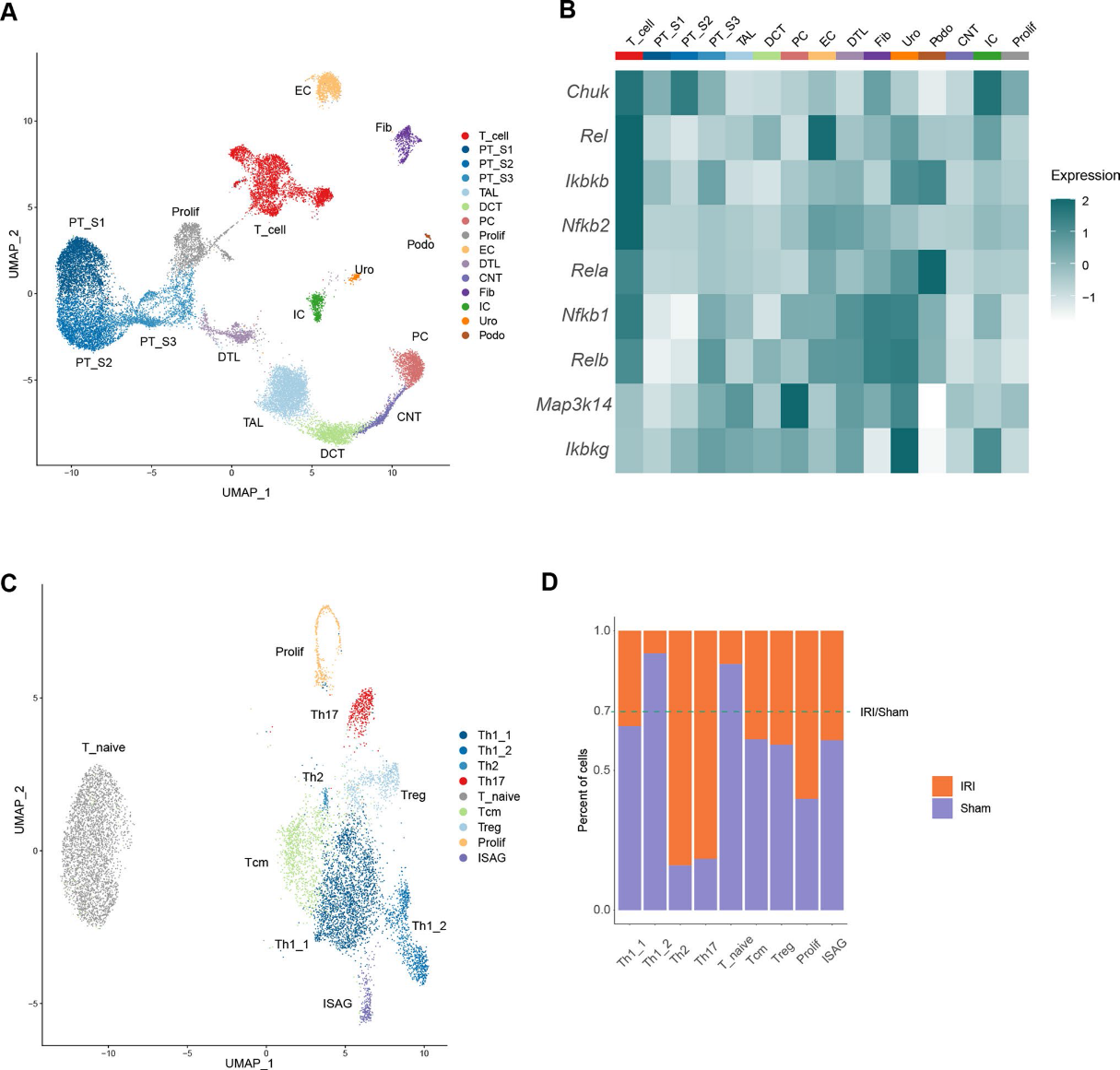
为了捕获IRI的肾细胞和肾CD4+T细胞景观,我们在IRI发生2天后整合了全小鼠肾脏在线单核RNA测序数据集(GSE139107)和CD4+T细胞单细胞RNA测序数据集(E-MTAB-8002)(图2A)。无监督聚类识别出IRI诱导后肾脏中的14个肾细胞簇和1个CD4+T细胞簇,包括上皮细胞和非上皮细胞。我们评估了所有细胞群中的NFκB激活评分,发现与所有细胞群相比,T细胞中的NFκB激活评分显著上调(图2B)。接下来,我们更精确地分析了IRI后2天的CD4+T细胞数据集(E-MTAB-8002),并与对照小鼠的CD4+T细胞整合。通过无监督聚类,我们确定了9个细胞群,包括Th1_1、Th1_2、Th2、Th17、Tnai (naïve T细胞)、Tcm(中枢记忆T细胞)、Treg(调节性T细胞)、Prolif(增殖T细胞)和ISAG (IFN信号相关基因高表达T细胞)(图2C)。为了剖析IRI对肾脏中CD4+T细胞组成的影响,我们比较了对照小鼠和IRI小鼠的CD4+T细胞亚群(图2D)。结果表明,Th17群体在炎症肾脏中更为丰富,表明该群体可能是IRI早期的重要致病因素。综上所述,这促使我们假设CD4+T细胞中NFκB的激活有助于IRI的发病机制。

2)CD4+T细胞中的IKK1驱动IRI
为了研究肾炎症过程中NFκB激活在CD4+T细胞中的功能作用,我们通过CD4cre与相应的flox小鼠杂交,特异性删除了激活CD4+T细胞中NFκB通路的关键分子IKK1(Chuk)、IKK2(Ikbkb)、NEMO(Ikbkg)和NIK(Map3k14)。与对照小鼠相比,CD4IKK1Δ小鼠的血尿素氮(BUN)水平和肌酐水平(功能性肾损害的代表性标志物)显著降低,而CD4IKK2Δ、CD4NEMOΔ和CD4NIKΔ小鼠则无显著差异(图3A、B)。此外,肾脏切片的形态学评估也显示CD4IKK1Δ小鼠肾小管损伤显著降低,而其他组则无显著差异(图3C、D)。在CD4IKK1Δ小鼠中,肾脏Nfkb1和Nfkb2基因表达也显著降低,这表明在CD4IKK1Δ小鼠中,NFκB通路的激活发生了显著变化(图3E)。综上所述,我们的数据表明,CD4+T细胞中的IKK1是IRI中肾组织损伤的主要驱动因素。

3)药理抑制IKK1可保护小鼠IRI
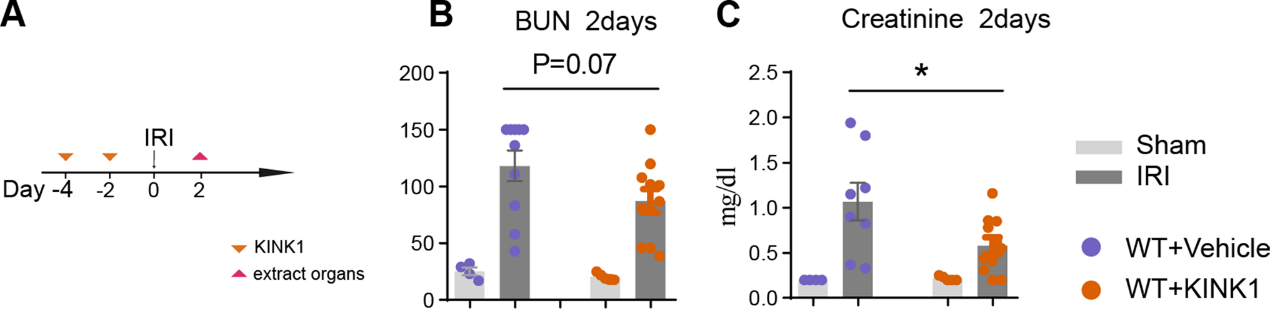
关于IKK1在IRI中的致病作用及其对CD4+T细胞分化过程的重要性,我们研究IKK1的药物阻断是否可以减轻肾损害。因此,我们在IRI诱导前后用IKK1/IKK2抑制剂KINK-1治疗小鼠,阻断IKK1的激活。(图4A)。诱导IRI后,与载药治疗相比,IKK1抑制降低了肾损伤的严重程度(图4B,4C)。
4)IKK1促进CD4+T细胞产生细胞因子
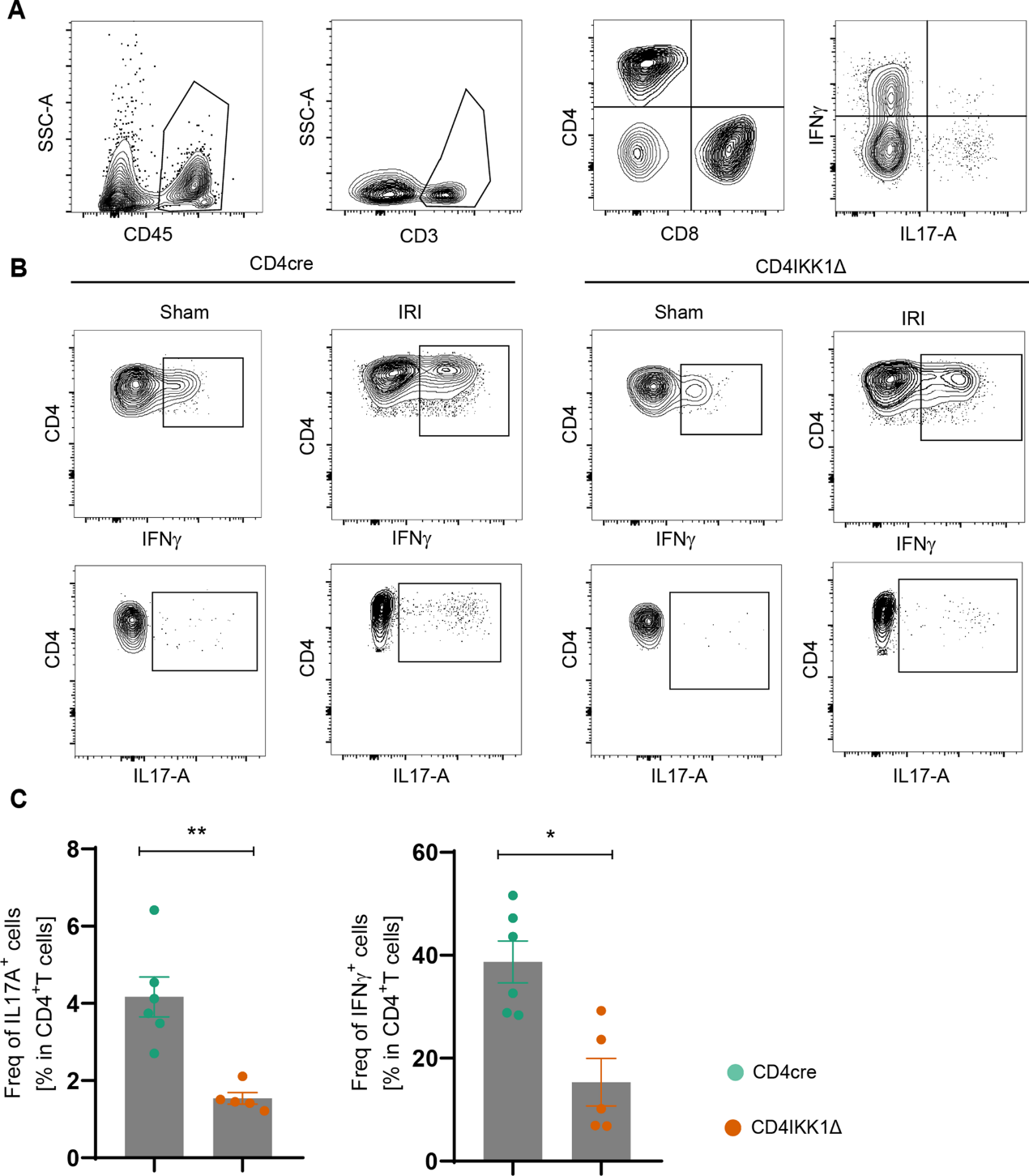
为了研究IKK1对IRI后肾CD4+T细胞细胞因子产生的影响,我们对浸润肾脏的免疫细胞进行了流式细胞术。基于流式细胞术的CD4cre和CD4IKK1Δ小鼠的白细胞染色显示,IRI诱导2天后,肾脏浸润的淋巴细胞中约40%是CD4+T细胞(图5A)。细胞因子染色结果显示,IRI诱导后,CD4IKK1Δ小鼠的IFN-γ和IL-17A的产生均增加,此外,与CD4cre小鼠相比,CD4IKK1Δ小鼠中这两种细胞因子的产生均显著减少(图5B, C)。综上所述,IKK1对Th1细胞和Th17细胞的分化具有主要的致病作用。
5)IKK1驱动CD4+T细胞的Th17和Th1/Th2分化
为了进一步探索淋巴样IKK1在IRI中致病作用的机制,我们进行了大量RNA测序,分析了IRI后CD4cre或CD4IKK1Δ小鼠肾CD4+T细胞的RNA转录组谱。从基因表达谱和整体表达相似性来看,各组个体重复具有高度同源性(图6A)。共识别248个DEG,其中下调基因228个,上调基因20个(图6B)。在下调的基因中,大多数与炎症相关,并富集KEGG术语“Th1和Th2细胞分化”、“Th17细胞分化”和“炎症性肠病”(图6C),而上调基因大多富集“ECM受体相互作用”、“凋亡”和“轴突引导”(图6D)。在“Th1/ Th2细胞分化”和“Th17细胞分化”中,Tbx21、Il2ra、Il17a和H2-Ab1的富集也符合对NFκB如何调节T细胞免疫应答的理解(图6E)。对肾脏Ifng、Tbx21、Cxcr3、Il17、Rorc和Ccr6基因表达的RT-PCR分析也证实了IRI后炎症肾脏中Th1和Th17的分化依赖于IKK1(图7)。综上所述,IKK1通过影响CD4+T细胞的分化在IRI中起着重要的致病作用,抑制CD4+T细胞中的IKK1可减轻IRI损伤。


结论
IKK1的抑制可以通过影响NFκB通路的激活来抑制CD4+T细胞向Th1和Th17细胞分化的能力,从而降低IRI损伤的程度。
实验方法
PAS染色,流式,qPCR,RNA测序,单细胞测序。
参考文献
Song N, Xu Y, Paust HJ, Panzer U, de Las Noriega MM, Guo L, Renné T, Huang J, Meng X, Zhao M, Thaiss F. IKK1 aggravates ischemia-reperfusion kidney injury by promoting the differentiation of effector T cells. Cell Mol Life Sci. 2023 Apr 19;80(5):125. doi: 10.1007/s00018-023-04763-2.






