靶向诱导细胞焦亡促进胶质母细胞瘤治疗
胶质母细胞瘤(GBM)是一种高度侵袭性的肿瘤,目前缺乏有效的治疗方法。细胞焦亡已成为一种有前途的癌症治疗方法,但仍需要新的焦亡促进剂来靶向癌细胞。本研究报道来源于植物的天然化合物芦荟大黄素(AE)可以通过诱导细胞焦亡抑制GBM细胞,使其成为焦亡介导的GBM治疗的潜在助推器。然而,由于血脑屏障(BBB)及其非选择性,给药AE具有挑战性。为克服这一障碍,开发了AE @ ZIF-8 NPs,一种生物矿化的纳米载体,可以响应肿瘤的酸性微环境(TAM)释放AE。进一步用转铁蛋白(Tf)和聚乙二醇-聚嵌段共聚物(乳酸-羟基乙酸)(PEG-PLGA)修饰纳米载体,分别提高其穿过BBB和肿瘤靶向性。结果表明,AE-NPs(Tf-PEGPLGA修饰AE @ ZIF-8 NPs)显著增加颅内分布和肿瘤组织蓄积,增强GBM焦亡。此外,AE-NPs激活抗肿瘤免疫并降低AE相关毒性。总的来说,本研究为GBM治疗提供了一种新的方法,并提供了一种能够穿透BBB、靶向肿瘤和减轻毒性的纳米载体。研究于2023年4月发表在期刊《Small》上,IF: 15.153。
技术路线:

主要研究结果:
1、AE抑制GBM细胞增殖,诱导细胞焦亡
芦荟大黄素(Aloe-emodin, AE)是一种具有抗肿瘤作用的天然单体化合物(图1A)。为探索AE潜在的抗GBM活性,作者对GBM人细胞系U87MG和GBM小鼠细胞系GL261给予AE。Cell Counting Kit 8(CCK-8)实验表明AE以时间和浓度依赖的方式抑制GBM细胞(图1B),并且AE处理的GBM细胞的形态表现出焦亡特异性特征,如细胞膜肿胀和起泡(图1C),提示AE可能诱导GBM细胞焦亡。由于细胞焦亡伴随着乳酸脱氢酶(lactate dehydrogenase,LDH)的胞外释放,为进一步证实AE诱导的细胞焦亡,作者下面检测AE处理的U87MG细胞中LDH的释放,结果显示LDH的释放随着AE浓度的增加而增加(图1D)。这些结果表明,AE抑制GBM细胞增殖并诱导细胞焦亡。
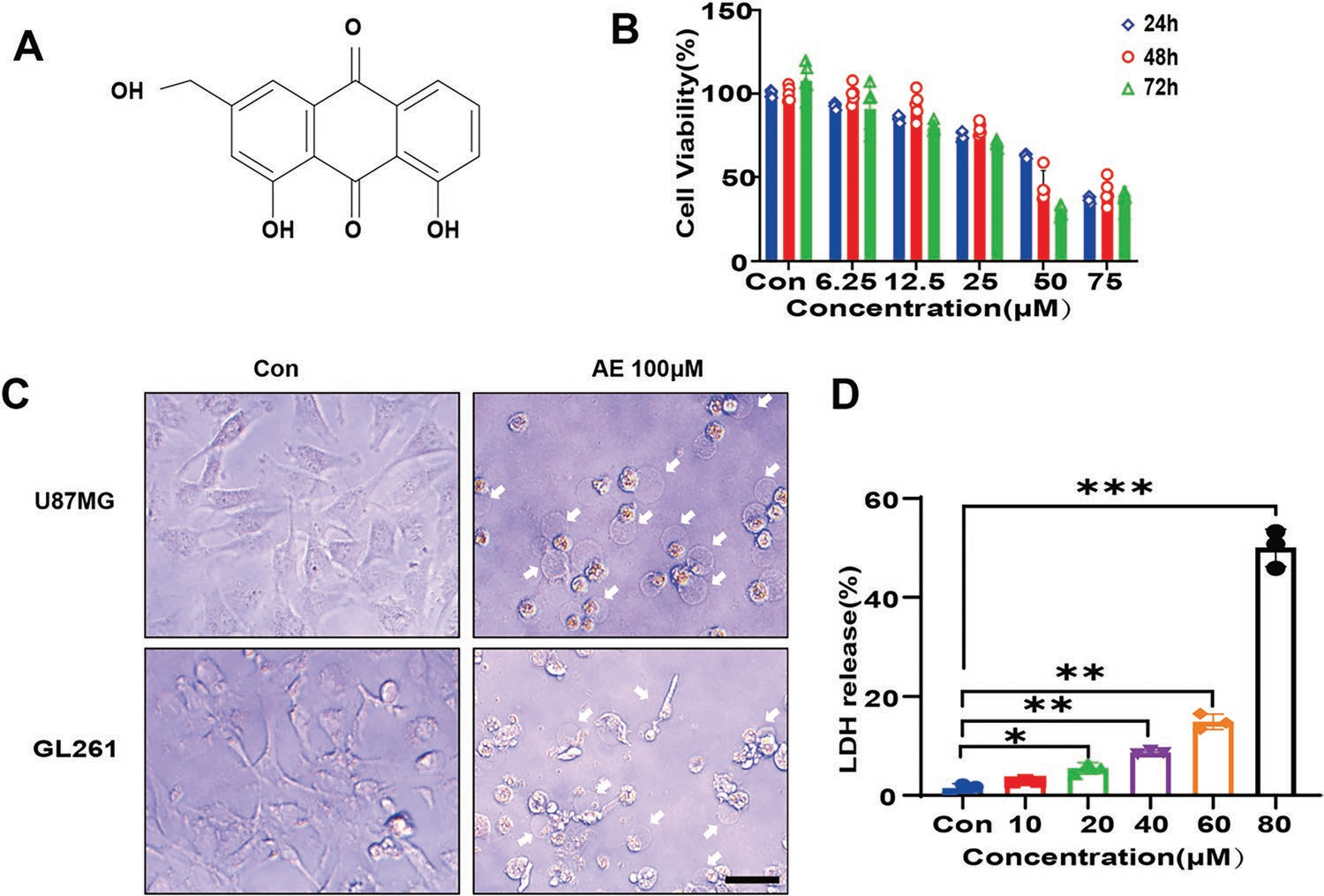
图1 AE诱导GBM细胞焦亡
2、AE激活GBM细胞中的CASP3 / GSDME焦亡通路
细胞焦亡主要通过caspase-1 / gasdermin D(CASP1 / GSDMD)途径或CASP3 / GSDME途径激活。为明确AE介导细胞焦亡的机制,进行AE-GBM网络药理学分析。与AE和GBM相关的重叠靶点的Venn图确定了44个GBM治疗AE的潜在靶点(图2A)。用STRING数据库对这44个靶点进行网络分析(图2B),PPI网络显示44个节点和473条边。作者接下来对每个节点进行分析,筛选出节点度大于23的前20个靶点。这些靶点包括AKT1、ALOX5、AKT2、BCL2L1、CASP3、CASP9、CDK2、CDK6。其中,CASP3是核心交集靶点之一(图2C)。由于CASP3是CASP3 / GSDME焦亡通路的关键蛋白,作者推测AE可能通过CASP3 / GSDME通路诱导GBM焦亡。体外研究证实AE诱导CASP3和GSDME的激活,但不诱导GSDMD(图2D-E)的激活,这与经典的焦亡诱导剂顺铂相似。
有报道显示GSDME的表达决定了细胞焦亡是否在化疗药物诱导的抗肿瘤过程中占主导地位。作者接下来通过Western blot(WB)和TCGA数据库分析GSDME在GBM细胞系和肿瘤组织中的表达情况。TCGA数据库(http://ualcan.path.uab.edu/index. html)分析结果显示,与其他肿瘤和正常脑组织相比,GSDME在GBM(图2F-G)中高表达。WB显示GSDME在HMO6(人小胶质细胞系)细胞中呈阴性表达,在人GBM细胞系U87MG、DBTRG中表达较高,其次是HepG2、Hela、A549,甚至在小鼠细胞中也有表达。最重要的是,GSDME在GBM细胞系GL261中的表达高于小胶质细胞系BV2(图2H)。这些结果提示GSDME通过激活CASP3 / CASP3 / CASP3 / CASP3是抗GBM治疗的良好靶点。
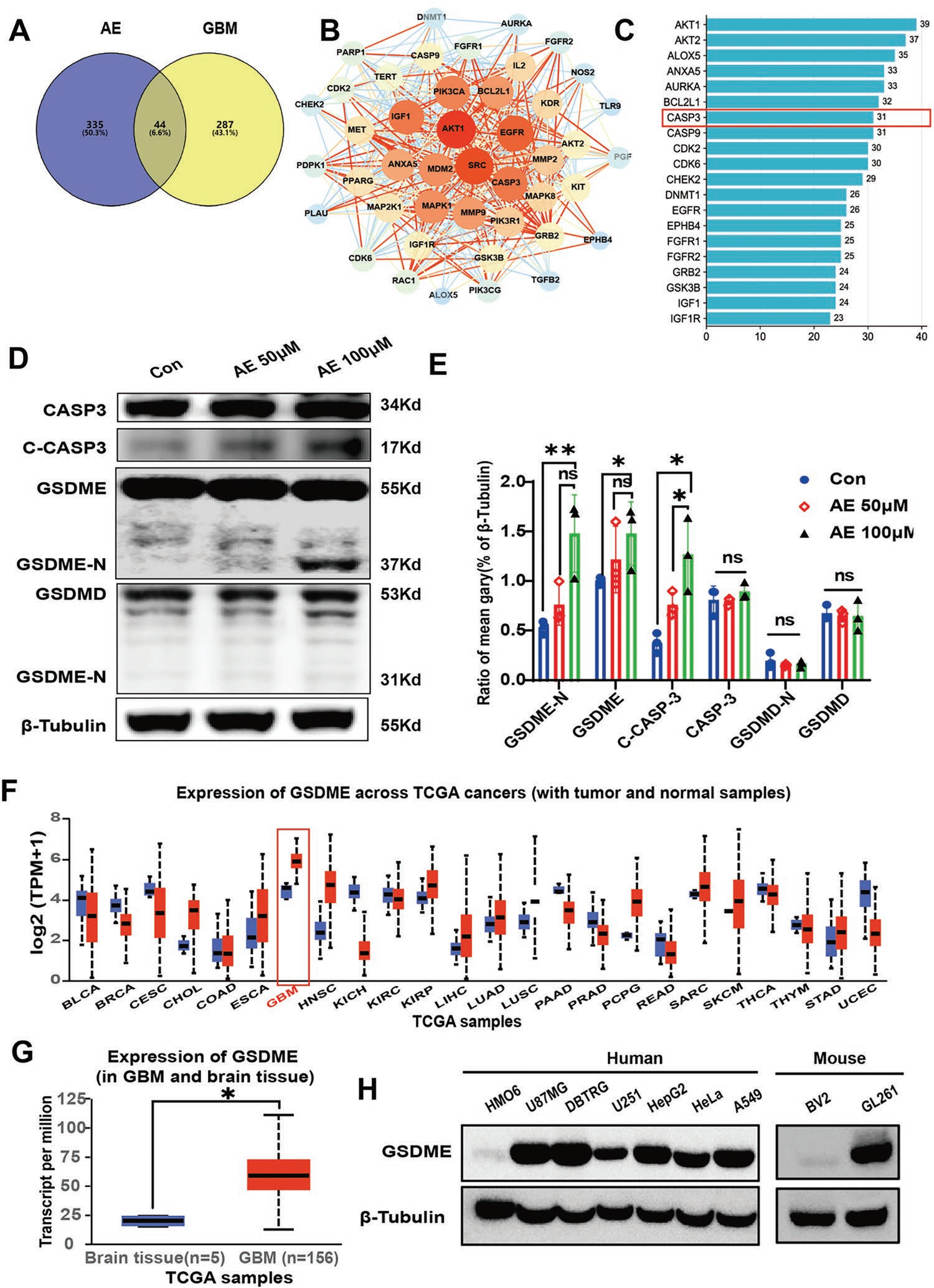
图2 AE激活GBM细胞中的CASP3 / GSDME焦亡通路
3、AE-NPS的表征及其酸性微环境响应性研究
为改善AE的颅内分布和肿瘤富集,作者通过两步法构建了AE-NPs(Scheme 1A)。首先,通过在Zn(NO3)2和2 -甲基咪唑矿化过程中包裹AE合成了AE @ ZIF-8纳米颗粒。随后,用Tf-PEG-PLGA聚合物包覆AE @ ZIF-8 NPs。空白ZIF-8、AE @ ZIF-8和AE-NPs的外观如图3A所示。本研究选择10 mg AE用于最终的AE @ ZIF-8 NPs处方和后续实验。AE的负载量为43.2%,AE @ ZIF-8的包封率为32.6%,动态光散射(DLS)测得AE @ ZIF-8的流体力学尺寸为155.1 ± 42.41 nm(图3B),表面zeta电位为20.3 ± 7.95 mV(图3C)。本研究选择7:3的体积比进行AE-NPs的制备及后续实验。作者通过DLS测得AE-NPs的水动力学粒径为199 ± 85 nm(图3B),并在96 h内保持稳定(图3G),表面Zeta电位为13.8 ± 6.49 nm(图3C),AE-NPs的包封率为22.5 %。由于正常脑组织的细胞间隙为38-68 nm,而肿瘤组织的细胞间隙为7-100 nm,这表明作者制备的AE-NPs可以自由通过脑组织间隙和肿瘤细胞间隙。
通过TEM检测空白ZIF-8 NPs、AE @ ZIF-8 NPs、AE-NPs时,AE-NPs表面有突出的Tf-PEG-PLGA包裹(图3E中的紫红色箭头)。与AE @ ZIF-8相比,AE-NPs的傅里叶变换红外(FTIR)光谱在1500-1700 cm-1之间也出现了新的吸收峰(图3F)。这可能是由转铁蛋白与PEG-PLGA的酰胺键上-CO-NH-的伸缩振动峰引起的,提示AE-NPs制备成功。
酸性环境响应的降解能力使ZIF-8 NPs成为靶向肿瘤和细胞内环境的高效载体。为测试Tf-PEG-PLGA聚合物涂层是否会干扰ZIF-8 NPs的pH响应性能,作者进一步进行了pH降解实验。作者的实验表明AE-NPs在中性环境中稳定,而在酸性环境中随着AE的释放而降解(图3H-K)。这些结果表明AE-NPs与酸性微环境发生了反应。
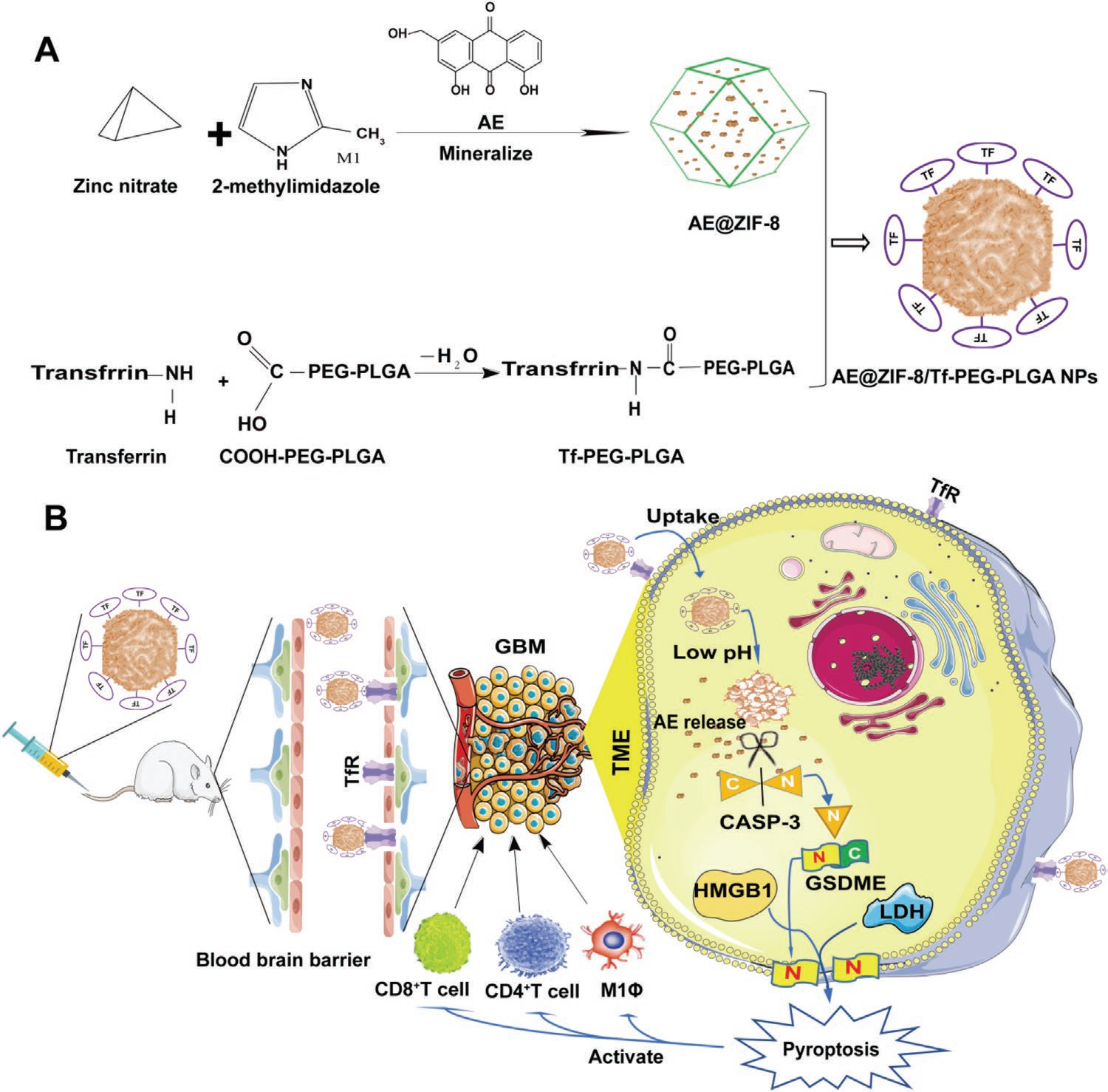
Scheme 1
图3:AE-NPS的表征及其酸性微环境响应性研究
4、NPs促进细胞内摄取和AE介导的GBM细胞焦亡
为评估GBM细胞对AE-NPs的摄取情况,作者将荧光染料吲哚菁绿包裹在ZIF-8颗粒(ICG @ ZIF-8)和Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs(ICG-NPs)中。流式细胞术分析显示ICG、ICG @ ZIF-8和ICGNPs以时间依赖性方式进入U87MG细胞(图4A)。各时间点ICG-NPs组ICG阳性细胞比例及其荧光强度均显著高于ICG组和ICG @ ZIF-8组(图4B)。因此,作者推测Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs增加U87MG细胞对ICG的细胞内摄取。接下来用ICG、ICG @ ZIF-8和ICG-NPs处理U87MG细胞6 h。激光共聚焦显微镜(LSCM)显示ICG-NPs处理组的荧光强度明显增强(图4C),证实摄取增加。
由于Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs增加了细胞内对货物的摄取,因此作者想知道Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs是否也增强了AE的抗肿瘤效果。因此,作者接下来用AE和AE-NPs处理U87MG细胞24 h,测定细胞存活率。纳米粒包载AE表现出明显更高的抑制效果(图4D)。为研究细胞摄取增加是否影响细胞死亡机制,作者接下来用共聚焦高强度成像分析系统观察了AE和AE-NPs处理的U87MG细胞。结果显示,AE-NPs处理组细胞焦亡发生在24 h内,而AE组细胞焦亡时间超过60 h(图4E),AE-NPs处理组细胞焦亡发生在24 h内,而AE组细胞焦亡发生在24 h内(图4F)。这表明TfPEG-PLGA聚合物包裹的ZIF-8 NPs对AE的包裹通过增强细胞焦亡进一步增强了抗GBM细胞的作用。

图4 NPs促进细胞内摄取和AE介导的GBM细胞焦亡
5、AE-NPS增加AE在体内的颅内分布和肿瘤富集
化疗药物在GBM治疗中面临的主要挑战是BBB穿透和肿瘤靶向性。因此,制备游离ICG、ICG @ ZIF-8、ICG-NPs作为纳米示踪剂,评价Tf-PEG-PLGA包裹ZIF-8 NPs的体内生物分布、BBB渗透和肿瘤靶向能力。按计划,首先通过尾静脉注射(ICG标准化为3 mg kg-1)对C57BL/6j小鼠进行ICG、ICG @ ZIF-8和ICG-NPs处理,然后进行光学活体成像,检测各时间点ICG在脑和主要器官的生物分布。结果表明,与ICG和ICG @ ZIF-8相比,ICG-NPs在15 min内具有更好的颅内富集性,在(图5A、B)后24 h具有明显的颅内滞留,液相色谱-质谱联用(LC-MS)定量进一步证实了AE-NPs组在(图5D ;图S10 ,支持信息)后2 h内脑内AE浓度高于其他组。器官分布显示Tf-PEG-PLGA包裹的ZIF-8 NPs延长了在体内的滞留时间。作者的研究还表明,与游离ICG相比,ICG @ ZIF-8早期脑分布较低,但(图5A ~ C)滞留时间较长。这些结果表明,负载Tf-PEG-PLGA包裹的ZIF-8 NPs增强了货物进入脑内的能力,延长了滞留时间。随后,为了评估肿瘤靶向能力,制备了ICG和ICG-NPs处理小鼠的荷瘤脑冷冻切片。结果显示,ICGNPs在肿瘤组织(图5E ;图S11 ,支持信息)中显著富集,LC-MS定量进一步证实AE-NPs组肿瘤组织具有较高的AE浓度(图5D ;图S10 ,支持信息)。
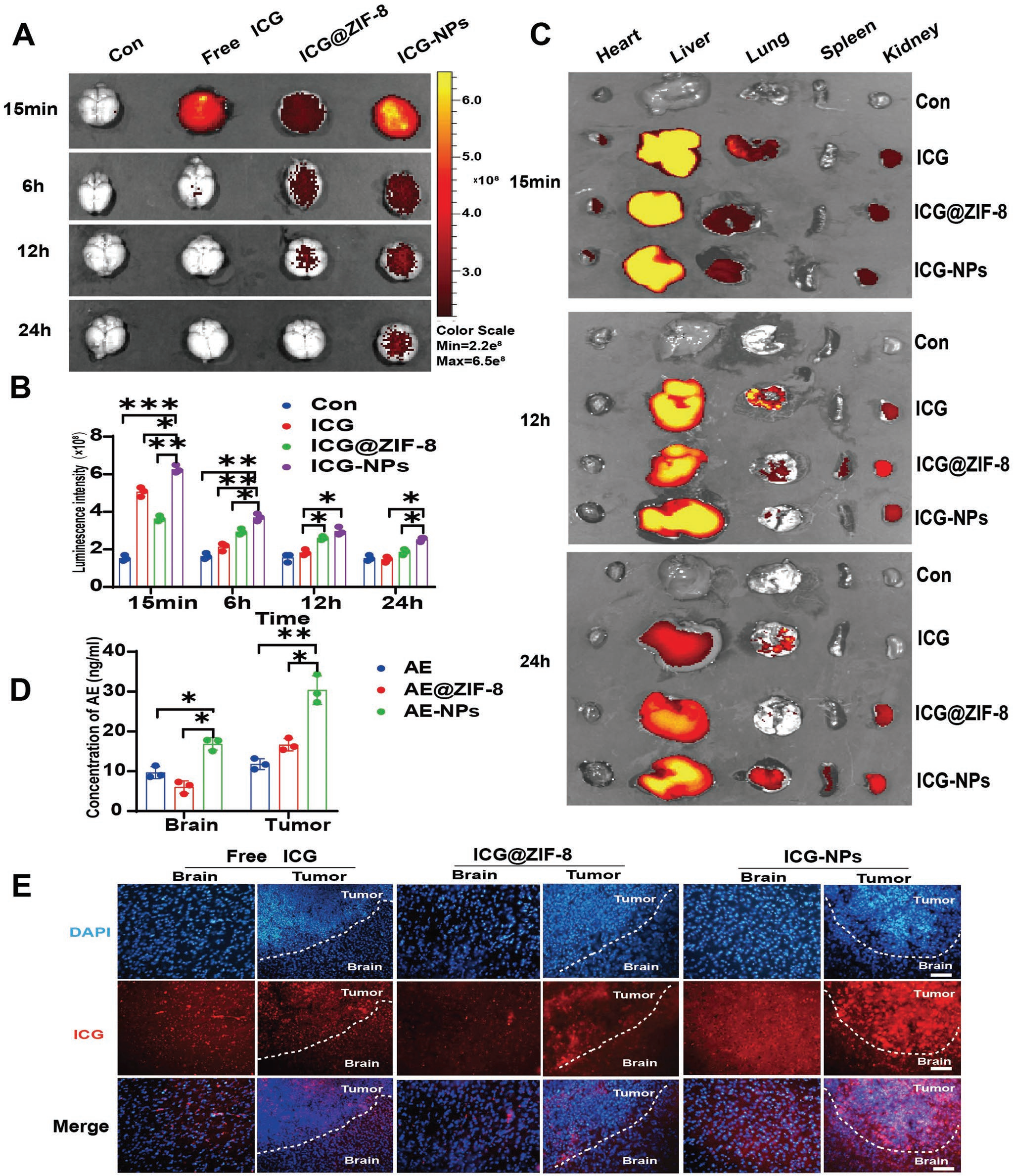
图5 AE-NPS增加AE在体内的颅内分布和肿瘤富集
6、AE-NPs增强了AE介导的体内抗肿瘤作用
为进一步评价AE-NPs的抗肿瘤作用,作者进行GL261原位GBM小鼠模型的体内实验。接种和成瘤后,动物随机分为4组,每2天经尾静脉注射1 % F127 NS、AE、Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs(NPs)、AE @ ZIF-8 AE-NPs。每周测量体重、肿瘤荧光素酶表达和精神状态(图6A)。结果显示,给药1周后,对照组(Con)组、NPs组、AE组GBM的荧光持续增强,其中Con组荧光增强最为明显。相比之下,在AE-NPs组中降低(图6B、C)。与其他3组相比,AE-NPs对肿瘤体积和重量的降低作用更强。此外,与对照组相比,NPs还降低肿瘤体积和重量(图6D-E),这可能归因于ZIF-8 NPs的细胞毒性作用。尽管NPs和AE对肿瘤体积和重量的减少具有相似的效果,但AE组在组织病理学上显示肿瘤坏死增加(图6F)。
最后,通过HE、Ki-67染色和WB实验明确AE-NPs作用于GBM的机制。HE染色显示各组均有肿瘤坏死,但AE组、AE @ ZIF-8组和AE-NPs组肿瘤坏死更明显(图6F)。Ki-67染色是增殖的生物标志物,免疫组化结果显示AE-NPs处理的GBM组织中Ki-67表达较低(图6G-H),支持抑制增殖。给药结束时,AE-NPs组的终末生存率优于其他4组(图6I)。这些结果表明AE-NPs促进坏死,抑制GBM生长,改善预后。随后,为进一步在分子水平上证实其抗肿瘤机制,作者通过WB检测了不同处理的肿瘤组织中焦亡关键生物标志物CASP3、C-CASP3、GSDME和GSDME-N的表达水平。与其他3组相比,AE-NPs显著增强了CASP3和GSDME的活化(图6J-K)。同时,AE @ ZIF-8显示出焦亡激活能力,这可能是由于AE @ ZIF-8在肿瘤组织中富集引起的。
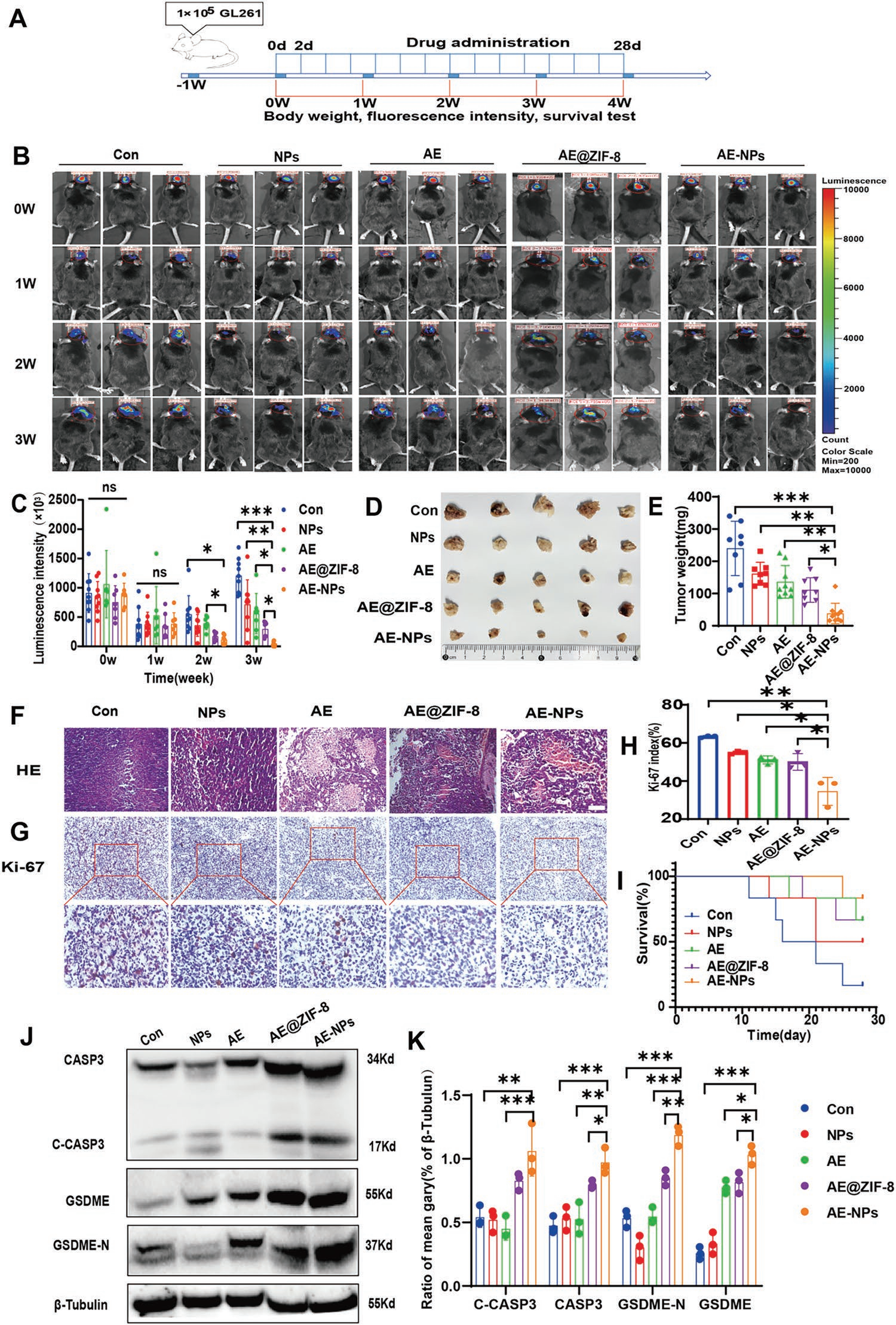
图6 AE-NPs增强了AE介导的体内抗肿瘤作用
7、AE-NPs调控GBM免疫微环境
以上实验证实AE-NPs在体内外均激活CASP3 / GSDME焦亡通路。作为一种免疫原性死亡模型,细胞焦亡具有激活固有免疫和适应性免疫以放大抗肿瘤效应的潜力。因此,通过流式细胞术(FCM)和免疫荧光检测免疫细胞CD8 + T细胞、CD4+ T细胞、Treg细胞(Fox P3+)、巨噬细胞及其M1亚型(抗炎、抗肿瘤亚型, CD86+)。CD8 + T细胞是抗肿瘤免疫的关键免疫细胞。因此,采用流式细胞术检测不同处理组肿瘤组织中CD8 + T细胞的浸润水平。结果显示,与con组相比,AE、AE @ ZIF-8和AE-NPS组CD8表达水平均有提高,尤其是AE-NPs组(CD8 + T细胞占CD3 + T细胞的比例由31 %提高到64 %)(图7A、E)。传统观点认为CD8 + T细胞上表达的PD-1作为抑制性受体介导免疫耐受,但也有报道称PD-1表达于抗原刺激后CD8 + T细胞活化的早期阶段。因此,PD-1升高可能来自于CD8 + T细胞活化,即[ 34、35],但其确切作用有待进一步探讨。CD4 + T细胞是重要的免疫细胞,CD4 + T细胞及其亚型Treg细胞(FoxP3 + ,介导免疫耐受)也被检测到。FCM显示与con组相比,AE-NPs组CD4 + T由71.45 %上升至86.18 %,Treg细胞(图7B、E、F)无明显差异。肿瘤相关巨噬细胞功能复杂,但M1亚型(M1Φ)浸润有利于其发挥抗肿瘤作用。进一步,作者通过qPCR检测抗肿瘤免疫相关细胞因子IFN-γ、HMGB1、TNF-α,结果如图7HJ所示,与对照组相比,AE-NPs组IFN-γ、HMGB1、TNF-α mRNA表达增加6 ~ 17倍,验证了免疫微环境的激活。

图7 AE-NPs调控GBM免疫微环境
8、AE-NPs可减轻AE相关的肝毒性和肾毒性
与许多化疗药物类似,高浓度AE的肝毒性和肾毒性作用已被报道。同时,高浓度和未修饰的ZIF-8 NPs也有明显的毒性反应。因此,有必要对新构建的AE-NPs进行安全性评价。因此,作者对荷瘤小鼠进行了体内CCK-8、体重、血液生化和组织病理学检测。尽管空白纳米粒在体内(图6B、E、F)有明显的GBM抑制作用,但低剂量的Zn(NO3)2、2 -甲基咪唑、ZIF-8、Tf-PEG-PLGA和空白纳米粒在体外均未表现出明显的细胞毒性(图8A)。血液生化分析显示,AE、AE @ ZIF-8和NPs处理组的肝损伤标志物谷丙转氨酶(ALT)、谷草转氨酶(AST)(图8B、C)和肾损伤标志物BUN升高(图8E),而γ-GT和CRE无变化(图8D、F)。令人惊讶的是,在AE-NPs处理的小鼠中,ALT、AST和BUN没有明显变化。此外,通过HE染色的组织病理学显示,AE处理组的肝脏中检测到局灶性坏死,而NPs和AE-NPs处理组没有检测到(图8G)。这些结果表明AE和NPs引起的肝肾损伤均被AE-NPs显著减轻。这可能是肿瘤靶向性增强的结果,降低了药物相关的脱靶毒性和副作用。4周内,对照组和NPs组小鼠体重下降,AE @ ZIF-8和AE-NPs组小鼠体重下降不明显。NPs组ALT轻度升高,AST、γ-GT、Cr、BUN无统计学差异。

图8 AE-NPs可减轻AE相关的肝毒性和肾毒性
实验方法:
体外释放和PH响应分析,C57BL/6J小鼠,CCK-8, LDH Release Assay,qPCR,Body Distribution,生信分析(Swiss Target Prediction数据库查询AE靶点及相关靶基因,UniPort蛋白标准化数据库,AE-GBM靶蛋白-蛋白相互作用(PPI)的网络构建),血液生化检查,HE染色,免疫组织化学,流式细胞术.
参考文献
Fang X, Chen Z, Zhou W, Li T, Wang M, Gao Y, Ma S, Feng Y, Du S, Lan P, Chen H, Wei J, Zhang S, Li Z, Liu X, Zhang H, Guo X, Luo J. Boosting Glioblastoma Therapy with Targeted Pyroptosis Induction. Small. 2023 Apr 17:e2207604. doi: 10.1002/smll.202207604. Epub ahead of print. PMID: 37066699.






