细胞外囊泡中的miR-126-5p和miR-212-3p在辐射诱导的血管炎症早期激活单核细胞参与动脉粥样硬化
实验方法:细胞培养,Western blotting,巨噬细胞浸润测量,RNA提取,qRT-PCR,Small RNA-sequencing,生信分析,GO和KEGG分析,双荧光素酶分析
在癌症治疗和核事故中暴露于辐射的人在长期存活者中心血管结果的风险增加。细胞外囊泡(EVs)参与辐射诱导的内皮功能障碍,但其在辐射后血管炎症早期阶段的作用尚不完全清楚。在这里,作者证明了含有miRNAs的内皮细胞来源的EVs在辐射诱导的血管炎症中启动单核细胞活化。体外共培养和体内实验数据表明,内皮EVs可以敏感地通过辐射暴露以剂量依赖的方式增加,并刺激单细胞释放单核EVs和粘附到内皮细胞,同时增加编码细胞-细胞相互作用的特异性配体的基因的表达。小RNA测序和使用模拟物和抑制剂转染解释了富集在内皮EVs中的miR-126-5p和miR-212-3p在辐射暴露后通过单核细胞激活启动血管炎症。此外,在辐射诱导的动脉粥样硬化模型小鼠循环内皮EVs中可以检测到miR-126-5p,并且发现其与血浆致动脉粥样硬化指数密切相关。综上所述,作者的研究表明,在辐射诱导的血管损伤中,内皮EVs中存在的miR-126-5p和miR-212-3p介导炎症信号激活单核细胞。更好地了解循环内皮EVs含量可以促进其作为辐射暴露后动脉粥样硬化的诊断和预后生物标志物。研究于2023年3月发表于期刊《J Extracell Vesicles》上,IF:17.337。
技术路线:

主要研究结果:
1、循环血浆EVs的数量随着暴露剂量的增加而增加
为研究辐射暴露对血浆EVs的影响,作者测定0、0.1和1 Gy全身照射实验小鼠血浆中EVs的生成量。首先,根据2018年国际细胞外囊泡学会提出的《细胞外囊泡研究的最小信息》指南对分离的EV进行鉴定。通过纳米颗粒跟踪分析(NTA)和透射电镜(TEM)测得的大多数EVs的粒径小于200 nm,并通过western blot分析验证这些EVs的质量和纯度(图1a-c)。流式细胞术检测到受照小鼠血浆EVs数量增加(图1d),ImageStreamX分析直观地证实了血浆EVs的荧光事件(图1e)。两种分析方法均用于增加结果的稳健性。接下来,作者扩大照射剂量范围,考察0、0.1、0.5、1和5 Gy不同剂量辐射的EVs响应(图1f)。循环内皮EVs水平在暴露后敏感地增加,并呈剂量依赖性,即使在低剂量(0.1 Gy)下也是如此。有趣的是,内皮细胞来源的EVs,如特异性标志物CD105+、CD31+/CD42-和146+的存在,以剂量依赖的方式显著升高。其他细胞来源的EVs,标记为CD11b +(单核细胞),CD41 +(血小板)和CD45 +(白细胞),也显著增加。损伤的血管结构进一步通过照射小鼠肠道组织中单核细胞系细胞浸润增加得到验证(图2c),这对应于中性粒细胞和巨噬细胞向小肠固有层的迁移(图2d)。
为探究辐射暴露对人体血浆EVs的影响,对6名健康献血者的血液样本也进行了不同剂量的辐射(0.1 ~ 5 Gy)。在淋巴细胞中,双着丝粒染色体和γ H2AX焦点的数量,即已知的辐射诱导损伤的基因组标记,在照射后以剂量依赖的方式增加。通过统计辐射特异的双着丝粒染色体数目,计算得到的辐射实际剂量与估算剂量具有很好的相关性(图2a)。辐射暴露增加γ H2AX指示的DNA损伤灶数目。在辐射剂量大于0.5 Gy的淋巴细胞中观察到两个以上的灶(图2b)。在线性回归模型中,以CD31+/CD42-,CD105 +,CD146 +和CD144 +标记的人血浆EVs和内皮EVs水平随着辐射剂量的增加而增加,在受辐射的小鼠血液样本中观察到(图2c)。除白细胞来源的EVs(CD45 +)外,单核细胞(CD14 + , HLA-DR +)和血小板来源的EVs(CD41 +)也显著增加。与在小鼠中观察到的结果类似,辐射剂量与人类EVs产量呈正相关(表1)。总的来说,这些数据表明,辐射引起基因组和细胞损伤后,EVs从人和小鼠的血细胞中敏感地分泌。
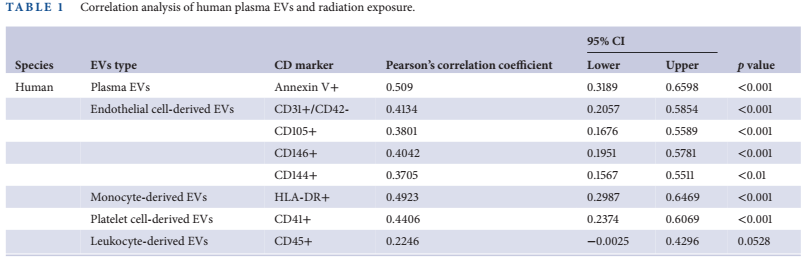

图1 循环血浆EVs的数量随着暴露剂量的增加而增加

图2 在人体血液样本中,细胞外囊泡( EVs )是由不同类型的细胞响应辐射照射而释放的
2、在共培养体系中,内皮细胞和单核细胞在辐射暴露后的不同时间点产生EVs
作者利用含有内皮细胞(Huvecs)和单核细胞(Thp-1Cells)的共培养体系来探讨辐射诱导的细胞通讯在血管结构中的作用。作者首先检测了辐射暴露后共培养培养基中的EV水平。内皮EVs(CD105和CD31阳性)在辐射暴露(暴露后4 h)后的早期时间点显著增加,并在24和48 h消失(图3a)。单核EVs(CD11b、HLA-DR阳性)的增加在暴露后24 h才被检测到(图3b)。这些数据表明,内皮细胞和单核细胞可以通过增加EVs的产生来应对辐射暴露,细胞特异性EVs在照射后的不同时间点达到峰值。单核细胞粘附是炎症反应的初始步骤,在辐射暴露后24 h,单核细胞粘附被激活(图3c),单核细胞粘附分子LFA1和Mac1表达升高(图3d)。相应地,在辐射后24和48 h,内皮细胞黏附分子ICAM-1和ICAM-2的表达也增加(图3e)。两种细胞均表现出伴随EVs产生的多种细胞因子表达增加。具体来说,HUVECs中TNF-α、干扰素(INF)-γ和白细胞介素(IL)-在4 h高表达,但在24 h消失,这与内皮EVs的产生平行(图3f)。在THP-1细胞中,这些细胞因子在辐射暴露后24 h表达增加,即观察到粘附活性增强的时间点(图3g)。这些数据表明,在作者的血管共培养体系中,辐射首先诱导内皮细胞产生促炎信号,导致单核EVs的产生和单核细胞的激活,随后发生一系列复杂的细胞因子反应。
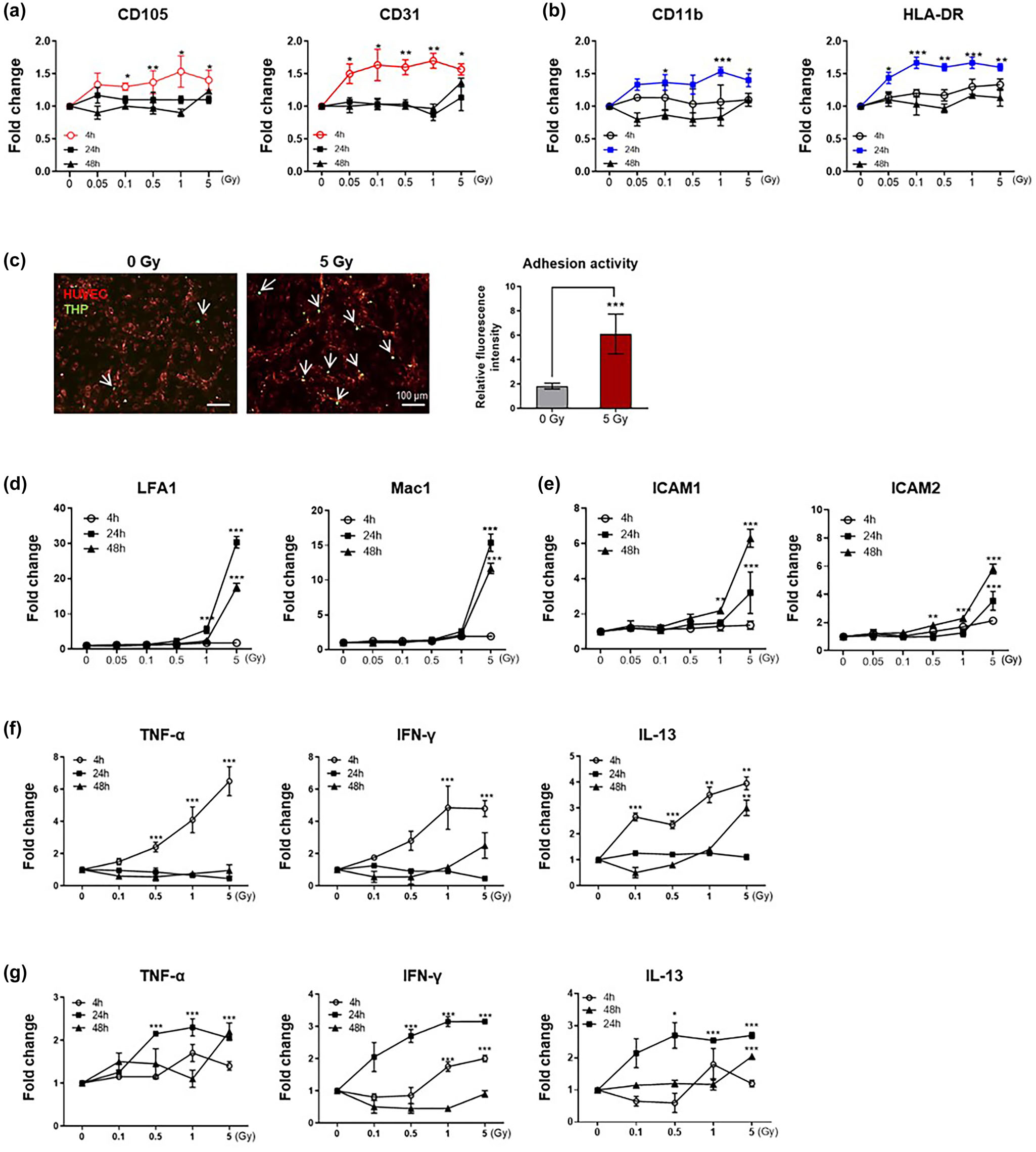
图3 内皮细胞和单核细胞EVs在辐射暴露后的不同时间点释放
3、辐射诱导的内皮EVs可促进单核细胞活化,且不依赖于辐射暴露
为检测辐射后产生的内皮EVs是否可以直接诱导单核细胞活化,在辐射后4 h,用HUVEC-THP-1共培养上清中分离的EVs处理未经辐射的THP-1细胞。辐射暴露显著增加内皮细胞EVs的数量,但并没有增加培养液中单核细胞EVs的数量(图4a)。EVs摄取实验显示HUVECs来源的EVs很容易被未照射的THP-1细胞摄取(图4b)。与内皮细胞EVs共孵育24 h后,观察受体单核细胞中EVs的产生(图4c)。相反,当THP-1细胞与EVs耗竭的条件培养基孵育时,单核细胞来源的EVs没有增加。令人惊讶的是,作者观察到THP-1细胞经辐射诱导的内皮EVs处理后,其表面粘附分子表达增加,与直接辐射暴露后观察到的水平相当(图4d)。值得注意的是,随着内皮EVs浓度的增加,THP-1细胞表面黏附分子的表达显著增加(图4e)。这一发现与辐射诱导的内皮EVs处理的单核细胞表面标志基因表达升高相互印证(图4f)。总之,这些数据表明辐射诱导的内皮EVs可以直接刺激单核细胞的粘附活性,即使在没有辐射暴露的情况下。
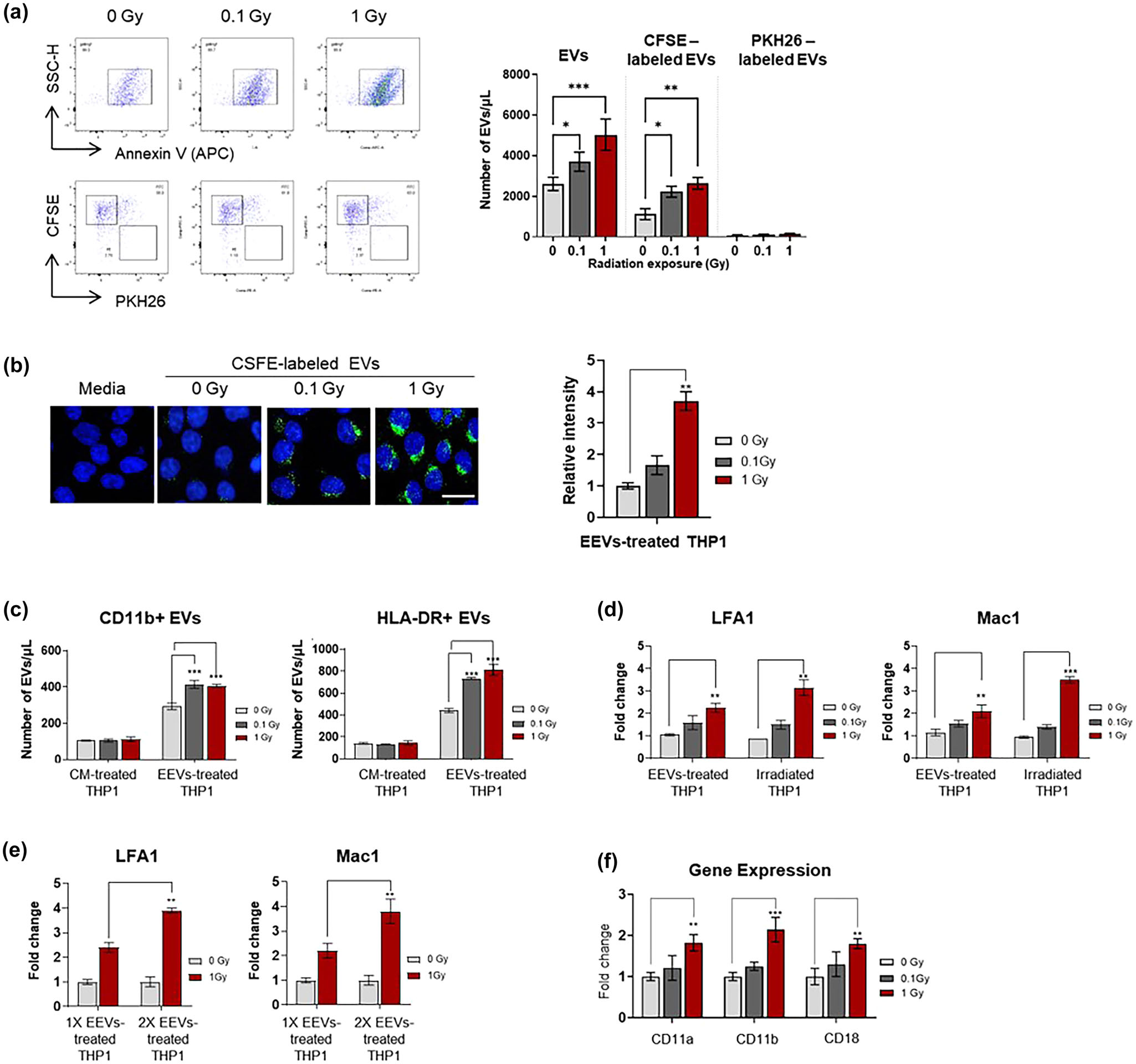
图4 来自辐照共培养的内皮EVs在体外诱导非辐照单核细胞的活化
4、辐射诱导的内皮EVs可以在非辐射小鼠中启动免疫反应
为研究辐射诱导的内皮EVs在小鼠体内的潜在作用,将辐射后24 h的小鼠血浆EVs通过尾静脉注射到非辐射小鼠体内(图5a)。与单核细胞EVs相比,内皮细胞EVs在辐射暴露后显著增加(图5b-c)。接受辐射诱导的EVs的小鼠在外周血和脾脏中显示髓系细胞的增加,但在骨髓中没有,包括中性粒细胞(CD45 + / CD11b + / Ly6G +)和巨噬细胞(CD45 + / CD11b + / F4 / 80 +),已知的急性炎症免疫细胞(图5d)。值得注意的是,在血液和脾脏中也检测到白细胞粘附分子如LFA1和Mac1的表达增加,但在骨髓中没有检测到(图5e)。利用细胞因子芯片,作者发现一些内皮功能障碍相关标志物,包括胱抑素C(CST3),CD105,几丁质酶3样蛋白1(CHI3L1)和丝氨酸蛋白酶抑制剂F1(SERPINF1),在辐射诱导的EVs处理的动物淋巴细胞中高表达(图5f)。此外,中性粒细胞标志物(C1qR1和MPO)和中性粒细胞募集趋化因子(MMP9和CXCL5)的表达在辐射诱导的EVs处理后增加。总的来说,这些结果表明,从受照小鼠体内转移EVs可以通过急性炎症细胞的扩增,系统性地启动受体小鼠的免疫激活。

图5 辐照小鼠血浆EVs诱导非辐照小鼠产生免疫应答
5、内皮EVs中的miR-126和miR-212传递给对辐射暴露有反应的单核细胞
以往的研究表明,EVs中的miRNA能够在细胞间传递炎症信号。miRNA能够靶向多个与多种疾病相关的关键调控基因。为分析miRNAs,在1Gy照射后从小鼠血浆中分离出内皮EVs,并进行小RNA测序。利用85个在辐射和对照样品中差异表达的miRNAs(倍数变化阈值为1.5)构建Aheatmap(图6a)。使用DIANA-mirPath软件对这些差异表达的miRNA进行通路分析,并使用R编程语言中的DESeq2包测量统计学意义。在显著变化的29个miRNA(p < 0.05)中,通过对辐射响应相关miRNA的文献调研,筛选出10个候选miRNA(图6b和表2)。qRT-PCR验证候选miRNAs在辐射后4 h共培养的HUVECs和内皮EVs,以及转移后24 h内皮EVs处理的THP-1细胞中的表达模式。在10个miRNAs中,有6个miRNAs在辐射后内皮EVs中的表达模式发生了显著变化(图6c)。其中,miR-126-5p和miR-212-3p在辐射后的HUVECs和内皮EVs以及内皮EVs处理的THP-1细胞中表达显著增加(图6d-e)。电离辐射后,少数miRNAs如miR-10a-5p、miR-29b-3p、miR-142-5p和miR-146b-5p在内皮EVs中表达降低,但在HUVECs和THP-1细胞中的表达模式不一致。这些结果表明,当血管细胞受到辐射时,miR-126-5p和miR-212-3p可以通过EVs从内皮细胞传递到单核细胞。
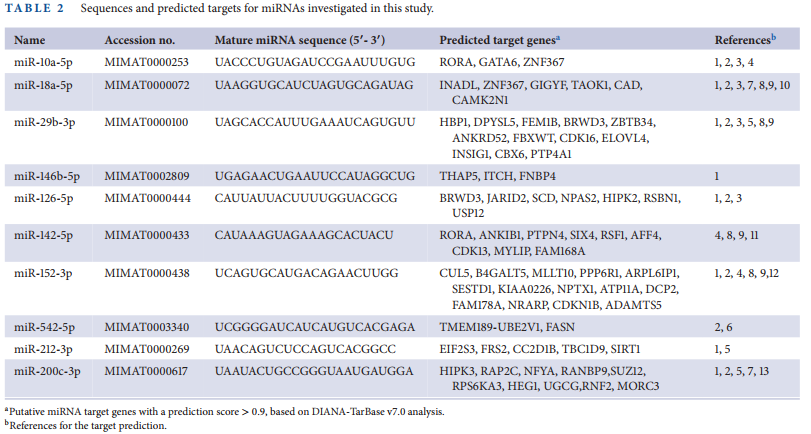
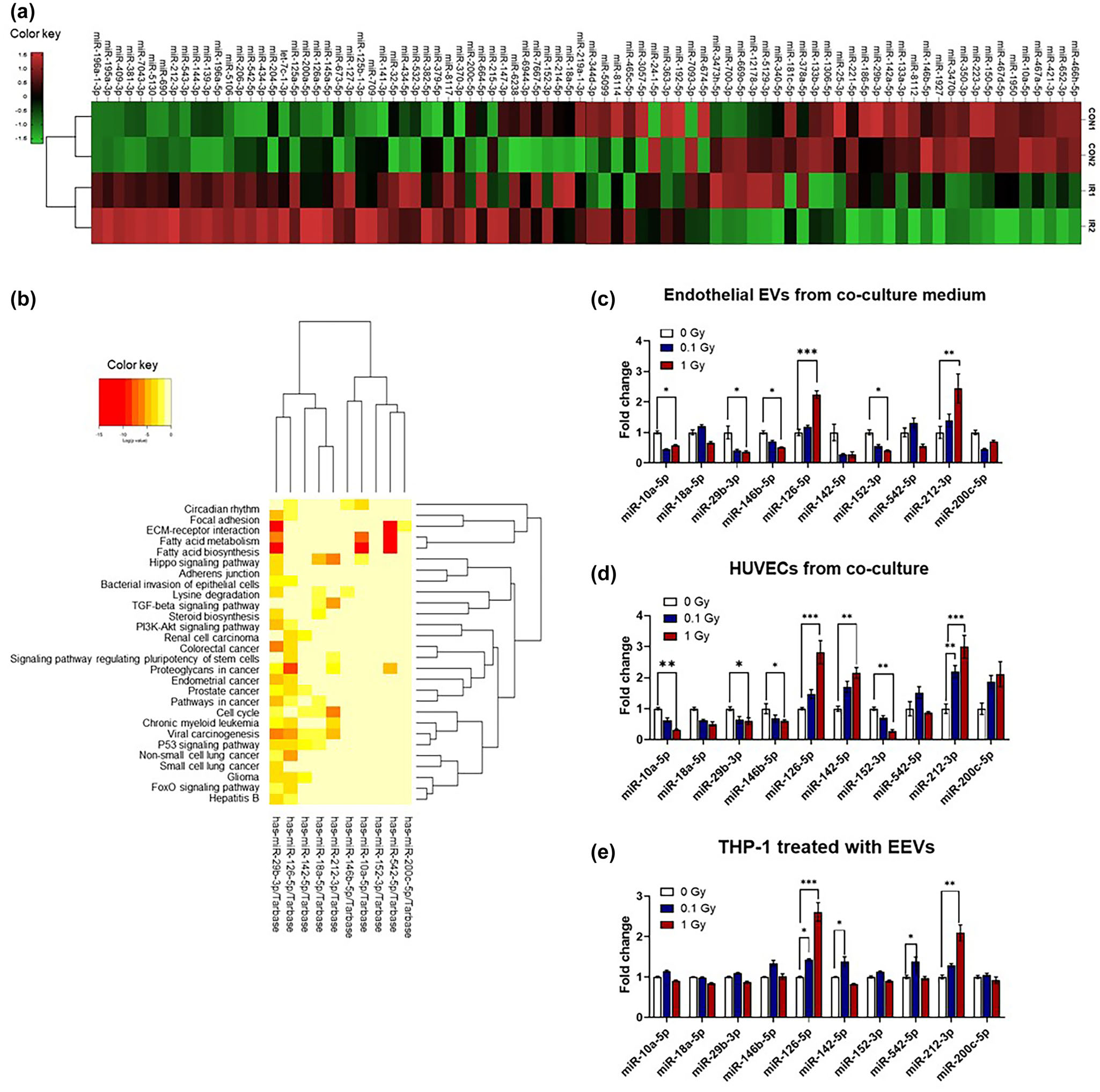
图6 EVs在血液中响应辐射暴露而释放
6、miR-126和miR-212促进单核细胞粘附以应对辐射暴露
为证明内皮EVs可以将辐射诱导的损伤信号从内皮细胞传递到炎症细胞,作者使用模拟物和抑制剂来研究miR-126-5p和miR-212-3p的功能。抑制剂处理降低了与THP-1细胞共培养24 h后HUVECs中靶miRNA的表达(图7a)。此外,HUVECs转染miR-126-5p和miR-212-3p抑制剂后,共培养的THP-1细胞在辐射后24 h黏附分子的表达降低(图7b),这与作者之前在THP-1细胞上的实验结果相反,如图4d所示。未经辐射照射的共培养THP-1细胞中细胞黏附分子的表达无变化。此外,使用miR-126-5p或miR-212-3p mimic转染可增强未照射的THP-1细胞表面黏附分子的表达(图7d)。miR-126-5p和miR-212-3p模拟物转染THP-1细胞后,即使没有辐射照射,细胞表面粘附分子的表达也增加,与辐射后的THP-1细胞相似。作者使用双荧光素酶报告基因实验证实了这两个miRNA的直接和特异性调控。荧光素酶报告载体含有与miR-126-5p或miR-212-3p靶基因的结合序列相匹配的序列,可能为antago-miRNA。mi RNAs模拟物转染THP-1细胞后,与其配对的靶位点荧光素酶活性明显降低(图7e)。此外,通过与每个miRNA特异的antago-miRNA构建的荧光素酶报告载体,转染miR-126-5p或miR-212-3p的模拟物后,粘附分子的表达显著降低(图7f)。总之,这些数据表明miR-126-5p和miR-212-3p均介导了辐射后单核细胞通过骑乘内皮细胞的EVs而发挥粘附活性所需的刺激信号。
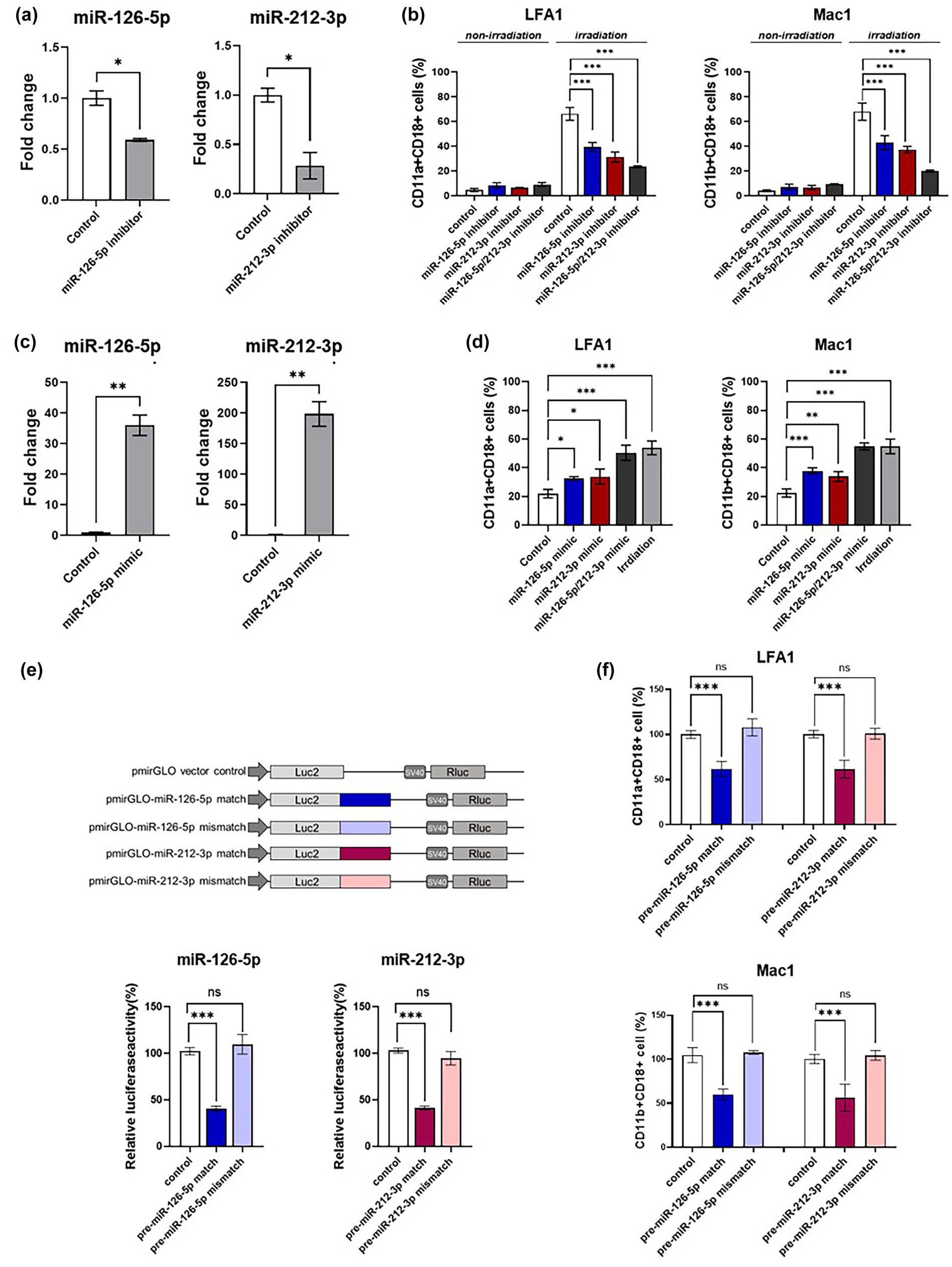
图7 miR-126-5p和miR-212-3p介导内皮细胞到单核细胞的辐射诱导损伤信号
7、miR-126和miR-212促进THP-1源性巨噬细胞泡沫化
接下来作者研究了miR-126-5p和miR-212-3p对泡沫细胞形成的影响。在与内皮细胞粘附后,循环单核细胞进入内膜区域并分化为巨噬细胞。这些巨噬细胞可以摄取ox-LDL颗粒并在炎症过程中转化为泡沫细胞。用miRNA mimics处理THP-1细胞后,PMA诱导的巨噬细胞分化显著增加(图8a)。此外,ox-LDL处理THP-1源性巨噬细胞导致细胞内脂滴增多,细胞呈现泡沫细胞形态。用miRNA模拟物处理THP-1细胞后,泡沫细胞中的脂质积累也增加(图8b-c)。此外,miRNA mimics处理细胞后,细胞内总胆固醇和胆固醇酯的水平也增加(图8d-e)。与miR-126-5p mimic相比,miR-212-3p mimic处理后巨噬细胞分化和泡沫细胞形成略有增强,但差异无统计学意义。这些结果表明,miR-126-5p和miR-212-3p可以促进单核细胞分化和泡沫细胞形成,而这被认为是与动脉粥样硬化等慢性炎症性疾病相关的主要病理特征。
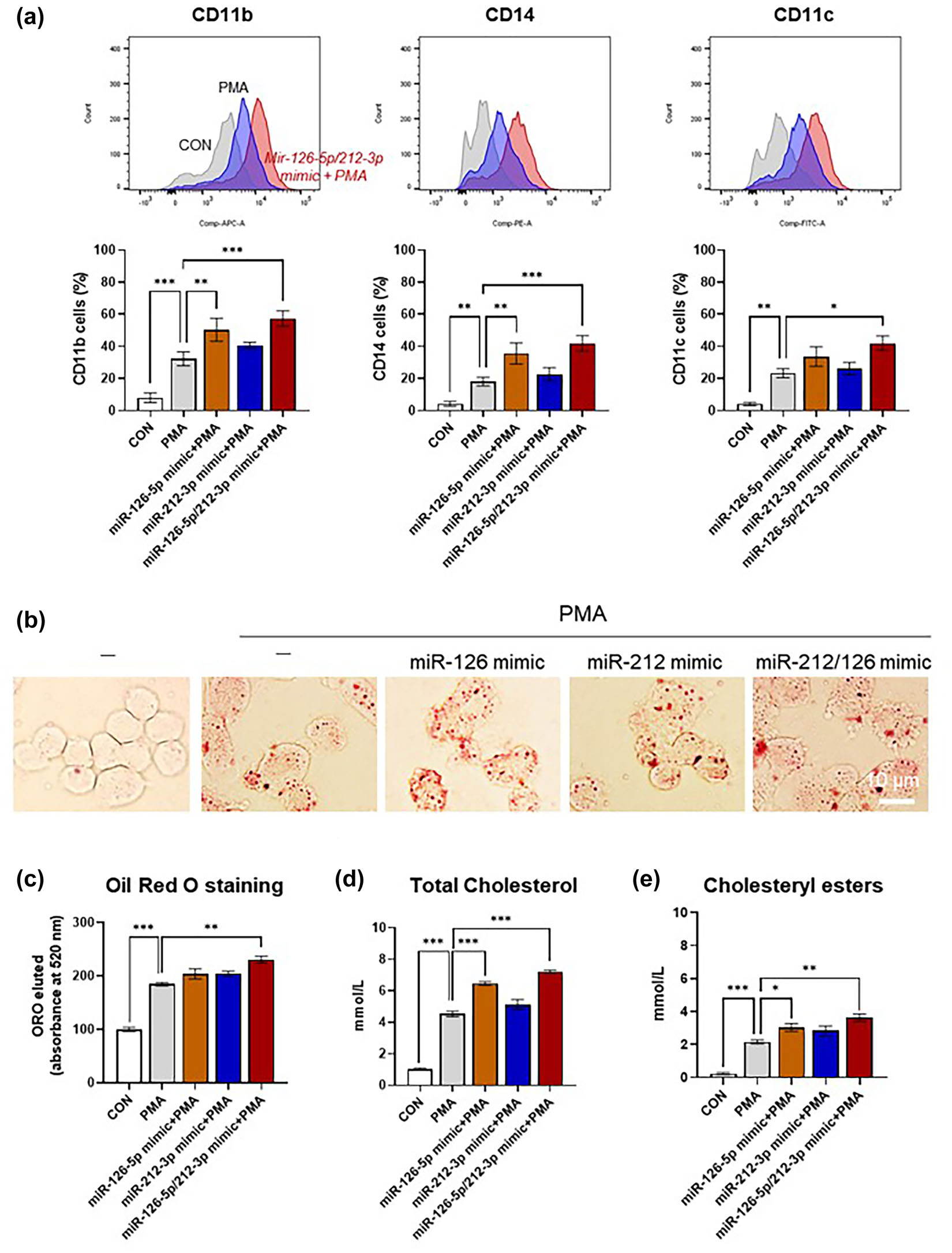
图8 MiR-126-5p和miR-212-3p促进巨噬细胞分化和ox-LDL摄取
8、辐射诱导的动脉粥样硬化Ldlr-/-小鼠血浆EVs及其货物miR-126-5p水平升高
在证实内皮细胞来源的EVs可促进辐射后单核细胞黏附导致炎症的基础上,作者接下来评估在具有代表性的辐射诱导炎症性疾病模型--辐射诱导动脉粥样硬化小鼠中是否可以检测到类似的EVs。通过评估辐射暴露Ldlr-/-小鼠主动脉根部脂质斑块的形成,验证了辐射诱导的动脉粥样硬化的成功发展(图9a)。通过测量辐照小鼠的血脂水平,包括总胆固醇、总甘油三酯和高密度胆固醇来评估冠心病的致动脉粥样硬化风险指数(图9b)。辐射后Ldlr-/-小鼠血浆EVs数量与辐射后动脉粥样硬化发生风险成正比(图9c)。值得注意的是,作者发现在辐射诱导的动脉粥样硬化模型小鼠血浆EVs中,miR-126-5p的水平显著升高,而miR-212-3p的水平没有显著变化。此外,Pearson ' s相关分析显示斑块形成、EVs分泌和EVs中miR-126-5p表达与放射性动脉粥样硬化临床风险指标相关(图9f-h)。总之,这些数据表明EVs中存在的miR-126-5p可以介导动脉粥样硬化发展过程中辐射诱导的炎症信号。此外,血浆EVs及其货物miR-126-5p可用于评估辐射后较长时间内动脉粥样硬化发生的风险。
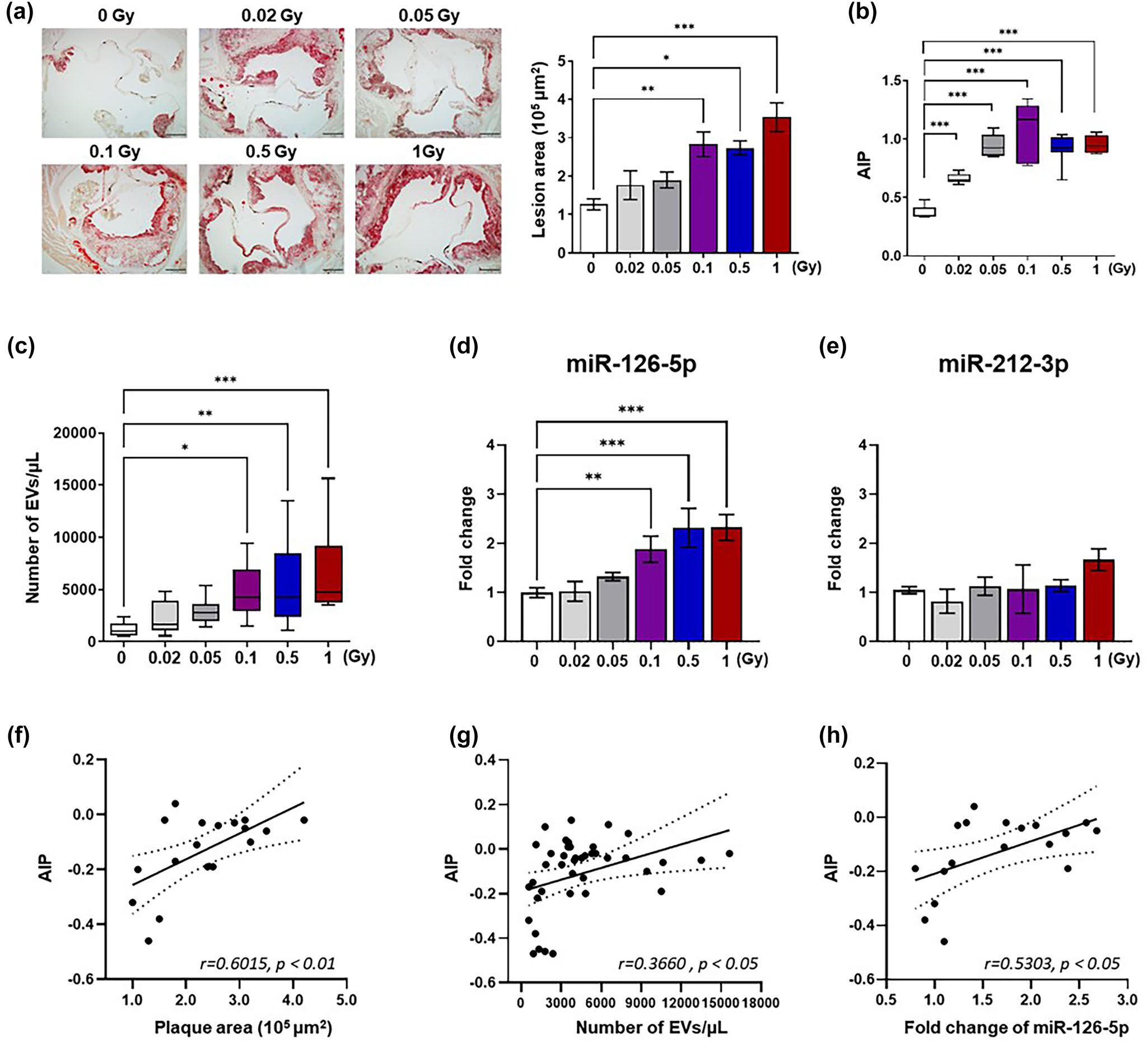
图9 辐射诱导的动脉粥样硬化Ldl -/-小鼠血浆内皮细胞及其载货量增加

图10 机制图
参考文献
Choi, Y. Y., Kim, A., Lee, Y., Lee, Y. H., Park, M., Shin, E., Park, S., Youn, B., & Seong, K. M.(2023). The miR-126-5p and miR-212-3p in the extracellular vesicles activate monocytes in the early stage of radiation-induced vascular inflammation implicated in atherosclerosis. Journal of Extracellular Vesicles, 12, e12325. https://doi.org/10.1002/jev2.12325






