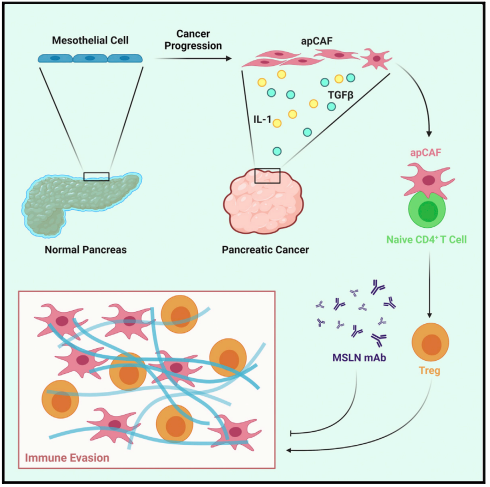
邪恶推手:apCAFs新亚群诱导Treg细胞扩增
实验方法:免疫组化,RT-qPCR,WB,小鼠模型,谱系追踪测定,肿瘤类器官,流式分选,细胞共培养,Treg抑制实验,RNA测序,单细胞RNA测序及其生信分析
最新研究发现了一种独特的癌症相关成纤维细胞(CAF)群体,称为抗原呈递CAFs(apCAFs),其特征是主要MHC II类分子的表达,表明其具有调节肿瘤免疫方面的功能。本研究通过整合多项单细胞RNA测序和进行稳健的谱系追踪分析,发现apCAFs来源于间皮细胞;在胰管腺癌(PDA)进展过程中,间皮细胞通过下调间皮特征并获得成纤维细胞特征形成apCAFs,这一过程由IL-1和TGF-β诱导;apCAFs以抗原特异性方式直接连接并诱导初始CD4+ T细胞分化为调节性T细胞(Tregs);靶向间皮细胞标志物mesothelin可有效抑制间皮细胞向apCAF转化和apCAF诱导的Treg形成。
技术路线:
主要实验结果:
1、apCAFs来源于间皮细胞
作者之前通过scRNA-seq分析了多种PDA的基因工程小鼠模型(GEMMs)(正常胰腺、早期KIC、晚期KIC、晚期KPC和晚期KPfC [KrasLSL-G12D/+; Trp53 fl/fl; Pdx1Cre/+]),并确定了正常胰腺和早期PDA中的三个成纤维细胞群(FB1、FB2和FB3)以及后期PDA中的两个群(FB1和FB3)。为了解成纤维细胞在这些模型之间的关系,将来自正常胰腺、早期KIC、晚期KIC、晚期KPC和晚期KPfC的所有成纤维细胞投影到tSNE图上,并进行聚类(图1A),并鉴定到成纤维细胞的四种分子亚型(图1B),其中FB1和FB2在此前的报道中已有描述,但此前鉴定的FB3亚群在这里聚为了3类,所以命名为FB3和FB3B,其中FB3B在所有晚期GEMMs中都有特异性扩增(图1C)。然后研究FB3A和FB3B的转录谱,发现每个亚型都以MHC II通路和间皮细胞基因的表达为特征(图1D-1E)。但与FB3A相比,FB3B的间皮标志基因表达水平较低,炎症和肌纤维母细胞性基因表达水平升高(图1D,1F)。这些数据表明FB3A和FB3B为间皮细胞,FB3A为正常间皮细胞,FB3B为成纤维表型的间皮细胞。
为了解这些间皮细胞相关群体之间的关系,作者整合了三个成纤维细胞数据集,并使用UMAP进行聚类和降维,结果显示来成纤维细胞分为11个不同的集群(图1G)。为识别间皮细胞簇,生成MHC II通路和间皮细胞基因的UMAP图,发现聚类7和9表达这些特征基因(图1H)。根据数据集的来源强调成纤维细胞的分布,以了解FB3A、FB3B、apCAFs和正常间皮细胞之间的关系(图1I)。发现合并数据中的聚类7(图1G)具有与FB3A相同的特征,聚类9与FB3A相同,提示簇7代表正常间皮细胞,簇9代表成纤维细胞间皮细胞群。因此,本研究中将簇9定义为apCAFs,簇7定义为正常间皮细胞。
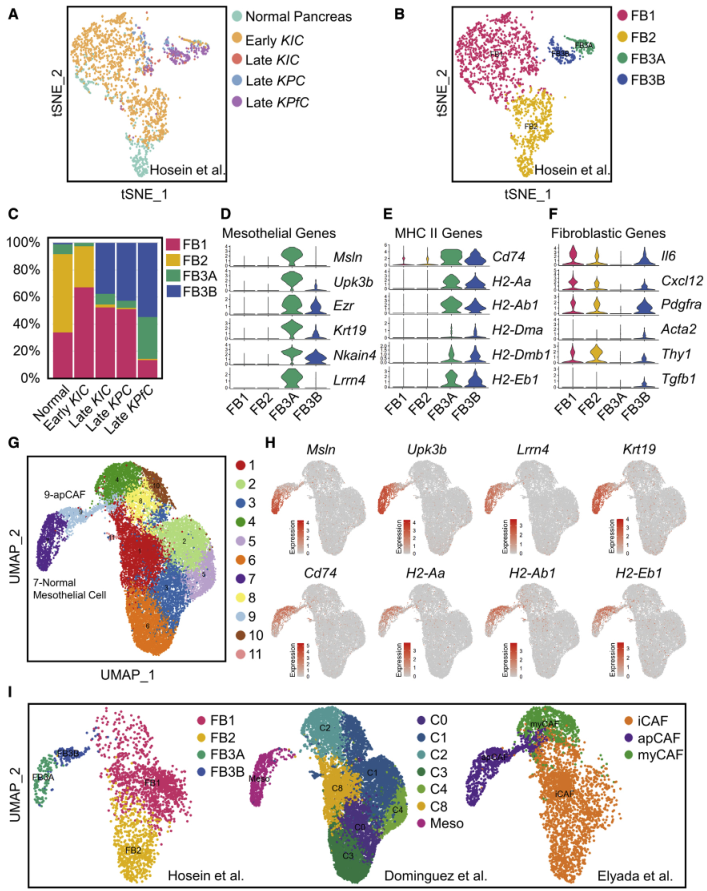
图1 scRNA-seq综合分析正常间皮细胞与apCAFs的关系
2、在PDA进展过程中,间皮细胞扩张并促进粘连形成
收集3只KPfC小鼠的晚期肿瘤(PDA1、PDA2、PDA3),消化成单细胞悬液,分析apCAFs的比例(图2A),发现所有三种肿瘤都由apCAFs组成,其百分比与iCAFs和myCAFs相当。为追踪PDA进展过程中间皮细胞的命运,作者使用CFSE燃料进行谱系追踪测定,将CFSE注射到野生型小鼠的腹腔内,并在2天后获取胰腺,发现正常胰腺的间皮被细胞示踪染料标记(图2B),相反,在60天大的KIC或KPfC荷瘤小鼠身上进行了同样的检测,并且发现CFSE标记的细胞从间皮区域渗入到肿瘤基质中(图2B)。为确保CFSE信号是间皮细胞特异性的,将CFSE标记的组织与cadherin-11共同染色(图2C),发现在正常的胰腺和PDA中,CFSE+细胞也是cadherin-11+;此外,与胰腺癌细胞标志物SOX9共同染色,发现CFSE+的细胞与SOX9+的癌细胞不同(图2C),进一步支持CFSE信号对间质细胞的特异性。
鉴于在胚胎发育过程中,间皮细胞可以分化为成纤维细胞和平滑肌细胞,所以作者用正常的间皮细胞(簇7)、apCAF(簇9)和其他密切相关的成纤维细胞群(集群1、4、8和10)进行伪时间分析,发现尽管正常的间皮细胞在成为apCAF时获得了成纤维细胞的特征并趋向于成纤维细胞,但它们对其他CAF群体的形成贡献有限(图2D),这支持iCAF和myCAF系来自常驻成纤维细胞。由于apCAFs通过下调间皮细胞基因和上调成纤维细胞基因获得了差异基因标签(图2E),所以对apCAFs中上调的基因进行通路和功能富集分析,以确定驱动这种基因特征变化的生物学过程,结果发现许多已识别的生物过程与损伤或炎症反应有关(图2F),这表明来自肿瘤小生境的创伤相关信号可以诱导apCAF的形成。
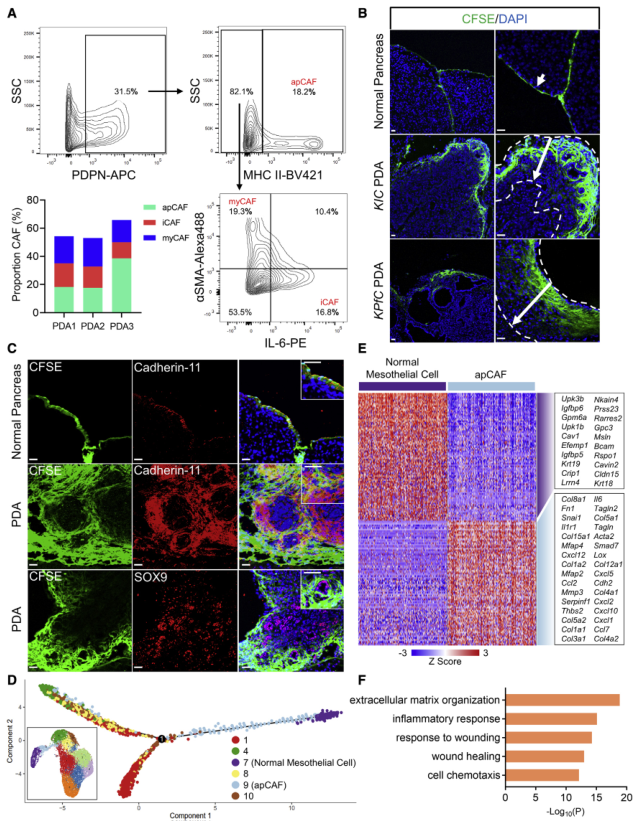
图2 间皮细胞在PDA形成过程中扩增并获得成纤维细胞特征
3、创伤相关肿瘤旁分泌信号诱导间皮细胞—apCAF转变
为验证间皮细胞—apCAF的转化,以及在PDA进展过程中确定间皮细胞的命运,利用一个由间皮细胞特异性基因Wt1启动子驱动的可诱导Cre-loxP系统构建Wt1CreERT2;R26LSL-tdTomato模型(图3A)。Wt1CreERT2/+;R26LSL-tdTomato/+小鼠在Wt1基因位点表达Cre-ERT2融合蛋白。CreERT2在他莫昔芬(TAM)处理后会从R26位点切除LSL序列,这将不可逆地诱导tdTomato表达。将TAM注射入Wt1CreERT2;R26LSL-tdTomato模型小鼠并收集胰腺(图3B)。结果显示正常胰腺间皮表达tdTomato(图3C-3D)。作为阴性对照,R26LSL-tdTomato小鼠没有Wt1CreERT2不表达tdTomato(图3E)。接下来,追踪PDA进展过程中间皮细胞的命运。将Wt1CreERT2;R26LSL-tdTomato小鼠胰腺内的间皮细胞标记为tdTomato+,原位注射源自KPfC小鼠的同基因PDA细胞系,在植入后3周收获成熟肿瘤(图3B),发现间皮细胞在PDA中大量扩增,tdTomato+细胞分布在肿瘤周围和内部(图3F-H)。此外,在正常胰腺中,间皮细胞不表达成纤维细胞标志物,如aSMA和IL-6(图3C-3D),而PDA内可见tdTomato+aSMA+(图3F)或tdTomato+IL-6+(图3G)细胞。间皮谱系追踪实验强有力的证明间皮细胞获得成纤维细胞特征,并有助于PDA的间质形成。
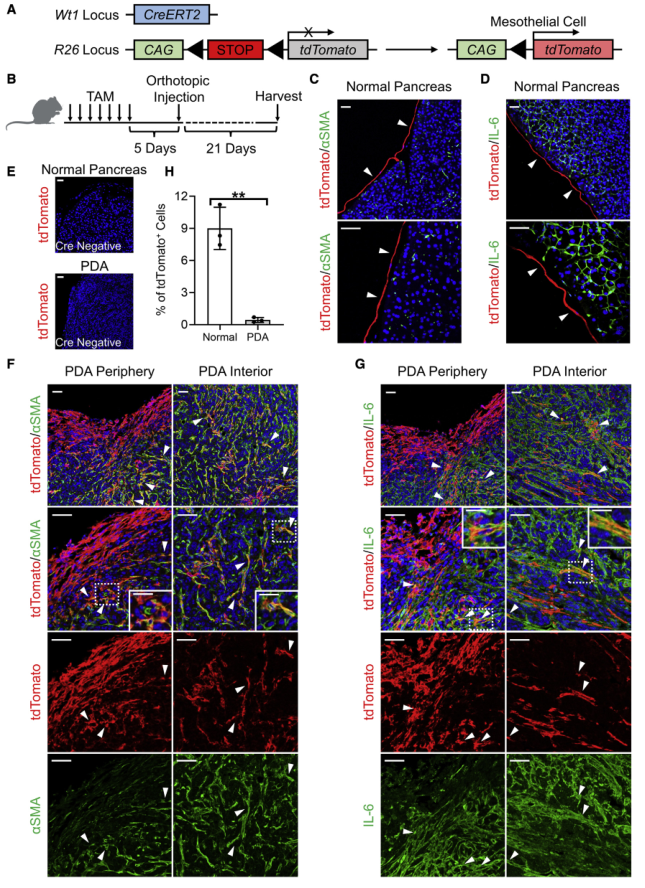
图3 PDA中间皮细胞的谱系示踪与可诱导转基因小鼠模型
4、间皮细胞系再现间皮细胞—apCAF转变
为研究肿瘤旁分泌信号是否能诱导间皮细胞分化为apCAFs,建立小鼠胰腺间皮细胞系。将间皮外植体接种到组织培养皿中,接种后5天,细胞开始从间皮迁移(图4A)。一旦融合,这些细胞进行流式细胞术,其中95%的细胞为podoplanin和MHC II双阳细胞(图4A),将这些细胞命名为胰腺间皮细胞(PanMeso)。对第10-20代PanMeso细胞进行转录组分析,发现其具有稳定的间皮基因标签和低表达的成纤维细胞基因(图4B)。用KPfC PDA类器官条件培养(CM)基处理PanMeso细胞,发现其显著降低间皮细胞基因的表达(图4C)。对差异上调的基因进行功能富集分析,发现其主要参与伤口和炎症响应(图4D),这与单细胞测序结果一致。进一步对肿瘤进行eGFP和aSMA或IL-6的IHC染色,发现TME诱导eGFP+ PanMeso细胞表达aSMA和IL-6(图4E和4F)。综上所述,使用PanMeso细胞的体外数据再现了间皮细胞的成纤维细胞转化,并强调了肿瘤旁分泌信号在促进这一过程中的重要性。

图4 PanMeso细胞中间皮细胞- apCAF转变的概述
5、apCAFs诱导幼稚CD4+ T细胞转变为Tregs细胞
采用图5A中的方案对KPfC肿瘤进行流式细胞术分选,对分选的细胞进行OVA处理,然后和CD4+ T细胞共培养。结果显示正常间皮细胞和apCAFs能以OVA依赖的方式诱导T细胞扩增早期激活标志物CD25和CD69的表达,而iCAFs和myCAFs则不能(图5B-C)。随后使用PanMeso细胞重复上述实验(图5A),PDA类器官CM诱导的apCAFs形成导致PanMeso细胞的抗原提呈能力增加(图5B-C)。
随后为探究apCAFs是否诱导Treg细胞形成,检测和OVA处理的apCAFs细胞共培养的CD4+ T细胞的Treg细胞的存在,结果显示apCAFs以抗原特异性的方式诱导Treg的形成(图5D-E)。进一步检测apCAFs诱导形成的Tregs细胞的免疫抑制功能,如图5F-G所示,其显著抑制CD8+ T细胞的增殖。综上所述,这些数据表明apCAFs可能是一个独特的免疫调节CAF群体,可以通过抗原依赖的TCR连接诱导Treg的形成和扩增。
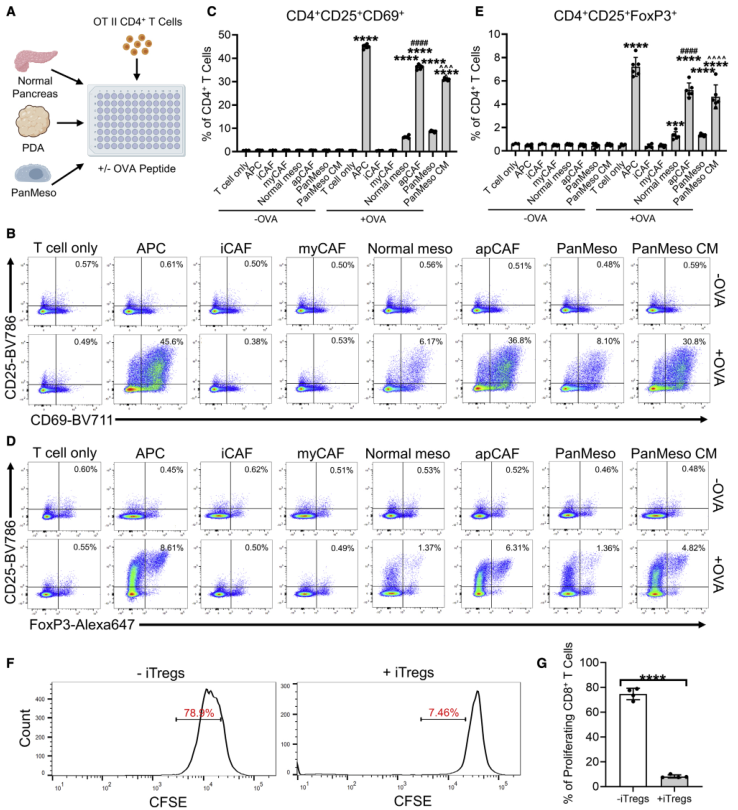
图5 apCAFs诱导幼稚CD4 + T细胞进入Tregs
6、apCAFs存在于人类肿瘤中并与Tregs相关
为证明apCAFs与人类的相关性,收集人PDA肿瘤组织并进行多色免疫荧光观察apCAFs与Tregs。PDGFRa在除了间质细胞外的所有CAF类群中表达,所以PDGFRa+CD74+特异性标记apCAFs,PDGFRa+CD74—标记其余类型CAFs(图6A)。结果显示,在人PDA中,apCAFs丰度具有异质性(图6B),并且与Tregs具有相关性,与其它CAF无相关性(图6C-D)。此外,作者使用上述小鼠apCAFs基因特征表征了两个人PDA和卵巢癌的单细胞数据集,发现两者间有重叠(图6F-G)。因此,以上表明在人肿瘤中也存在apCAFs并与Tregs相关。
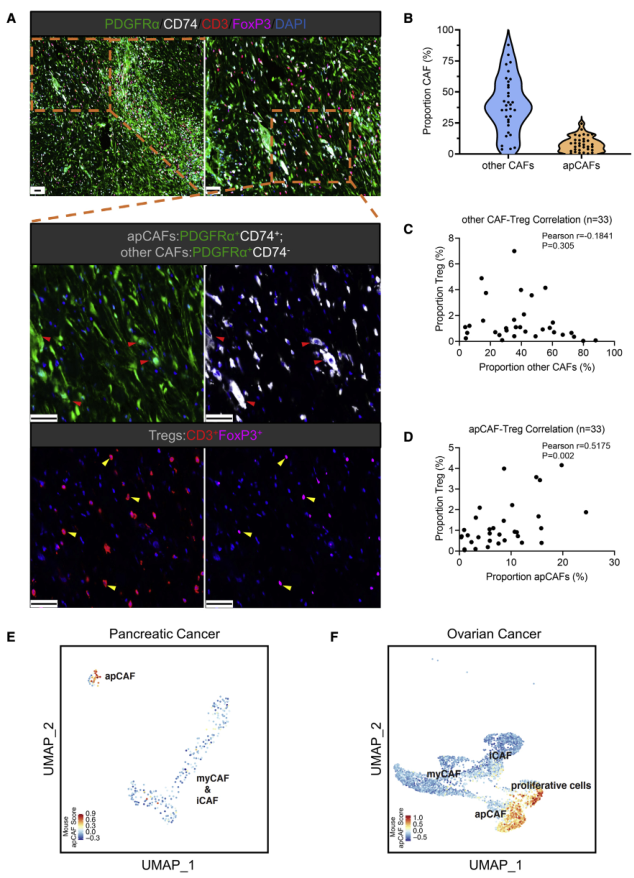
图6 apCAFs存在于人类肿瘤中,并与Treg相关
7、IL-1和TGF-β参与间皮细胞—apCAF转化
为确定驱动间皮细胞向apCAF转化的信号通路,提取在apCAF中上调的差异基因,并对它们进行motif富集分析,鉴定到NF-kB通路的Nfkb1和Rela,TGF-β信号通路的Smad1,Smad3,Smad4(图7A)。IL-1诱导的NF-kB信号通路被预测负责iCAF谱系的形成,而TGFβ被预测驱动myCAF谱系。为验证这一结果,使用PDA类器官CM处理PanMeso细胞,结果显示NF-kB和TGF-β信号通路均被激活了(图7B)。随后检测IL-1和TGFβ是否驱动间皮细胞的apCAF表型,结果显示,与对照组比较,IL-1和TGFβ处理的PanMeso细胞中间质细胞基因的表达显著下降(图7C),相反成纤维细胞相关基因显著上调表达(图7D)。这些结果表明IL-1和TGFβ可以驱动间皮细胞向apCAF表型转化。
接下来探究IL-1和TGFβ是否影响间皮细胞的功能。结果显示OVA特异性TCR激活被IL-1和/或TGFβ预处理的PanMeso细胞增强(图7E-7F)。此外,IL-1和/或TGFβ预处理的PanMeso细胞显著增强Treg细胞数量(图7G-7H)。以上数据表明,IL-1/NF-kB和TGFb信号通路负责正常间皮细胞分化为apCAFs,并具有活化CD4+ T细胞和促进其分化为Treg的能力。
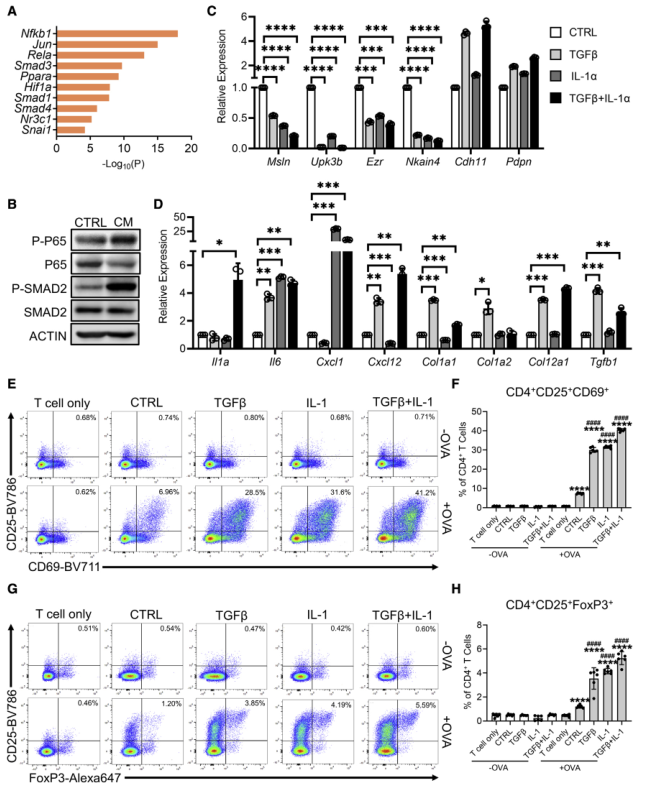
图7 IL-1和TGF-β参与间皮细胞—apCAF转化
8、靶向间皮素可抑制间皮细胞向apCADs转化
有两篇报道使用小鼠特异性阻断单克隆抗体(mAb)对抗间皮细胞标记物间皮素(MSLN Ab)来抑制间皮细胞向成纤维细胞的转变。因此,作者测试了mAb对间皮细胞apCAF形成的影响。使用PDA类器官CM、对照Ab、MSLN Ab处理PanMeso细胞,结果显示MSLN Ab显著抑制由PDA类器官CM引起的间质基因的下调和EMT及成纤维细胞基因的上调(图8A)。在小鼠体内,MSLN Ab显著减少TAM诱导的Wt1CreERT2;R26LSL-tdTomato小鼠的tdTomato阳性细胞(图8B-C)、tdTomato+aSMA/IL6+双阳性细胞(图8D-E)。
功能实验显示,MSLN Ab可抑制因PanMeso细胞的PDA类器官CM引起的抗原呈递和Treg细胞诱导能力(图8F-I)。重要的是,MSLN Ab可抑制肿瘤生长和肿瘤中Treg细胞比例(图8J-M)。综上所述,以上表明靶向MSLN可能是有效抑制间皮细胞向apCAF转化和克服apCAF诱导的免疫抑制的潜在策略。
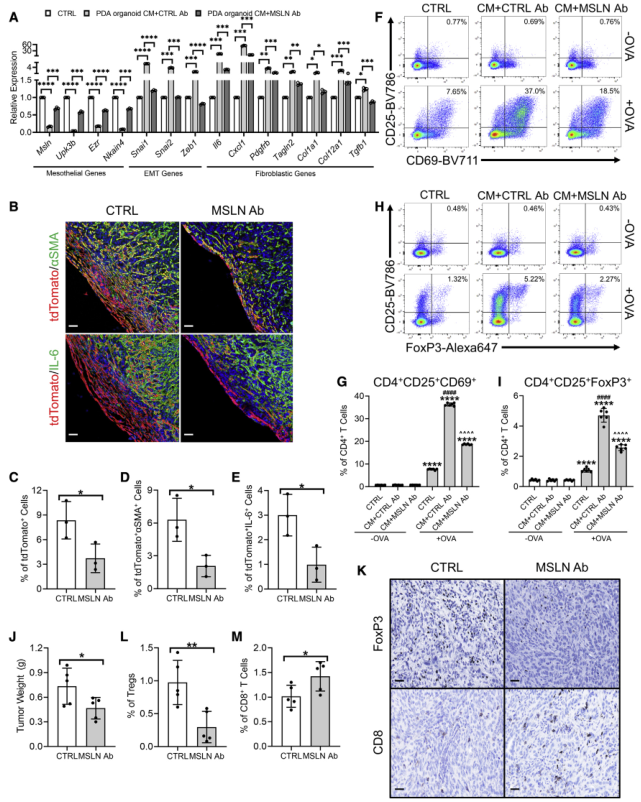
图8靶向间皮素可抑制间皮细胞向apCADs转化
参考文献:
Huang H, Wang Z, Zhang Y, Pradhan RN, Ganguly D, Chandra R, Murimwa G, Wright S, Gu X, Maddipati R, Müller S, Turley SJ, Brekken RA. Mesothelial cell-derived antigen-presenting cancer-associated fibroblasts induce expansion of regulatory T cells in pancreatic cancer. Cancer Cell. 2022 Jun 13;40(6):656-673.e7. doi: 10.1016/j.ccell.2022.04.011. Epub 2022 May 5. PMID: 35523176; PMCID: PMC9197998.