BMP2/GDF5和BMP4/GDF5异源二聚体的形成和表征
实验方法:Western blots,细胞培养,荧光素酶报告分析,表面等离子体共振,非洲爪蟾发育测定,斑马鱼信号分析,晶体学,结构分析与建模
TGFβ家族的蛋白质主要作为同源二聚体被研究,也已知形成具有不同于其组成的同源二聚体的生物活性的异二聚体。例如,骨形态发生蛋白的异二聚体,包括BMP2/BMP7、BMP2/BMP6和BMP9/BMP10等,已经说明了这些异二聚蛋白在TGFβ信号转导中的重要性。在本研究中,我们确定了成熟的GDF5可以与成熟的BMP2或BMP4结合形成BMP2/GDF5和BMP4/GDF5异源二聚体。这种BMP2或BMP4单体与具有低硫酸肝素亲和力的GDF5单体的组合产生了具有中等亲和力的异源二聚体。使用肝素亲和层析纯化异质二聚体蛋白,我们随后确定BMP2/GDF5和BMP4/GDF5异质二聚体在一系列细胞和体内系统中始终有效地发出信号,而其同质二聚体对应物的活性则更多地依赖于环境。这些差异可能是由1型受体Alk3和Alk6的联合亲和力的增加所驱动的。此外,测定了BMP2/GDF5异源二聚体的X射线晶体结构,强调了两个不对称的1型受体结合位点的形成,这两个结合位点都是相对于同型二聚体独特的。最终,这种异源二聚体生产方法获得了一种相对于同型二聚体配体具有独特性质的信号分子,包括对多种1型的高亲和力和中等的肝素结合亲和力。本文于2023年2月发表于BMC Biology (IF=7.364)。
技术路线:

结果:
(1) GDF5/BMP2和GDF5/BMP4异源二聚体的产生和验证
由于BMP2和GDF5同型二聚体都可以通过细菌包涵体的氧化再折叠产生和纯化,我们假设可以通过修改氧化再折叠方案来形成BMP2/GDF5异型二聚体。纯化并溶解BMP2和GDF5包涵体,在氧化复折叠前以1:1的摩尔比混合。然后让BMP2和GDF5的混合物再折叠5天。重折叠后,BMP2和GDF5同型二聚体通常通过肝素亲和层析从不正确折叠的种中分离出来,其中BMP2二聚体用高盐洗脱,而GDF5结合较弱,用低盐浓度洗脱。我们假设异源二聚体可能对肝素表现出中间亲和力。因此,我们将BMP2/GDF5的复折叠混合物应用于肝素柱,在洗脱时确定了三个独立的峰(图1C)。SDS-PAGE和Western blots分析表明,在还原和非还原条件下,第一个峰含有GDF5同型二聚体,最后一个峰含有BMP2同型二聚体。中间峰由包含BMP2和GDF5链的单一二聚体组成(图1C)。为了验证我们的异源二聚体形成方法,我们用BMP4和GDF5重复了这一过程。同样,从肝素洗脱谱中鉴定出三个峰,中间的峰由BMP4/GDF5异源二聚体组成(图1D)。这些结果表明,BMP2/GDF5和BMP4/GDF5异质二聚体都可以通过氧化复折叠生成,并分离出同源性进行进一步分析。
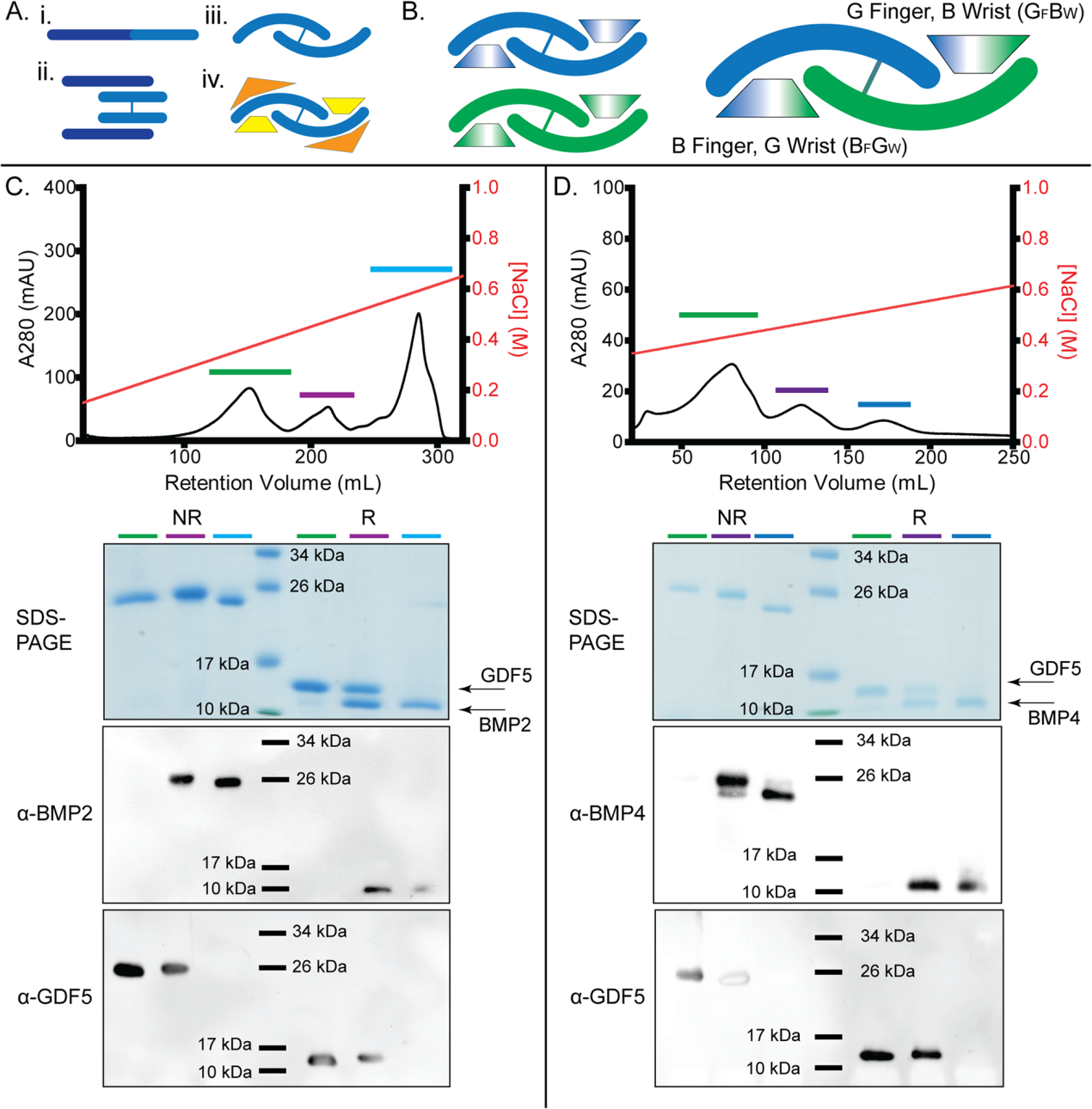
图1:天然BMP生产和异质二聚体制造的原理图
(2) 体外异二聚体和同二聚体信号的比较
先前对其他BMP异二聚体(特别是BMP2/7和BMP2/6)的研究发现,异二聚体往往比同源二聚体更能激活BMP信号。为了确定这是否适用于BMP2/GDF5和BMP4/GDF5异源二聚体,我们使用BRITER成骨细胞系测试了信号活性。BRITER细胞系通过SMAD 1/5/9表达荧光素酶以响应BMP信号。在该检测系统中,BMP2/GDF5和BMP4/GDF5异质二聚体都是有效的信号分子,EC50值分别为1.7和1.1 nM(图2)。与BMP2、BMP4或GDF5同质二聚体相比,异质二聚体的EC50值比所有同质二聚体低约3-5倍(图2)。此外,BMP2/GDF5和BMP4/GDF5异质二聚体的信号比用等量的同质二聚体BMP2+GDF5或BMP4+GDF5组合培养的细胞更强(图2)。此外,在配体浓度较高时,异质二聚体比各自的同质二聚体表现出更大的信号。
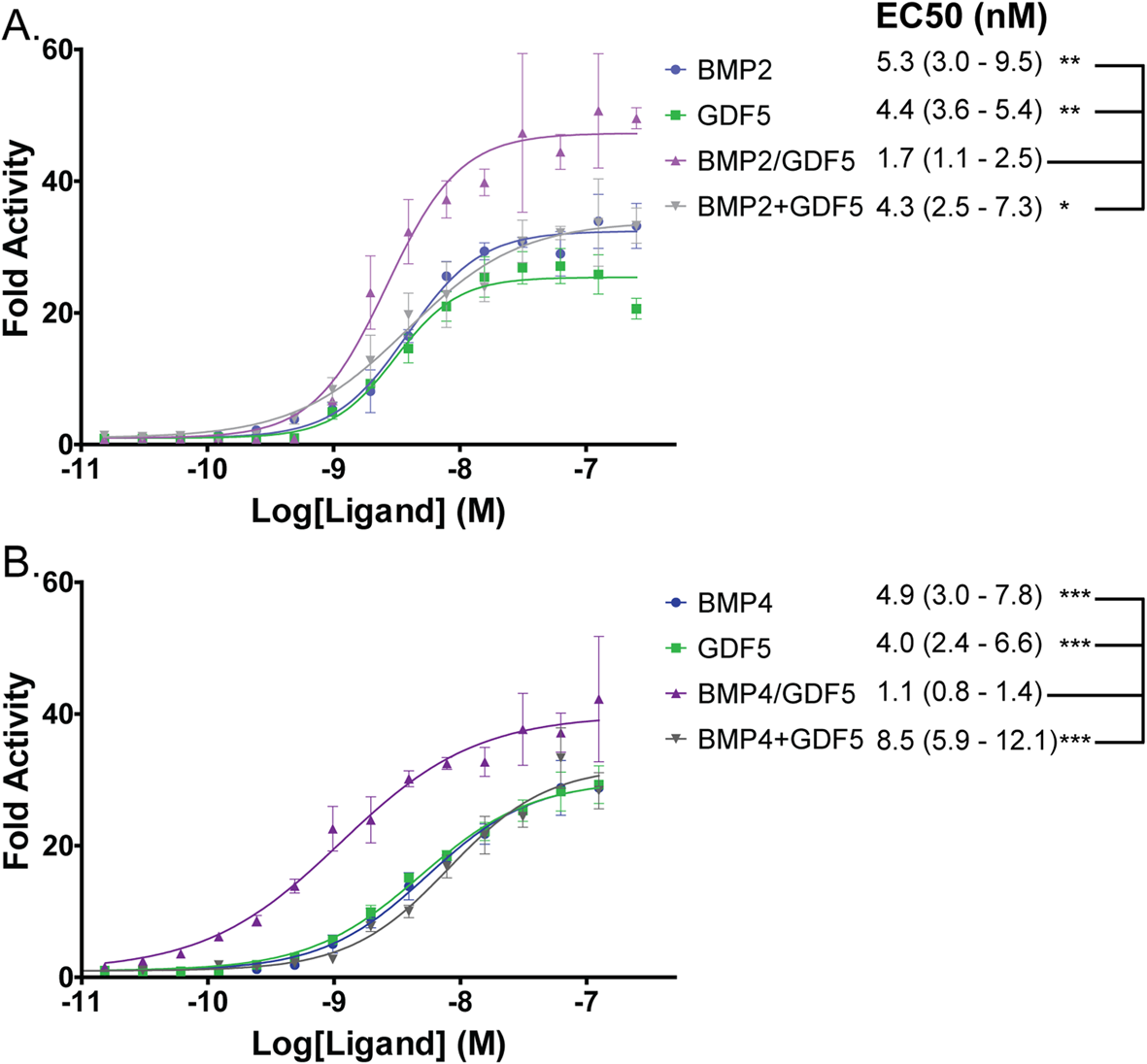
图2:异二聚体在体外比同二聚体更有效
(3) 异二聚体和同二聚体信号在体内的比较
我们使用Xenopus显影试验来测量BMP同二聚体与异二聚体的活性。重组配体或溶剂对照被微量注射到爪蛙囊胚的囊胚腔中,并允许它们发育约46小时,直到它们达到蝌蚪期(NF37期),那时它们被评分为腹化。首先,进行了剂量反应实验,以确定引起具有最低致死率的表型的最小有效剂量;极度腹化胚胎在原肠形成时停止并随后死亡(图3A)。注射了0.15 pmol和0.5 pmol蛋白质的胚胎使用背前指数(DAI)盲目评分,该指数可以测量胚胎腹化异常程度。在这个评分系统中,5分表示发育正常,0分表示腹化程度最严重(图3D)。
与BMP2和BMP4相比,注射异二聚体的胚胎原肠发育停止和致死性更频繁,并且略高于GDF5同型二聚体(图3A)。GDF5同型二聚体比BMP2或BMP4造成更严重的腹化(图3B, C)。这与体外系统相反,在体外系统中,BMP2是最有效的同型二聚体(图2)。与GDF5类似,在所有测试浓度下,注射BMP2/GDF5或BMP4/GDF5异型二聚体与BMP2和BMP4同型二聚体相比,产生了剂量依赖性的腹化增加(图3B, C)。
我们使用全坐位原位杂交方法,在注射后仅数小时,检测了非洲爪蟾原肠胚形成期NF10期的一个亚群。在对照胚胎中,ventx1/2的表达仅限于发育中的原肠的最腹侧(图3E)。注射BMP2和BMP4导致ventx1/2的表达以剂量依赖的方式增加。相比之下,注射GDF5或BMP/GDF5异源二聚体可诱导ventx1/2表达域的剂量依赖性扩张,从原肠顶部扩散到背侧(图3E, F)。与BMP2和BMP4同型二聚体相比,BMP2/GDF5和BMP4/GDF5在体内都具有高度活性(图3B)。
重组配体(BMP2, GDF5和BMP2/GDF5)被注射到斑马鱼胚胎中,无论是WT还是缺乏BMP7的突变体(bmp7asb1aub),以在受精后3小时(hpf)否定内源性BMP信号。30分钟后,注射的胚胎、未注射的WT和突变对照,通过免疫荧光定量核pSMAD5(图4)。在未注射的野生型胚胎中有稳健的信号传导(图4A),但在未注射的BMP7突变型胚胎中没有信号传导(图4B)。以实验确定的0.08 fmol剂量注射同型二聚体BMP2蛋白,以诱导轻度pSMAD5反应(图4C),介于对照胚胎的两个极端之间。与BMP2相比,在此剂量注射同型二聚体GDF5诱导的pSMAD5反应较弱(图4D)。相反,注射BMP2/GDF5异源二聚体比单独注射同型二聚体诱导的pSMAD5反应更强(图4E, F)。这些结果表明,在该模型系统中,BMP2/GDF5异源二聚体比任何一种同型二聚体诱导的pSMAD5信号通路更强。
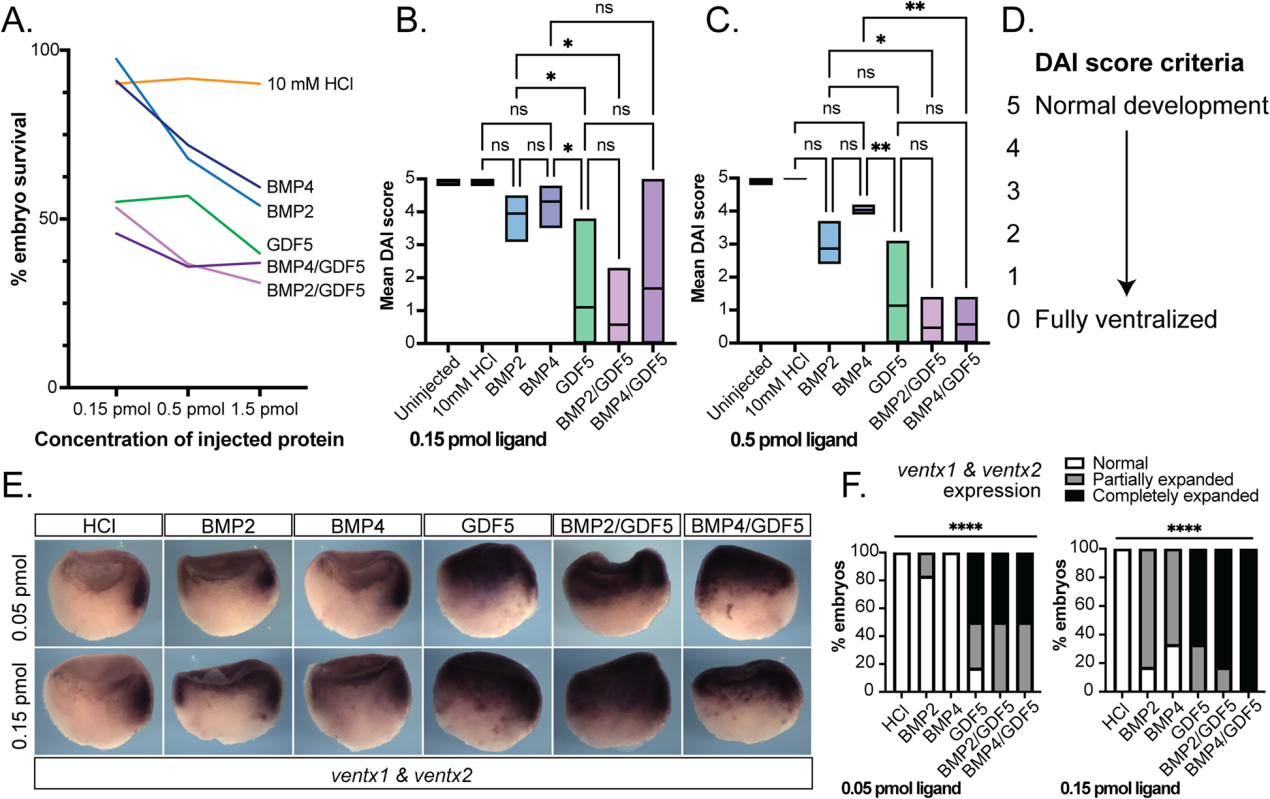
图3:在非洲爪蟾发育试验中,异二聚体比BMP2和BMP4同二聚体信号更强
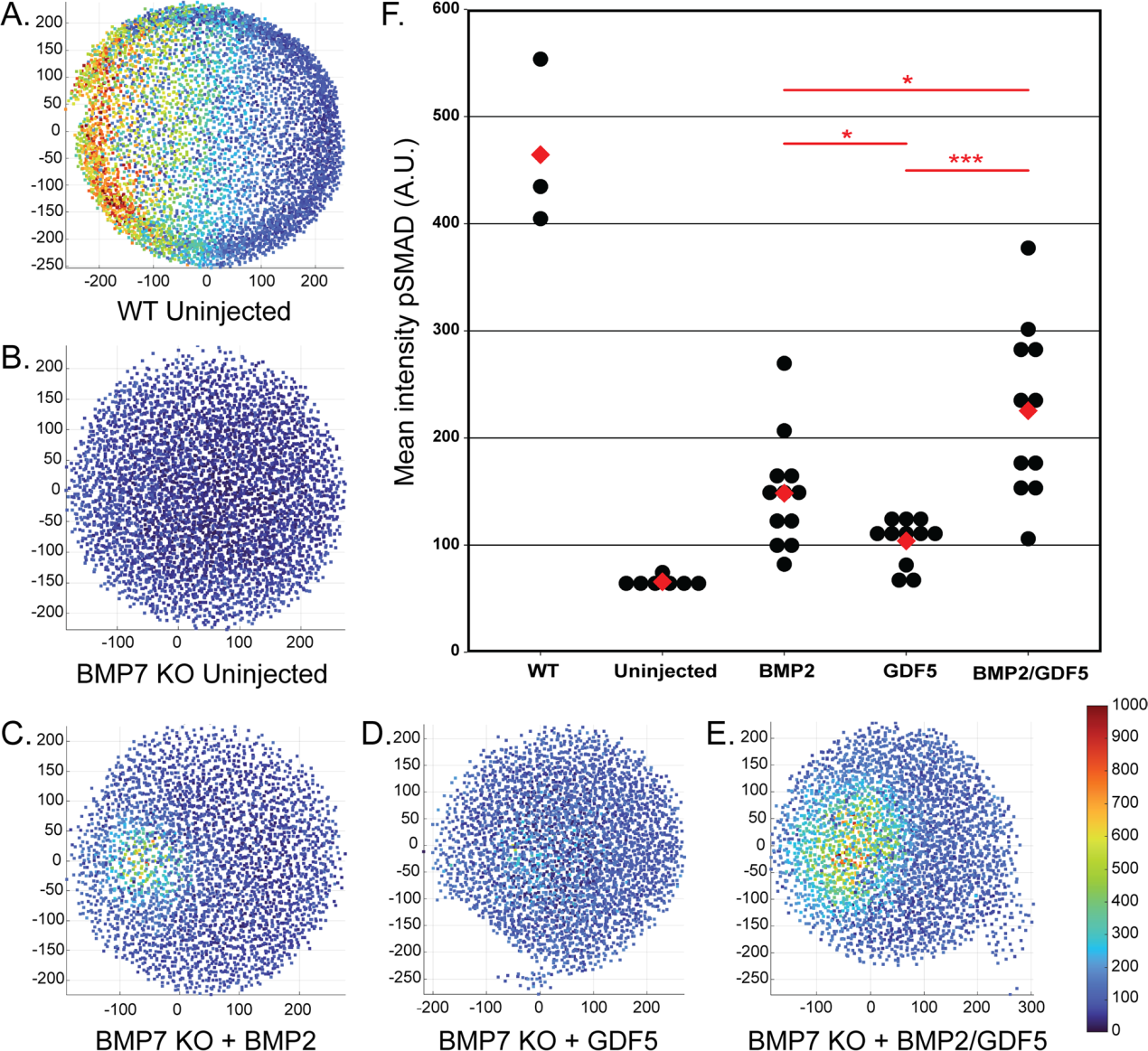
图4:BMP2/GDF5异源二聚体信号在斑马鱼囊胚发育中比BMP2或GDF5同源二聚体更有效
(4) 同型二聚体和异型二聚体受体结合的比较
我们使用表面等离子体共振(SPR)和测量配体与蛋白A SPR芯片结合重组嵌合FC受体。对于1型受体Alk3和Alk6,使用1:1结合模型进行了动力学分析以测量结合和拟合。图5A中显示了表观平衡解离常数(KD)的比较。GDF5对Alk6 (57 pM)的亲和力远高于Alk3 (328pM)。BMP4对Alk3 (72 pM)和Alk6 (113 pM)的亲和力相似,但对Alk3的偏好性较弱。BMP2优先与Alk3 (26 pM)结合,但也保留了与Alk6 (102 pM)结合的能力(图5A)。对于所有三种同型二聚体,较低的结合亲和力主要是由解离率的增加所驱动,因为关联率相似(图5A)。BMP2/GDF5和BMP4/GDF5异源二聚体对Alk3和Alk6都显示出高亲和KD值,且相应的解离速率较慢(图5A)。BMP2/GDF5与Alk3结合的亲和力为32 pM,与Alk6结合的亲和力为26 pM。类似地,BMP4/GDF5与Alk3结合的表观亲和力为29 pM,与Alk6结合的表观亲和力为46 pM(图5A)。实际上,异二聚体保留了它们单体组分的高亲和力,导致分子与更大的受体库具有特别高的结合亲和力。此外,我们还测试了这些蛋白质与Alk2 (BMP6和BMP7的首选目标)或Alk1(与BMP9和BMP10结合)结合的能力。
我们使用SPR来确定BMP配体和2型受体之间的相对结合亲和力。由于2型受体的结合位点被分离到单个链上,我们假设异二聚体对2型受体具有与同源二聚体相当的亲和力。与1型受体相比,这种快速的解离与BMP配体对2型受体的亲和力明显较弱相一致,这意味着更短暂的相互作用。这些极快的缔合和解离速率足够接近于渐近,以至于分析软件无法使用动力学模型拟合数据。因此,对这些SPR数据集进行了稳态结合分析,以确定表观结合亲和力。
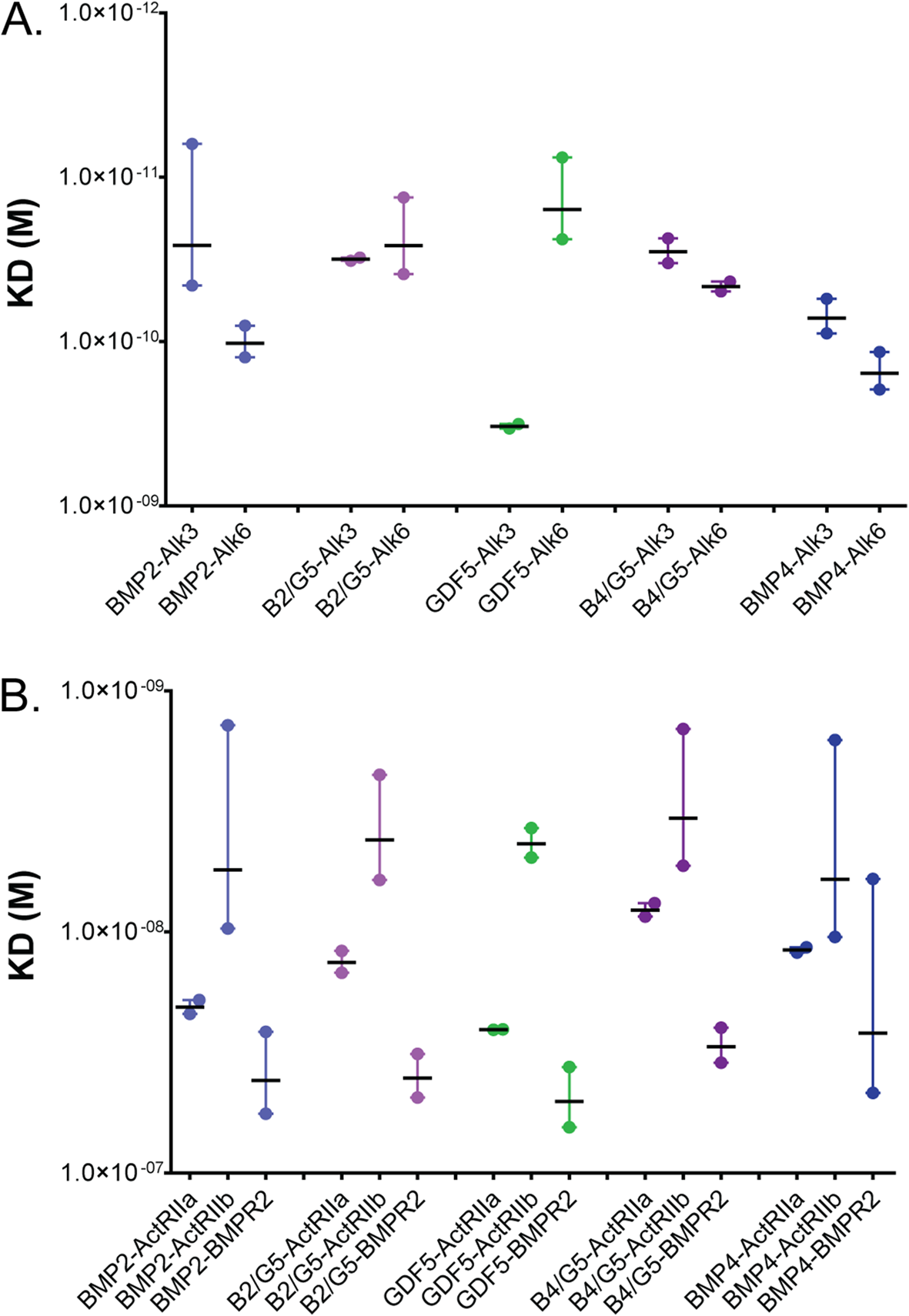
图5:SPR测定1型和2型受体亲和力
(5) BMP同二聚体和异二聚体拮抗作用的比较
由于BMP配体受到细胞外蛋白拮抗剂的高度调控,我们接下来想确定异质二聚体是否受到BMP拮抗剂的差异调控。已有研究表明,BMP2/BMP7异源二聚体不被细胞外拮抗剂Noggin中和,而Noggin已知能有效拮抗BMP2和BMP7同源二聚体。对于BMP异质二聚体疗效的增加,特别是在体内,一种可能的解释可能与细胞外拮抗剂的活性有关。我们使用BRITER荧光素酶报告试验测试了几种不同的细胞外蛋白拮抗剂(具有不同的结合方式和配体偏好)对BMP信号通路的影响。具体来说,我们测试了Noggin、Grem2和NBL1。Grem2和Noggin在低浓度时都能有效拮抗BMP2和BMP4,IC50浓度约为1 nM,而抑制GDF5信号则需要更高的浓度,Grem2的IC50为38 nM,Noggin的IC50为42 nM (图6)。Noggin和Grem2均可拮抗BMP2/GDF5和BMP4/GDF5异源二聚体,拮抗浓度与抑制BMP2和BMP4所需的浓度相似(图6)。虽然NBL1对异源二聚体的拮抗程度略高,尤其是BMP2/GDF5(图6),但NBL1对所有检测蛋白的拮抗作用相对较弱。这些结果表明,BMP2/GDF5和BMP4/GDF5异质二聚体都被已知的靶向BMP同型二聚体的细胞外拮抗剂有效抑制,并且与这些拮抗剂的不同相互作用不太可能导致细胞培养和体内实验系统中观察到的活性差异。
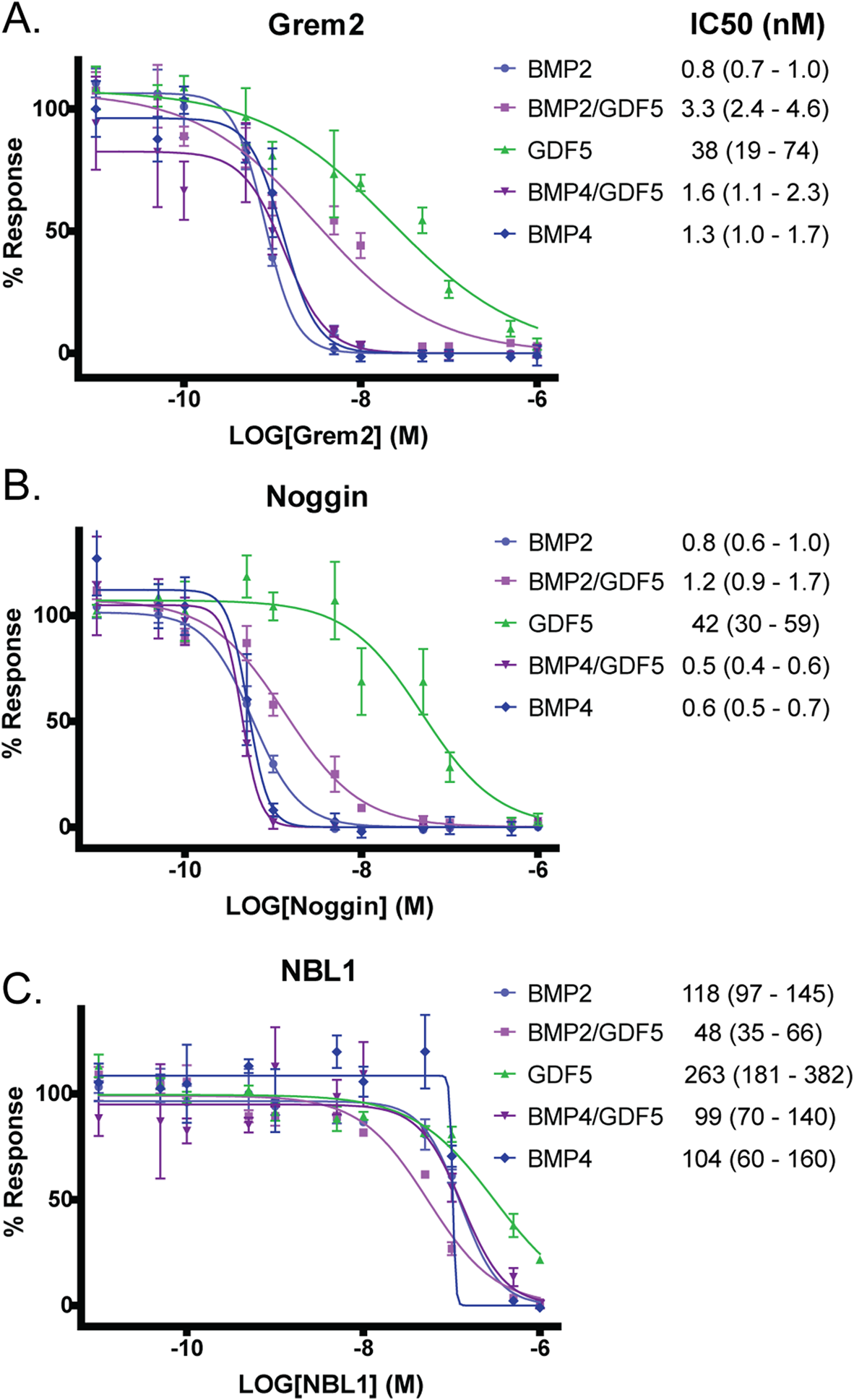
图6:蛋白质拮抗剂对异质二聚体和同源二聚体抑制活性的比较
(6) BMP2/GDF5异源二聚体的晶体结构
我们改进的氧化复折叠方案有效地产生毫克量的BMP2/GDF5。使用这种蛋白质,我们能够很容易地解决BMP2/GDF5的X射线晶体结构,分辨率为2.8 Å(图7A)。这使我们有机会直接交叉比较异质二聚体的结构与先前解决的BMP2和GDF5同型二聚体的结构。BMP2/GDF5异源二聚体显示出BMP生长因子的特征形状,然而,二聚体清楚地显示出不对称的外观(图7A)。这与所有已发表的BMP配体结构形成鲜明对比,包括载脂蛋白结构和包含其他蛋白质结合伙伴的复杂结构,它们保持相同的基本对称形状。因此,在许多先前的结构中,不对称单位只包含配体的一半。由于配体的不对称性,不对称单元由两个完整的二聚体组成。对于171 Cα,两种二聚体的RMSD为0.28,表明每种二聚体的晶体填充方式不同,对每种配体的整体形状影响不大。
异质二聚体和同质二聚体结构之间的显著差异发生在手指的弯曲上。与apo-BMP结构相比,异质二聚体的BMP2一半在形成BMP折叠的“手指”的β-链中显示出更小的曲率。当使用DynDom(可以用来测量结构之间畴向的差异)进行分析时,异源二聚体结构的曲率下降了23°,铰链点位于“手指”区域,从二聚体二硫半胱氨酸测量到19 Å(图6B)。相反,与apo-GDF5相比,GDF5一半的β链曲率略有增加(图6B)。在这里,分歧点(“铰链”)发生在非常接近“指尖”的尖端,27 Å远离中央二硫键,最大限度地减少了与apo-GDF5结构不同的残基数量。因此,异质二聚体的手指可以被描述为在BMP2侧打开,在GDF5侧关闭。手指在二聚体上曲率的整体差异是生长因子形状不对称的原因。
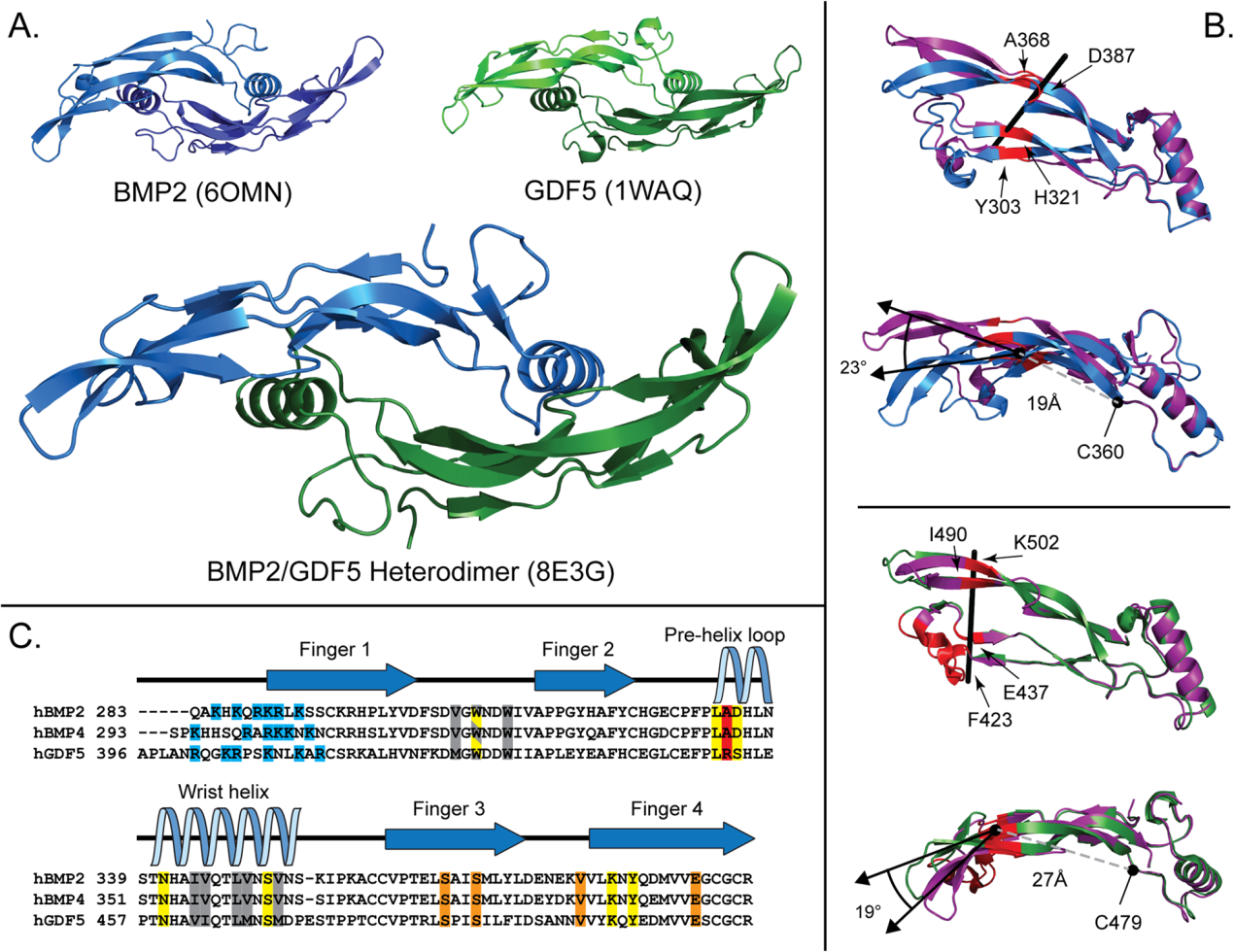
图7:BMP2/GDF5异源二聚体的结构及1型受体结合位点与同源二聚体的比较
(7) 表面静电分析
BMP2/GDF5异质二聚体与BMP2和GDF5同型二聚体之间的肝素/HS结合亲和力差异最初是在我们的蛋白质生产方案中观察到的,其中肝素亲和层析用于将异质二聚体与同型二聚体分离。当比较同型二聚体和异型二聚体结构的溶剂静电势时,可以观察到这种差异。带正电的表面(蓝色)对应于带正电的残基簇,包括精氨酸和赖氨酸,并与肝素/HS结合区域密切相关(图8)。BMP2的HS结合位点已经确定地定位于成熟多肽的N端、面向细胞的蛋白质基部的赖氨酸和精氨酸残基斑块(QAKHKQRKRLK-) (图7C和8,底部)。BMP4和BMP2都有三个连续长度的碱性氨基酸,在BMP4的情况下,这被证明是肝素结合的关键驱动因素(图7C)。GDF5具有与BMP2和BMP4相似数量的赖氨酸和精氨酸残基,但它们分布在较长的N端延伸处,导致局部正电荷浓度较低(图7C)。此外,GDF5在二聚体的底部带极负电荷,这可能抵消了在表面正面观察到的较小阳性斑块的影响(图8)。GDF5较低的肝素结合亲和力导致报道的哺乳动物血清水平比其他BMP高10-20倍。利用晶体结构分析了BMP2/GDF5异质二聚体的静电表面。该分析表明,BMP2/GDF5异源二聚体在该位点上显示了一个更中性的表面,并从其BMP2的一半保留了足够的正电荷残基,以形成一个更有限的肝素/HS结合基元,这与其观察到的中间肝素结合亲和力一致(图1和8C)。
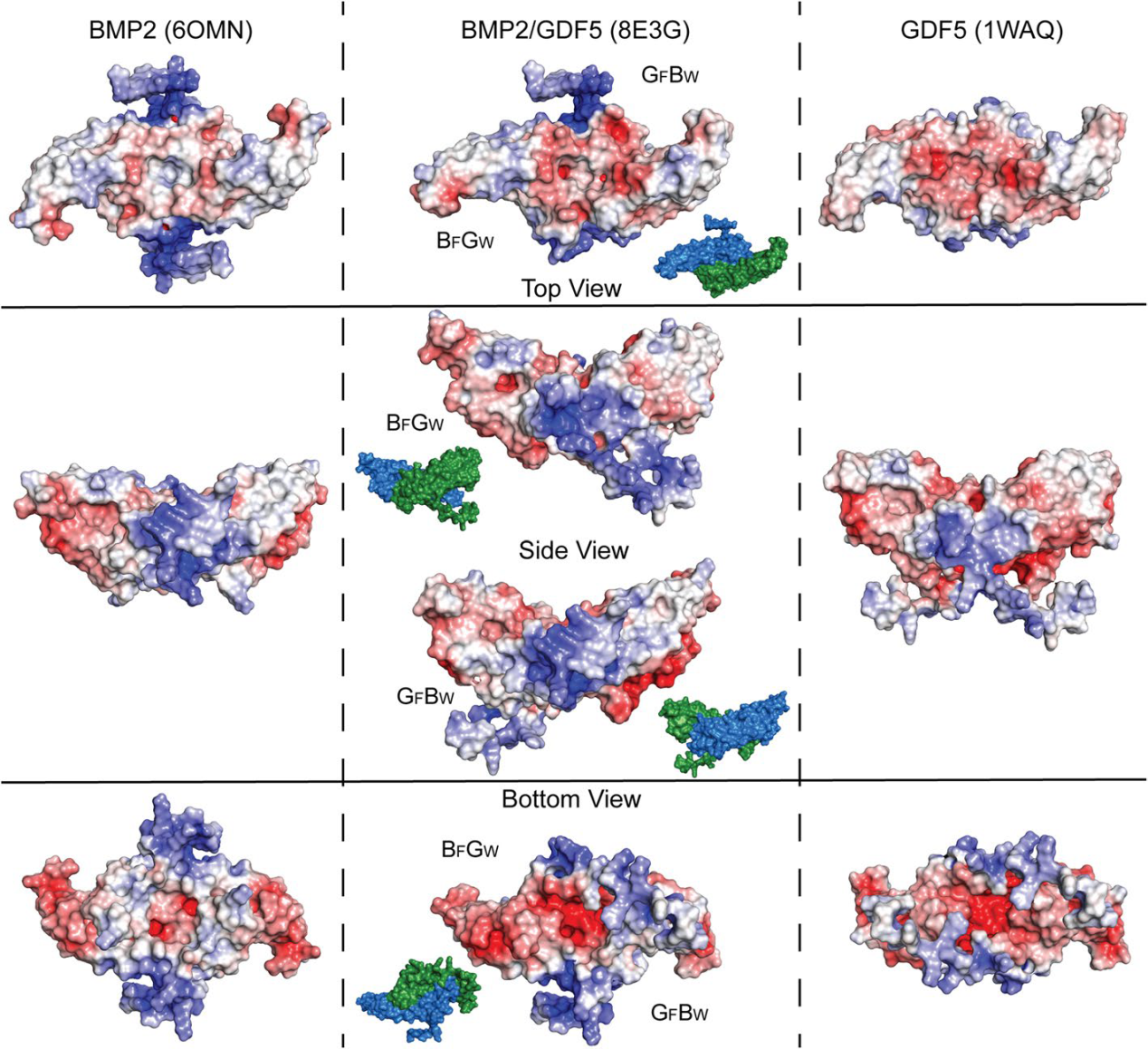
图8:BMP2/GDF5与各自同型二聚体的静电比较
(8) BMP2/GDF5结构中的1型结合位点分析
之前的结构已经阐明了Alk3和Alk6分别如何与BMP2和GDF5结合。这两种配体之间有许多相似之处:受体复合物结构,结合位置保守,疏水相互作用主导界面,包括疏水三联体位于一个单体的凹指区和第二个单体的腕螺旋面(图7C)。类似的氢键也能促进受体结合(图7C)。在BMP2的L333的主干和Alk3的Q109之间形成了一个关键的氢键,当突变为脯氨酸时,该氢键被干扰,导致受体结合和信号传导消融。这种特殊的氢键在GDF5与Alk6结合的结构中也很明显,尽管其必要性尚未得到实验验证。受体结合界面的这些相似性被认为是通过Alk3和Alk6的BMP2信号,在很大程度上可以互换。然而,一个关键的区别,也是GDF5对Alk3的亲和力明显低于Alk6的原因,是紧跟着这个关键氢键在L333 (GDF5中的L451)的残基之间的差异,即BMP2中的Ala和GDF5中的Arg。BFGW结合位点可能优先与Alk6而不是Alk3结合。事实上,Alk3和Alk6在该位点的叠加表明R438会与Alk3发生立体碰撞,就像在同型二聚体GDF5中一样。然而,由于手指曲率的差异,1型位点更加开放,这使得几个疏水残基远离叠加受体。因此,虽然BFGW位点保留了GDF5的歧视性R438残基,但口袋的整体形状更加开放,这可能使受体的定位与同源二聚体略有不同。GFBW结合位点的功能可能类似于同二聚体BMP2,对Alk3的偏好超过Alk6,并且能够通过这两个受体发出强烈的信号。
我们试图获得关于异源二聚体中每个独特位点的受体特异性的实验信息,并研究BFGW结合口袋中Alk3亲和力增加的可能性。我们利用了BMP2突变L333P,它破坏了1型受体的结合,以破坏异质二聚体一半上的受体结合。首先,产生具有L333P突变的BMP2同型二聚体作为对照,并在荧光素酶报告试验中显示不发出信号。使用L333P BMP2,我们与WT GDF5形成并分离了一个异源二聚体,预计它的一半(GFBW)上有一个中断的1型受体结合,在另一边(BFGW)上留下一个单一的功能位点。采用1:1结合模型,突变异质二聚体BMP2_L333P/GDF5与Alk3和Alk6结合的亲和力远低于同型二聚体GDF5,与仅具有单一1型受体结合位点的突变体一致。虽然在该结合系统中很难区分亲和性和亲和性的影响,但Alk3和Alk6结合的相对减少是相似的。因此,异二聚体对1型受体整体亲和力的增加可能是由于在一个信号配体中有两个不同的高亲和力位点,其中一侧表现为GDF5配体,另一侧表现为BMP,特异性由手腕区域决定。我们无法通过破坏BFGW位点来复制这些发现,因为GDF5突变不能正确地折叠。
结论:我们开发了新的BMP2/GDF5和BMP4/GDF5异源二聚体,它们比同源二聚体BMP2,BMP4更有效地发出信号。异质二聚体显示出肝素亲和力的差异,并可能保留类似于GDF5的更高扩散势。
参考文献:Gipson, G. R., Nolan, K., Kattamuri, C., Kenny, A. P., Agricola, Z., Edwards, N. A., Zinski, J., Czepnik, M., Mullins, M. C., Zorn, A. M., & Thompson, T. B. (2023). Formation and characterization of BMP2/GDF5 and BMP4/GDF5 heterodimers. BMC biology, 21(1), 16. https://doi.org/10.1186/s12915-023-01522-4.






