tRF-Gln-CTG-026通过减轻整体蛋白合成来改善肝损伤
肝脏执行各种生物学功能以维持体内平衡,如糖原储存、营养代谢、胆汁分泌和蛋白质合成。当发生肝损伤时,肝细胞会经历巨大的损伤应激,导致出血性坏死、肝细胞凋亡、肝脂肪变性和肝脏炎症等。由急性肝衰竭、肝硬化、癌症及其他原因引起的肝损伤是全世界众多死亡的重要原因。肝移植几乎是促进生存的唯一治疗方法,却受副作用和供体短缺的限制。肝脏可以有效地将小RNA输送到其中,小RNA疗法可能为肝损伤开辟一条新途径。tsRNA(tRNA衍生的小RNA)参与应激反应,并与损伤有广泛的关联。尽管tsRNA在调节应激反应和损伤方面发挥重要作用,但由于缺乏以治疗为重点的研究,tsRNA尚未被开发为减轻疾病的小治疗RNA。该研究发表于《Signal Transduction and Targeted Therapy》,IF:38.104。
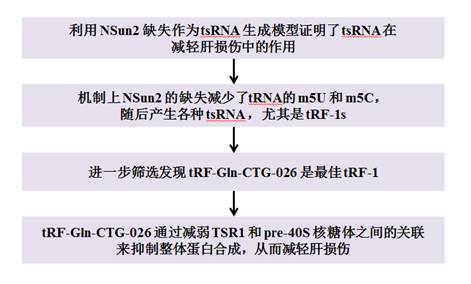
技术路线:
主要研究结果:
1. 建立NSun2缺失作为tsRNA生成模型以减轻体外损伤
作者首先在小鼠中诱导肝损伤,以验证tsRNA是否参与肝损伤和修复(图1a)。作者发现在肝损伤小鼠中,tsRNA的数量增加(图1b),说明tsRNA的产生与肝损伤有关。为了进一步研究tsRNA与肝损伤的关系,有必要建立tsRNA生成模型。作者首先在体外细胞实验中定义中高、低损伤应激的标准。对H2O2HL-7702和AML12细胞进行剂量梯度实验。由此,作者将10μM H2O2应激定义为低H2O2应激或增殖应激,不会导致细胞死亡,但会抑制细胞生长;将HL-7702的500μM H2O2应激和AML12的100μM H2O2应激定义为高H2O2应激、致死应激或生存应激。通过筛选HL-2细胞系中的三种tRNA修饰酶(NSun1,Mettl2和Dnmt7702),在低损伤应激下,与ME-KD(Mettl2敲低)和DN-KD(Dnmt1敲低)相比,NSun2敲低(NS-KD)导致增殖增加(图1c,e);此外,在高应激下,NSun2敲低提高了细胞存活率(图1d,e)。为了进一步探索NS-KD在细胞损伤中的作用,作者使用生长曲线实验测量了在低H2O2应激下连续5天的细胞增殖。结果表明,在H2O2处理下,NS-KD促进细胞增殖(图1f)。相比之下,作者应用了不同的高强度应激诱导剂(CCl4、对乙酰氨基酚和油酸混合物)并测量了细胞存活率。结果表明,NS-KD改善了细胞在应激损伤下的存活率(图1g,i)。正如预期的那样,NS-KD仅在应激下起作用。在基础条件下,NS-KD不影响细胞增殖(图1h,i)。总之,这些结果表明肝损伤与tsRNA的产生有关,NS-KD促进了体外应激下的细胞增殖和存活,但不改变细胞迁移。
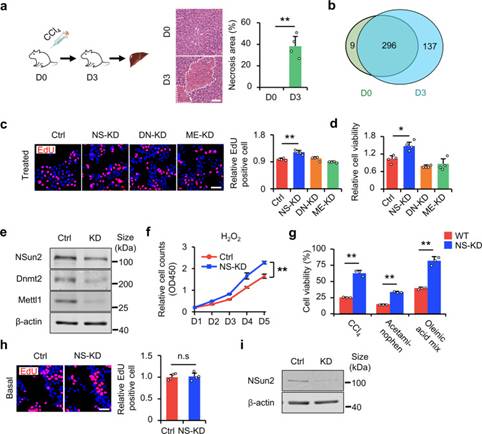
图1 NS-KD减轻细胞损伤
2. NS-KO减轻肝脏损伤
如上所述,NSun2的缺失是一个合适的研究tsRNA模型,可以提高细胞在应激下的增殖和生存。因此,作者通过CRISPR / Cas9介导的NSun2基因第2外显子中56 bp缺失产生了NS-KO小鼠(图2a)。在功能上,作者首先验证了NSun2缺失突变体是否对肝损伤的应激有反应。在没有应激损伤的情况下,NS-KO没有引起肝脏形态和病理生理学的异常(图2b),这表明NS-KO和由此产生的tsRNA在没有应激的情况下都没有发挥作用。通过腹腔注射CCl4建立短期或长期肝损伤模型(图2c),作者证明了NS-KO对应激损伤有反应,并减轻了肝损伤。在CCl4单次注射后第3天,肝脏出现坏死和炎症;第27天,大鼠出现肝纤维化。NS-KO小鼠的坏死程度低于野生型(WT)小鼠(图2d)。检测单次或重复注射CCl4后的血液生化指标。丙氨酸转氨酶、天冬氨酸转氨酶和碱性磷酸酶在CCl4单次注射后第3天达到最大值,肝细胞损伤严重,在CCl4重复注射后第27天降至正常水平。NS-KO小鼠的所有三项指标均低于WT小鼠,这意味着NS-KO小鼠的肝损伤轻微(图2e,f)。为了研究NSun2缺失如何改善肝损伤,作者通过BrdU掺入和Ki67染色检测肝细胞增殖。与WT小鼠相比,作者发现NS-KO小鼠在肝损伤第3天增殖的肝细胞数量显著增加(图2g)。作者还使用原位切口末端标记法检测了NSun2缺失如何影响细胞死亡。结果提示肝细胞凋亡在肝损伤后第3天达到峰值,然后逐渐下降。与WT小鼠相比,NS-KO小鼠中检测到较少的凋亡肝细胞,这意味着NSun2的缺失抵抗了细胞凋亡(图2h)。在应激条件下,促增殖、促生存和抗炎相关基因的表达增加,而抗增殖、抗存活和促炎症相关基因的表达被抑制(图2i)。总之,作者观察到在短期和长期肝损伤方面NS-KO小鼠的肝损伤均比WT小鼠轻,这表明NSun2缺失可减轻体内肝损伤。
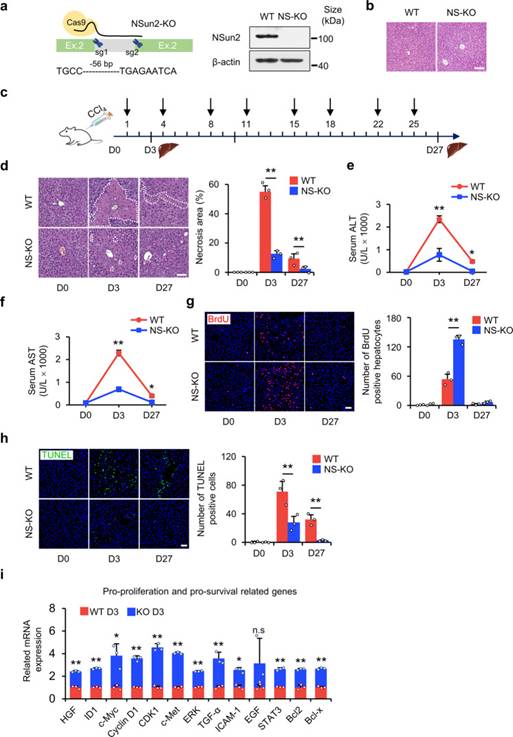
图2 NS-KO改善体内肝脏坏死、再生和存活
3. NS-KO衍生的小RNA可促进细胞在应激下的增殖和存活
作者假设,NS-KO通过NS-KO衍生的小RNA预防肝损伤。为了验证这一假设,作者首先在HL-7702细胞系中敲低NSun2基因,将无酶活性的突变型NSun2(K190M或C271A)转染到HL-7702细胞系中,并对细胞进行细胞毒性刺激。EdU掺入实验和细胞增殖实验表明,只有WT NSun2抑制了NSun2敲低引起的细胞增殖促进(图3a,b,d),而不是NSun2突变体(K190M或C271A)。同样,只有WT NSun2逆转了NS-KD诱导的细胞活力增加;NSun2突变体则没有(图3c,d)。这些结果表明,NSun2的缺失主要通过tRNA甲基转移酶活性的缺失促进细胞在应激下的增殖和存活。当NSun2失去甲基转移酶活性时,tRNA修饰不可避免地减少。在NS-KO细胞中,tRNA表达降低(图3e)。最显著的变异是tRNA m5U和前面描述的M5C.13两者在NS-KO样品中显著降低(图3f,g)。
上述结果表明,NS-KO在减少tRNA m5U和m5C修饰的同时,失去了其甲基转移酶活性。然后作者研究了NS-KO衍生的小RNA是否足以改善细胞在应激下的增殖和存活。作者从WT和NS-KO小鼠中分离出14-50 nt和50-100 nt的肝RNA片段(作为阴性对照)(图3h)。由于tsRNA的大小总是小于50 nt,作者认为14-50 nt的RNA是含tsRNA的RNA,50-100 nt的RNA是非tsRNA和阴性对照。作者首先检测了14-50 nt RNA和50-100 nt RNA 在低H2O2应激下的增殖差异。EdU掺入实验显示,与WT小鼠的片段相比,NS-KO小鼠的14-50 nt的RNA片段转染增加了细胞增殖(图3i)。同样,CCK-8检测表明,来自NS-KO小鼠的14-50 nt RNA片段增加了损伤后的细胞存活率,而来自WT小鼠的14-50 nt RNA片段和来自两种小鼠的50-100 nt RNA片段(图3j)。因此,NS-KO衍生的14-50 nt RNA片段在促进损伤后的细胞增殖和存活中发挥重要作用。
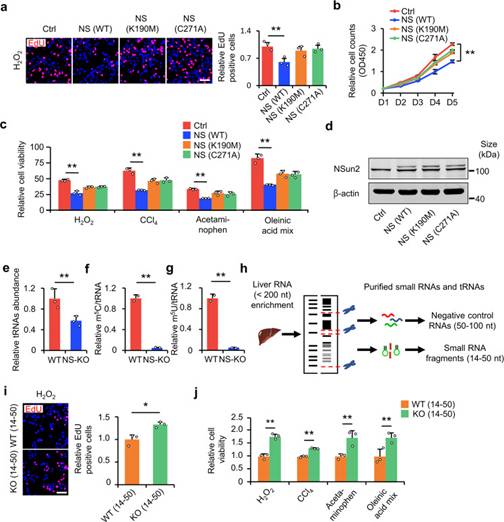
图3 NS-KO来源的tsRNA可减轻肝损伤
4. tRF-1是NS-KO的重要产物
为了全面分析tsRNA的代谢特性,分析WT和NS-KO小鼠在不同应激损伤后tsRNA的差异,作者首先确定了NSKO对miRNA的数量没有明显改变(WT52.96%,NS-KO 53.12%)。通过tRNA衍生的小RNA测序(tsRNA-seq),作者鉴定了tRFdb数据库中记录的841个未记录的tsRNA和104个已知的tsRNA(图4a)。然后,作者通过比较来自WT和NS-KO小鼠的样品来分析tsRNA表达,并鉴定出366个上调和267个下调的tsRNA,表明NS-KO引起的tsRNA上调多于下调。有趣的是,NS-KO小鼠中的tsRNA在整个损伤过程中保持相对较高的水平,而WT小鼠的tsRNA在D3达到峰值(图4b)。因此,作者假设在整个CCl重复注射期间,第3天是肝细胞增殖和tsRNA生成最活跃的时间(图2g,4b)。这些结果表明,NSun2缺失增加了NS-KO小鼠的tsRNA,并预留了足够的tsRNA来应对应激损伤,但在WT小鼠中,tsRNA只能在WT D3产生。
在进一步分析了WT和NS-KO小鼠在肝损伤不同阶段的tsRNA景观后,作者发现与其他tsRNA相比,NS-KO小鼠中的tRF-1s突然增加。在肝损伤的各个时间点,NS-KO组的tRF-1s明显多于WT组,但WT组仅在第3天增加(图4c,d)。对tRF-1s的详细分析发现,tRF-1s的长度主要在14-23 nt之间(图4d)。一般来说,NSun2表达缺失后,肝脏主要产生14-23nt的tRF-1。作者还检测了tRF-1s的表达,发现其在NS-KO小鼠中的表达高于WT小鼠,而其他类型的tsRNA在NS-KO小鼠中的表达低于WT小鼠(图4e)。同时,基于WT和KO以及WT D0和WT D3之间的差异,作者确定了68个可能起作用的tRF-1。因此,作者确定了tRF-1在NS-KO中增加,分析了tRF-1的分布,并确定了68个NS-KO衍生的tRF-1是预防肝损伤和响应应激损伤的候选tsRNA。
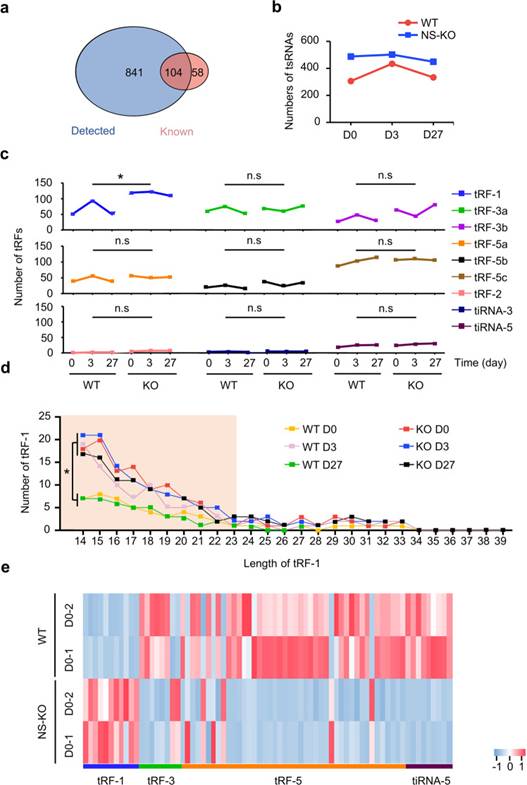
图4 tsRNA-seq显示了tRF-1在WT和NS-KO小鼠中的特征
5. 筛选的tRF-1在体外和体内挽救肝损伤
如上所述,肝损伤的副产物主要是tRF-1。为了阐明tRF-1s是否可以作为肝损伤的潜在治疗方法,作者人工合成了图4所示的68个tRF-1。作者用硫代磷酸酯(PS)、2'-O-甲基(2'-OMe)和胆固醇修饰了tRF-1s,以提高其在体内的稳定性和转染效率(图5a)。将人工合成的tRF-1转染HL-7702细胞和人原代肝细胞(PHH),并在体外和体外验证其功能。EdU掺入试验显示合成的tRF-1s促进细胞增殖(图5b)。CCK-8实验显示过表达tRF-1s后细胞活力提高(图5c)。在PHH实验中,作者也得到了一致的结果(图5d,e)。为了验证修饰的合成tRF-1s在体内的功能,作者将tRF-1s静脉注射到肝损伤小鼠体内。注射68个tRF-1的结果显示损伤减少,肝功能改善(图5F-i)。这些结果表明,68个tRF-1s在体外和体内加速了受损肝细胞的恢复。综上所述,作者发现作者筛选出的tG026在体内减轻了肝损伤(图5J,K),而在NS-KO后tG026的表达增加(图5l,m)。总之,通过筛选,作者确定了tG026可以减轻肝损伤。
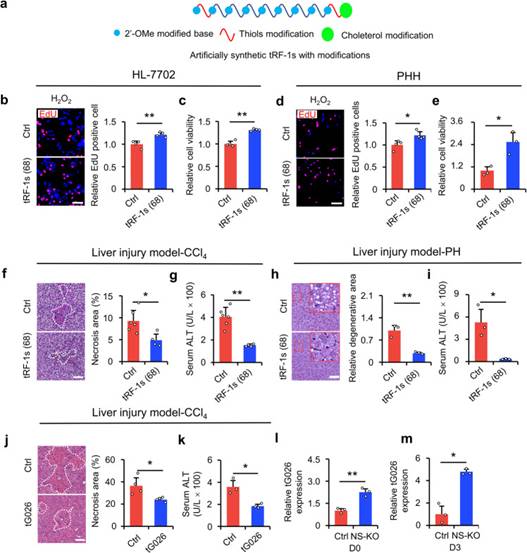
图5 筛选的tG026促进损伤后的细胞增殖和存活
6. tRF-Gln-CTG-026通过调节核糖体组装减少全球整体蛋白质合成
为了探索tG026的潜在机制,作者进行了RNApull-down-LC-MS/MS测定,以筛选与tG026相互作用的蛋白质(图6a)。在寻找与HL-7702和AML12细胞系的tG026共同相互作用的蛋白后,作者选择了参与Pre-rRNA加工蛋白TSR1同源物进行后续实验(图6b)。作者推测tG026可能调节核糖体。通过RNApull-down实验,作者在两个细胞系中验证了TSR1和tG026之间的相互作用(图6c,d)。为了确定tG026如何调节核糖体组装,作者在HL-7702和AML12细胞中过表达tG026。结果表明,tG026不改变18S rRNA的表达,但抑制了TSR1和18S rRNA之间的关联。这表明tG026抑制TSR1与核糖体之间的相互作用,因为18S rRNA是核糖体复合物的重要组成部分(图6e,f)。最后,tG026抑制GPS(图6g,h)。综上所述,NSun2缺失会导致tG026的产生。tG026通过抑制TSR1与18S rRNA之间的关联来缓解GPS,以促进肝损伤后的增殖和存活,可以开发为缓解肝损伤的RNA药物。
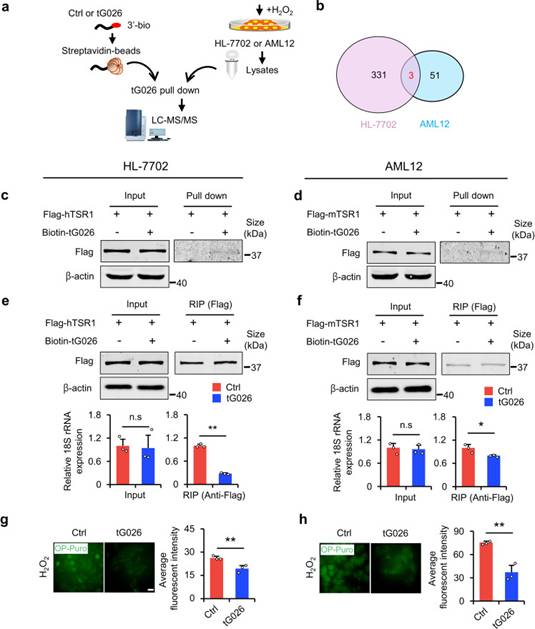
图6 tG026通过抑制TSR1与18S rRNA之间的相互作用来降低GPS
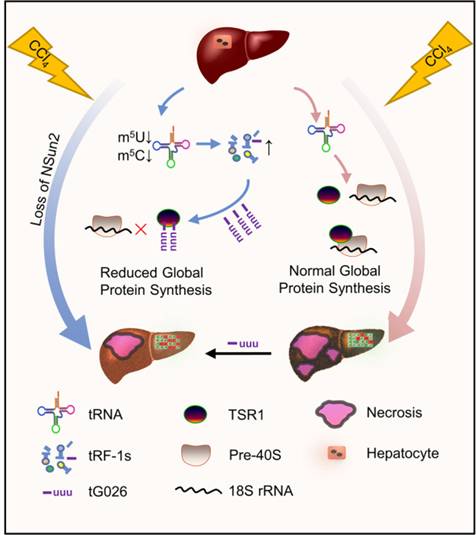
结论:
该研究利用调节GPS的tRNA降解产物RNA降低了RNA毒性。相关机制是通过tG026介导的TSR1和18S rRNA之间相互作用的破坏,这是由于tG026与TSR1的相互作用,阻止了TSR1和Pre-40S核糖体之间的关联。这导致核糖体组装程序的抑制,从而降低GPS。
tG026在肝损伤中的机制模型图:
参考文献:
Ying S, Li P, Wang J, et al. tRF-Gln-CTG-026 ameliorates liver injury by alleviating global protein synthesis. Signal Transduct TargetTher. 2023 Apr 3;8(1):144.






