胱胱硫氨酸-裂解酶(Cth)通过ERK1/2诱导巨噬细胞的胞葬作用,调节肠屏障修复
肠缺血再灌注损伤(I/R)引起的炎症反应与危重患者的感染性并发症和死亡率密切相关,及时有效清除凋亡细胞是降低炎症反应的重要组成部分。近日有研究发现胱胱硫氨酸-裂解酶(Cth)可激活ERK1/2信号通路,诱导巨噬细胞的胞葬作用,从而促进肠屏障修复。该研究发表在《Cell Communication and Signaling》,IF:7.525。
技术路线:

主要研究结果:
1. I/R条件下的胞葬发生并在体外和体内产生抗炎修复表型
为了阐明吞噬作用对抗炎修复表型的必要性,我们设计了巨噬细胞和凋亡内皮细胞共培养的体外实验。在实验组中,我们分别在缺血和缺氧环境下使用原代培养的小鼠骨髓源巨噬细胞和THP -1细胞诱导的人源巨噬细胞与凋亡的IEC-6和Caco-2细胞系共培养(图1)。为了确定非特异性巨噬细胞吞噬是否具有相同的效果,我们用羟化珠培养巨噬细胞作为对照。在与凋亡的IEC-6细胞共培养的小鼠源性巨噬细胞和与凋亡的Caco-2细胞共培养的人源性巨噬细胞中,吞噬细胞对凋亡细胞的吞噬能力强于羟酸珠(图1A)。此外,我们发现,在与凋亡的IAC -6细胞共培养的鼠源性巨噬细胞组和与凋亡的Caco-2细胞共培养的人源性巨噬细胞组中,修复标志物血红氧合酶-1 (Hmox1)和dectin-1 (Clec7a),特异性促炎症消退介质(SPMs) RvD1、RvE1和LipoxinA4和抗炎因子IL-10均高于巨噬细胞和羟基化珠共培养组(图1B-D),而促炎因子CD86和TNF-α低于巨噬细胞和羟化珠共培养组(图1D)。这些结果表明,胞葬对于产生抗炎和修复表型是必需的。
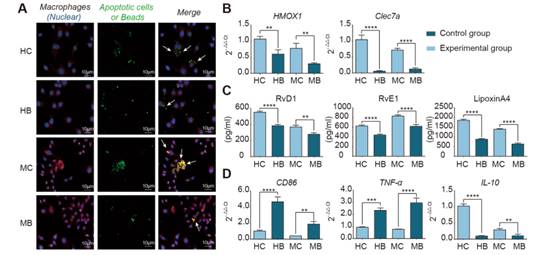
图1在体外,吞噬凋亡的内皮细胞可以诱导巨噬细胞的修复表型
在体动物模型中,I/R后肠内是否发生胞葬尚不清楚;因此,我们使用了体内肠胞葬检测技术(图2A)。我们发现,I/R后巨噬细胞对死亡细胞的吞噬作用逐渐增强(图2C),胞葬指数逐渐升高(图2B),随着I/R后恢复时间的延长,泡腾标志物AXL、CD36和UCP2逐渐升高(图2D)。这些结果提示,胞葬表型不仅存在于肠道内,而且随着损伤修复时间的延长,胞葬表型逐渐增加。接下来,我们进一步研究了胞葬促进I/R肠屏障修复的机制。
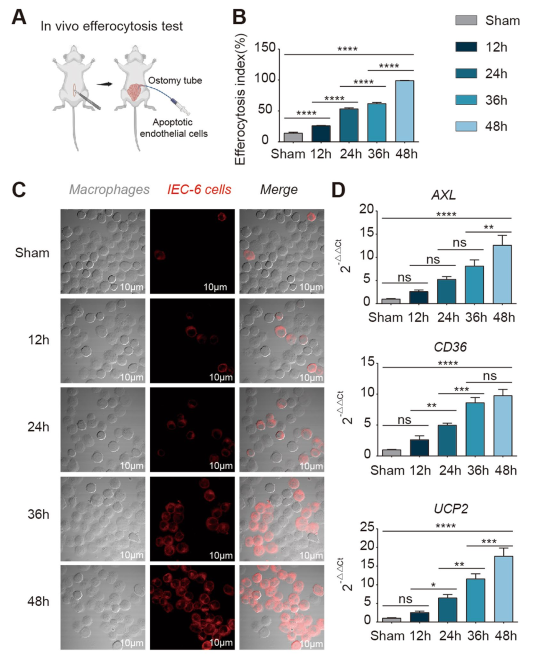
图2在体内,受损肠管内存在胞葬现象,胞葬水平随I/R时间延长逐渐升高
I/R诱导的胞葬后,大量基因表达发生改变。为了更好地理解I/R后巨噬细胞的遗传改变,我们在通过流式细胞术选择巨噬细胞后的动物模型中进行了转录组测序分析(图3)。主成分分析(PCA)显示,I/R术后12 h组与24 h、36 h和48 h组的样本分层良好(图3A)。然后,我们使用热图可视化54个基因在I/R后12 h和24 h的表达变化(图3B),包括28个随着I/R时间延长而下调的基因,这些基因主要与细胞周期、细胞增殖标志物Mki67和驱动蛋白家族分子Kif20a、Kif2c和Kif11相关。随着I/R时间延长,表达上调的基因有26个,这些基因中的许多可以发挥保护作用。因此,我们重点研究了这些随着I/R时间延长而上调的基因。
为了确定可以驱动巨噬细胞胞葬的差异表达基因(DEGs),比较了I/R后12 h和36 h,以及I/R后12 h和48 h的基因表达,与热图分析一样,我们在两组比较后发现了许多DEGs(图3C)。更重要的是,巨噬细胞活化的关键增强因子的Cth表达在I/R手术后显著上调。结合PCA结果和热图分析,这些结果提示Cth可能是驱动I/R后巨噬细胞胞葬的关键基因。为了验证这些结果,我们使用PCR和western blotting检测了24 h后I/R组、48 h后I/R组和假手术组的Cth表达,发现与假手术组相比,后I/R组的基因和蛋白表达有显著差异,并且随着I/R时间的增加而增加(图3D)。这一发现与我们的转录组分析结果一致。因此,我们假设Cth可以改变巨噬细胞表型,支持胞葬,在肠屏障损伤修复中具有重要作用。
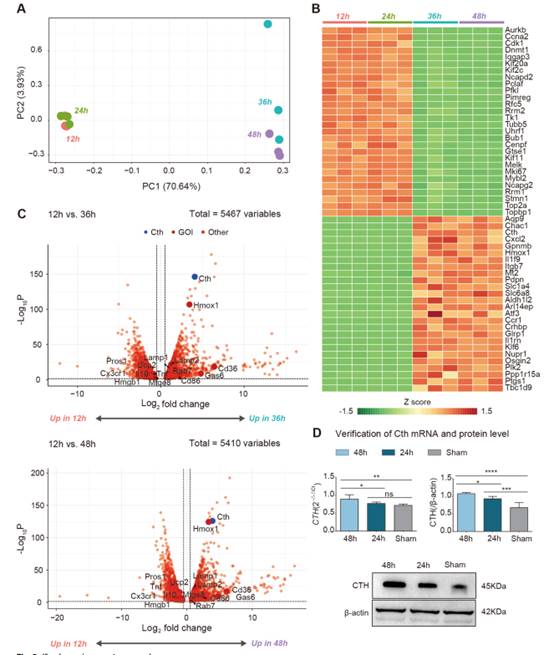
图3转录组测序分析发现,Cth是I/R后胞葬和消退阶段的潜在介质之一
2. Cth通过ERK1/2途径调控肠道炎症和肠屏障损伤恢复
当小鼠经历I/R损伤时,肠屏障损伤的功能指标(I-FABP和d -乳酸)较假手术组显著升高,而当I/R小鼠腹腔注射Cth激动剂MCH时,有下降趋势;相反,当给予小鼠腹腔注射Cth抑制剂PAG时,I-FABP和d -乳酸升高(图4A)。同样,与假手术组相比,Cth激动剂MCH抑制了I/R损伤后促炎标志物IL-6和TNF-α的增加,而Cth抑制剂PAG减缓了这一趋势。此外,通过IL-10和发挥保护修复作用的RvD1、RvE1、LipoxinA4的变化,也可以验证Cth影响抗炎因子和修复肠道表型(图4A)。此外,我们观察了小鼠肠黏膜的形态学变化,发现I/R后肠黏膜绒毛排列紊乱,中间有团块状绒毛,损伤较假手术组严重。当给予Cth抑制剂PAG时,绒毛排列更加紊乱,而给予Cth激动剂MCH时,绒毛排列略微规则(图4B)。这些结果表明,Cth的变化影响肠道的抗炎和肠屏障损伤修复表型。
在I/R模型组给予Cth抑制剂PAG和ERK激动剂PMA腹腔注射后,d -乳酸和I-FABP以及IL-6和TNF-α的升高被逆转,而抗炎因子IL-10和SPMs 的降低被显著升高。在I/R模型小鼠腹腔内给予Cth激动剂MCH和ERK抑制剂PD98059后,趋势相反(图4A)。同样,肠黏膜的形态学变化也呈现出类似的趋势(图4B)。
这些处理对细胞没有影响(图7A),但当共培养体系中过表达Cth的巨噬细胞用PD98059处理时,促炎因子IL-10和SPMs被抑制,而加入PMA后,Cth沉默细胞中IL-10和RvD1、RvE1、LipoxinA4的表达升高(图7B,C)。这些结果表明,Cth调节肠道炎症,肠屏障损伤修复依赖于ERK1/2通路。
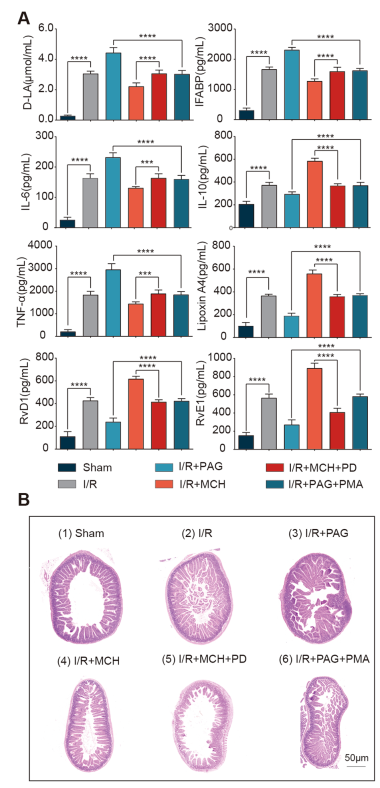
图4体内Cth变化影响肠屏障修复,其机制依赖于ERK1/2通路
3. Cth依赖的ERK1/2通路调节巨噬细胞,导致胞葬增强
为了阐明Cth调节胞葬的潜在机制,我们首先在活鼠模型中检测了Cth对ERK1/2通路和胞葬的影响。当给予Cth抑制剂PAG对I/R模型进行干预时,PCR结果显示,与对照组相比,Cth在基因水平上被显著抑制,但对ERK1/2无影响,胞葬的生物标志物(Axl、CD36、UCP2)也被显著抑制(图5B)。在蛋白水平上,当给予Cth抑制剂时,Cth和胞葬的生物标志物被显著抑制,但只有ERK1/2磷酸化被抑制(图5C, D)。腹腔注射PAG和再次给予PMA后,Cth和胞葬的生物标志物的下降在基因和蛋白水平上被逆转,ERK1/2唯一的变化发生在磷酸化水平(图5B-D)。为了进一步探讨Cth、ERK1/2与巨噬细胞的关系,我们采用荧光原位杂交(FISH)三标记共定位分析,其中Cth被染成绿色,ERK1/2被染成青色,巨噬细胞被染成红色。很明显,在给予Cth抑制剂PAG后,绿色(Cth)被显著抑制,青色(ERK1/2)和红色(功能性巨噬细胞)也被抑制,而当给予ERK1/2激动剂PMA时,这些因子被显著增强(图5A)。
此外,当给予I/R模型小鼠MCH时,与对照组相比,Cth和胞葬的生物标志物的基因和蛋白表达均显著升高。同样,只有p-ERK1/2表达显著增加。在已腹腔注射MCH的I/R模型小鼠中,给予PD98059后,Cth、p-ERK、Axl、CD36和UCP2最初的上升趋势被逆转为下降趋势(图5B-D)。同样,FISH结果一致(图5A)。在活体小鼠模型中,这些结果表明,Cth调节的巨噬细胞胞葬表型依赖于ERK1/2通路。
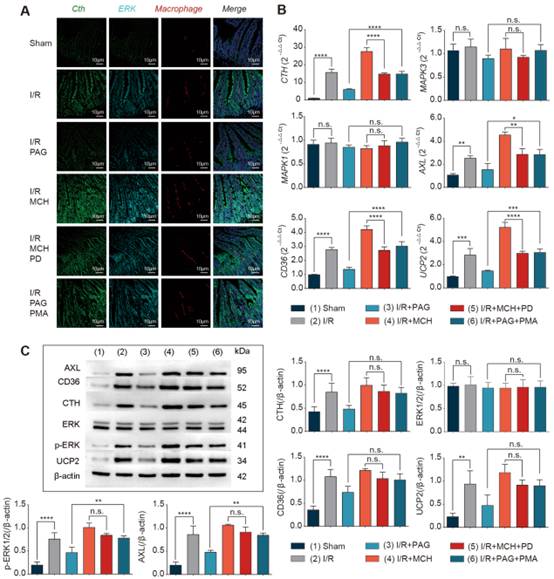
图5 Cth通过ERK1 /2依赖方式诱导I/R后巨噬细胞胞葬
在腹膜巨噬细胞(RAW 264.7)与凋亡内皮细胞的体外共培养系统中,对细胞的各种处理对细胞活力或凋亡均无影响(图6A)。然而RAW 264.7的Cth过表达组与对照组相比,在基因和蛋白水平上Axl, CD36和UCP2的表达显著增加,ERK1/2通路被激活,磷酸化水平显著增加(图6B, C)。这些结果表明,Cth介导的胞葬调节依赖于体外ERK1/2的磷酸化。
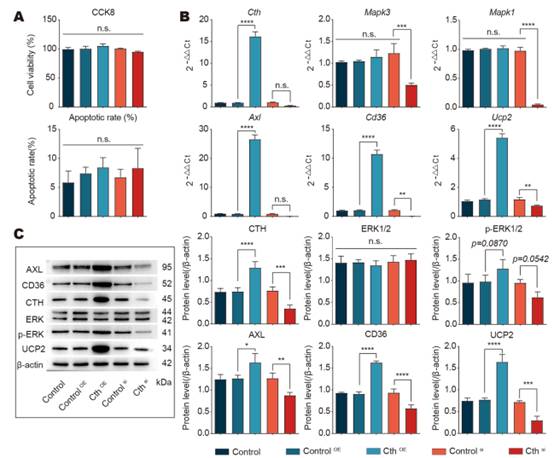
图6在巨噬细胞中,Cth沉默或过表达导致下游ERK1/2的变化和体外胞葬表型
4. Cth依赖于巨噬细胞的泡腾作用来调节修复表型
在体外共培养实验中,将细胞松弛素D加入过表达Cth的腹腔巨噬细胞和凋亡的内皮细胞中,在排除其对细胞活力的影响后(图7A),发现原本高表达的胞葬标志物(AXL, CD36, UCP2)显著降低(图7D)。高水平的IL-10和相关修复分子RvD1、RvE1和Lipoxin A4也显著降低(图7B、C)。这些结果表明,Cth介导的修复表型调节是胞葬依赖性的。
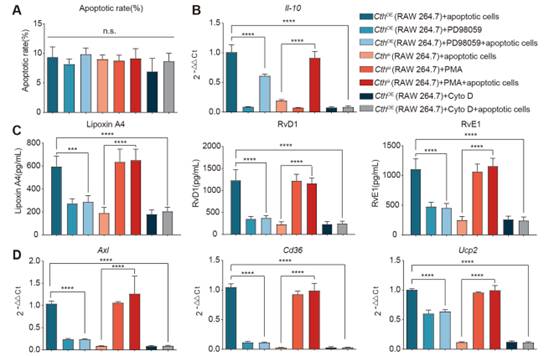
图7在体外,Cth通过激活ERK1/2通路调节胞葬和修复表型
5. Cth、ERK1/2通路激活和胞葬均经过临床验证
在证明Cth依赖于ERK1/2通路来调节胞浆化,并在体内外诱导抗炎和修复表型后,我们对临床患者进行采样,以评估我们的结果的转化相关性,并了解肠黏膜损伤和肠损伤后修复的严重程度。分别于术中、术后24、48 h取患者回肠造口处肠黏膜组织,并采集患者血液。随着患者术后恢复,抗炎因子IL-10和修复相关SPMs的表达水平逐渐升高(图8A)。此外,肠道黏膜Cth、AXL、CD36、UCP2基因及蛋白表达量随时间逐渐升高,这与抗炎修复结果相似。并且ERK1/2通路逐渐被激活,磷酸化水平逐渐升高(图8B, C)。具体来说,肠屏障损伤标志物(D-LA和IFABP)以及促炎分子IL-6和TNF-α随着时间的推移逐渐增加,这可能是患者肠道损伤和修复的结果。
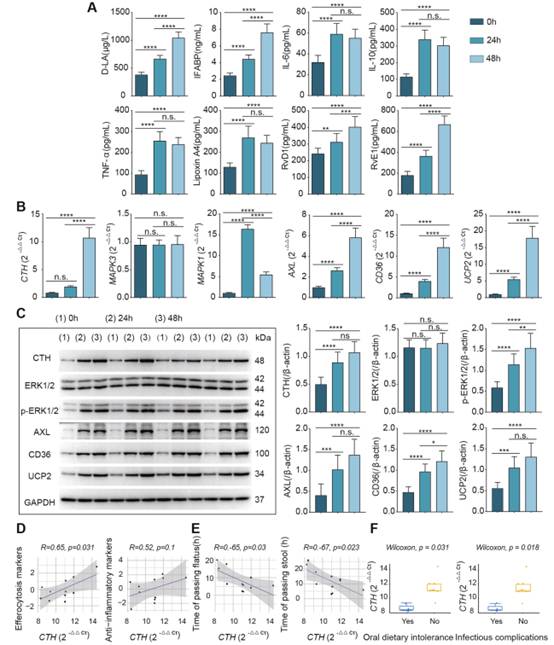
图8临床验证Cth、ERK1/2、胞葬水平变化与肠道功能恢复的相关性
6. Cth与临床患者胞葬和肠屏障修复相关
除了在临床患者中验证我们的发现,我们还检查了患者的肠道功能恢复结局,包括术后排气和大便的时间,术后48小时的口服饮食不耐受,以及术后7天的感染并发症。通过探索性观察,我们发现术后48 h Cth表达与胞葬标志物呈显著正相关(R = 0.65, P = 0.031),且Cth表达与抗炎分子呈正相关。此外,我们还发现术后48 h的Cth水平与患者恢复排便的时间(R =−0.65,P = 0.03)和排便次数(R =−0.67,P = 0.023)呈显著负相关,表明Cth高表达与患者肠道功能的恢复呈正相关。最后,我们发现在术后48 h口服饮食不耐受的患者和术后7 d有感染性并发症的患者中,Cth的表达水平较低(图8D-F)。总体而言,患者数据表明,Cth和胞葬与患者肠道炎症消退和屏障恢复密切相关。
结论:
在本研究中,Cth依赖的ERK1/2通路诱导巨噬细胞胞葬,进而调节肠黏膜损伤修复(图9)。因此,操纵胞葬促进肠黏膜损伤修复可能是一种有效的策略。此外,本研究结果为进一步阐明影响肠黏膜损伤修复的免疫机制提供了新的线索,对促进I/R患者的恢复具有重要意义。
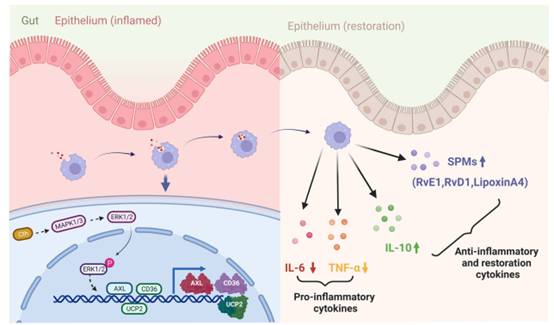
图9 Cth可以激活ERK1/2信号通路,诱导巨噬细胞胞葬,促进肠屏障修复






