单细胞RNA测序揭示了胶质瘤小鼠模型恶性进展过程中免疫抑制髓细胞多样性
近年来的研究表明,动态肿瘤微环境(TME)在高级别胶质瘤(HGGs)中的重要性。具体而言,髓系细胞在胶质瘤中介导免疫抑制。然而,髓系细胞是否在低级别胶质瘤(LGG)恶性进展中发挥作用尚不清楚。在本研究中,我们利用单细胞RNA测序在小鼠胶质瘤模型中研究了TME的细胞异质性,该模型重现了从LGG到HGG的恶性进展,为具有恶性进展风险的LGG患者提供治疗机会。该研究发表在《CELL REPORTS》,IF:9.995。
研究方法:细胞培养、组织样本收集、单细胞测序、H&E染色、随机森林建模、IPA分析、流式细胞术、免疫荧光、Opal、qPCR、生存分析
技术路线:
主要研究结果:
1. scRNA-seq识别胶质瘤进展过程中的动态免疫细胞异质性
未成熟的髓系来源细胞可能限制T细胞浸润和活化,导致胶质瘤的免疫抑制。为了研究髓系细胞群的异质性以及在LGG恶性进展过程中TME中这种多样性的功能后果,我们使用了小鼠PDGF-B-驱动的RCAS胶质瘤模型。该模型在大约3 ~ 4周开始形成LGGs,在大约6 ~ 8周进展为HGGs(图1A)。我们通过流式细胞术检测CD11b和Gr1 (Ly6c/Ly6g)(一种小鼠髓源性抑制细胞的标志物),确定了在特定时间点荷瘤动物骨髓中髓系细胞的比例。CD11b+Gr1+细胞增加与肿瘤进展相关。然而,我们的观察阐明了在携带胶质瘤的动物中,骨髓中CD11b+Gr1+细胞扩增的初始时间。
为了研究肿瘤进展过程中髓系细胞类型特异性的转录变化,我们对来自无肿瘤动物(NTs;n = 2)、LGG (n = 3)和HGG (n = 3),使用10× Genomics平台(图1B)。在包含所有样本12,668个细胞的整合数据集中,我们共识别出15个不同的细胞簇,这些细胞簇包括不同的小胶质细胞、巨噬细胞、单核细胞、T细胞、B细胞、自然杀伤细胞、中性粒细胞、血小板和未成熟红细胞群(图1C)。我们通过表达每种细胞类型的典型标记(使用点图(图1D)和特征图(图1E)可视化)来验证细胞簇的身份。
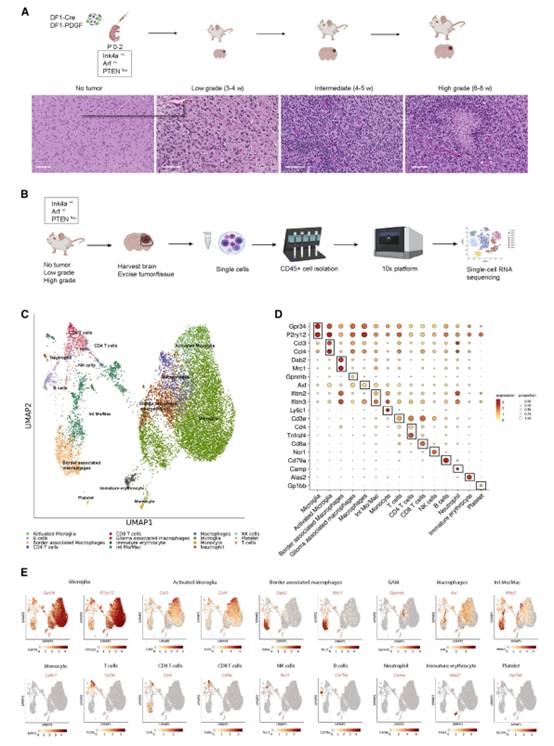
图1恶性进展过程中肿瘤浸润白细胞的单细胞RNA测序
为了确定胶质瘤进展过程中的免疫细胞景观动态,我们评估了NT、LGG和HGG的髓样和淋巴样细胞分布和异质性(图2A)。我们将巨噬细胞分为以下4种亚型:边界相关巨噬细胞(BAMs)、胶质瘤相关巨噬细胞(GAMs)、巨噬细胞和中间单核/巨噬细胞(Int Mos/Macs)。我们观察到,与LGG(4.7%)相比,HGGs中GAMs的比例(以Gpnmb和Spp1表达为标记)增加(20.8%)(图2A和2B)。我们发现,与NT组(3.5%)相比,LGGs组(9.4%)和HGGs组(8.8%)的Int Mos/ mac均增加。在HGGs中,GAMs的增加也伴随着T细胞比例的降低(图2A和2B)。这些数据提示,髓系介导的T细胞募集或扩增抑制。为了验证这些结果,我们对低级别和高级别胃癌的肿瘤浸润免疫细胞进行了流式细胞术检测。我们定量了CD45+细胞中CD45hiCD11b+细胞的百分比,通常被识别为BMDM细胞。我们检测到HGGs中BMDM细胞的百分比(11.5%±4.5%)比LGGs(2.7±1.5%)增加了4倍(图2C和2D)。我们观察到LGGs中CD45+细胞内淋巴细胞(CD11b−CD45hi)的比例(26.9%±12%)明显高于HGGs(9%±6.6%;p = 0.0197)(图2F)。我们还计算了淋巴细胞:BMDM细胞(CD45+细胞内)在LGG和HGG中的比例。LGGs中CD45+细胞的淋巴细胞:BMDM细胞比率(10.4±3.8)明显高于HGGs(0.76±0.34)。这进一步证实了在HGGs中CD45+细胞中的淋巴细胞群比例减少(图2F)。在63.5%±7%的LGGs和87.3%±5.1%的HGGs中,CD45hiCD11b+细胞也表达巨噬细胞标记物F4/80(图2C和2D)。在CD45hiCD11b+细胞中,LGG动物(5.5%±3.2%)和HGG动物(10.9%±4.3%)的CD11b+Gr1+细胞(髓源性抑制细胞)的差异无统计学意义(图2D)。此外,我们通过流式细胞术验证了患有LGG和HGG的动物大脑中存在T细胞(图2E)。我们发现LGGs中淋巴细胞群中的T细胞(CD45hiCD11b−)(78.5%±1.4%)明显高于HGGs(43.4%±11.3%)。同样,在淋巴细胞群体中,LGGs的CD8+ T细胞比例(33%±6.2%)明显高于HGGs(8.6%±10.9%)(图2F)。这些结果支持了我们的scRNA-seq数据,该数据也显示了HGGs中T细胞浸润减少。
在正常大脑中观察到的主要免疫细胞类型是小胶质细胞,81.2%的免疫细胞聚集为小胶质细胞。相比之下,LGG和HGG中分别只有41%和48.3%的免疫细胞是小胶质细胞(图2A、2B)。在正常大脑中无法检测到激活的小胶质细胞群;然而,它们分别占LGGs和HGGs的9%和8.5%(图2A和2B)。
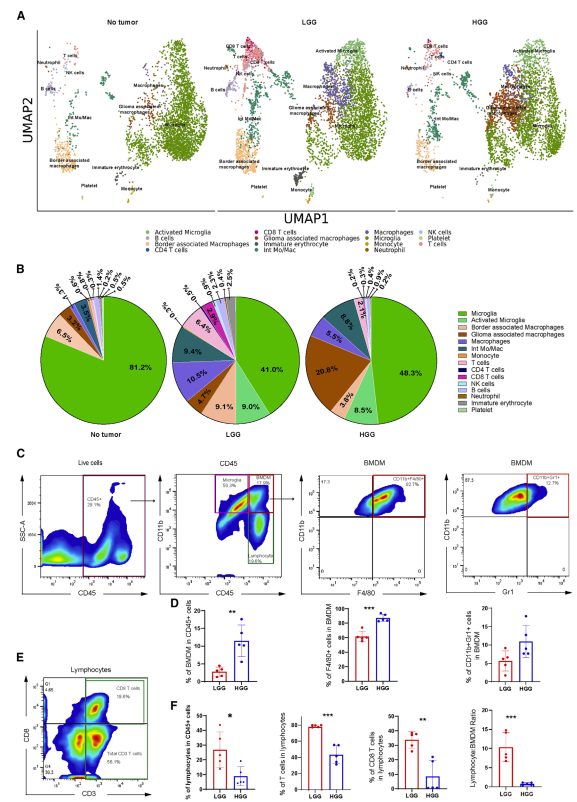
图2单细胞RNA测序显示胶质瘤进展过程中免疫细胞浸润的差异
2. 恶性进展过程中巨噬细胞采用免疫抑制转录信号
我们的scRNA-seq分析确定了4个不同的巨噬细胞簇。BAM和Int Mos/Macs表达BMDM细胞的独特特征(Tgfbi、Cd14和Itga4)(图3A),相比之下,GAM和巨噬细胞簇表达了微胶质来源的巨噬细胞的特征(Trem2、Cd9、Cd81、Ctsb、Ctsd和Ctsd),并表现出BMDM相关基因的显著下调特征(图3A)。
BAMs主要参与CNS边缘区域的清除功能,而已知巨噬细胞的其他亚群也存在于TME中。因此,我们的进一步分析将主要关注非BAMs巨噬细胞亚群,它们在脑TME的背景下更相关。对GAMs、巨噬细胞和Int Mos/Macs的联合分析表明,HGGs中免疫抑制因子(Mif、Lgals3、Pkm、Axl、Id2和Ccl4)水平较高,而LGGs中募集因子(Ccl5、Cxcl9和Cxcl10)和M1基因(Stat1、HLAII (H2-Aa)和IL-1β)显著表达(图3B)。
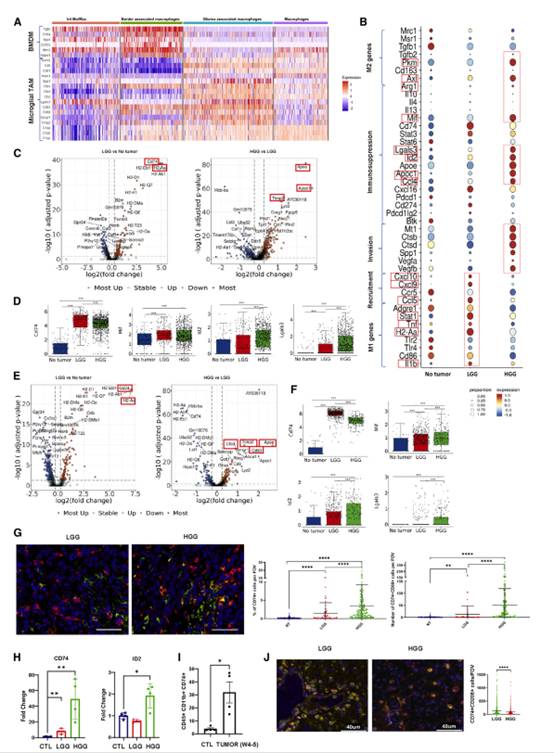
图3胶质瘤进展过程中巨噬细胞簇的异质性
3. 恶性进展过程中的异质性和不同的巨噬细胞簇功能
与NT相比,GAM在LGG中Cd74、MhcII (H2-Aa)基因和Stat1表达水平升高,在HGG中ApoE、ApoC1和Timp2表达水平升高(图3C)。与NT相比,LGG中巨噬细胞Cd74和MHCII (H2-Aa)基因表达水平升高(图3E)。与LGG相比,在HGGs中ApoE、Timp2、Cd63和Ctsd上调(图3E)。与GAMs相似,LGG和HGG中巨噬细胞簇的Cd74和Mif表达水平也明显高于NT (p < 0.005)(图3F)。附图4至附图9显示:IPA分析发现,与NT相比,LGG的巨噬细胞簇中TNF、IFNG、TREM2和STAT1被激活。与LGG相比,HGG下调IFNG和STAT1,上调CSF1、PPARG和IL-10RA。在Int Mo/Mac聚类中,ApoE、Apoc1、Ctsd、Spp1和Timp2是HGG中差异表达前20位的基因。相比之下,趋化因子Ccl5、Ccl8和Cxcl9是该类群中LGG中差异表达最多的基因。IPA分析发现,与NT相比,LGG中IFNG和STAT1相关通路上调。另一方面,与LGG相比,HGG中IL-10RA、PTGER4和PPARG被激活,而IFNG、STAT1和IFNG下调。我们在HGG中GAM和Int Mo/Mac聚类中发现了前20个上调基因中的Spp1。同样,Gpnmb是HGG中GAMs中上调最多的基因之一。随后,我们发现GAMs中同时表达M1和M2标记物。此外,在GAMs、巨噬细胞和Int Mos/ mac中的转录谱显示出较高的预测价值,并且在肿瘤进展期间显示出免疫抑制进化。我们在GAMs中发现了Apoc1和ApoE,在巨噬细胞中发现了Cd74和MHCII,在Int Mo/Mac人群中发现了MHCII、Cd74、M1极化标签Stat和趋化因子Ccl5。
4. CD74-MIF轴作为肿瘤浸润巨噬细胞的靶点
鉴于所有3个巨噬细胞簇似乎都表现出免疫抑制特性,我们确定了LGG期的常见标记物,值得进一步的功能研究。与NT相比,LGG和HGG样本中的GAMs和巨噬细胞中Cd74及其结合伙伴Mif的表达均显著上调(图3D和3F)。同样,与LGG相比,GAMs和巨噬细胞中促血管生成驱动因子Id2和免疫抑制分子Lgals3在HGG中显著上调(图3D和3F)。
为了评估CD74在荷瘤动物中的原位表达,我们对NT、LGG和HGG的组织切片进行了CD74和CD68的联合染色,并进行了全肿瘤组织成像,共分析了367个FOVs。我们发现,与NT(0.07%±0.2%)相比,HGG(3.4%±5.8%)和LGG(1.4%±2.9%)的CD74阳性细胞比例显著增加(图3G)。然后,我们用qPCR方法验证了从TME分离的免疫细胞中Cd74和Id2的表达。我们发现与LGG相比,HGG中Cd74和Id2的表达明显增加(图3H)。流式细胞术染色也显示,与LGG(3.9%±1.7%)相比,HGGs在CD45hiCD11b+细胞中过表达CD74(31.9%±16.2%)(图3I)。我们在LGG和HGG患者中均发现CD74+CD206+细胞。然而,LGG患者的CD74+CD206+细胞数量显著增加(图3J),证实了浸润性人脑胶质瘤巨噬细胞中CD74的表达。
5. HGG TME中T细胞运输和激活的限制
我们观察到,与HGG样本相比,LGG中的T细胞浸润增加(图2B和S2A)。CD3+ T细胞占LGGs免疫浸润的6.4%,而在每个样本中,正常脑和HGGs的CD3+ T细胞比例分别不到0.08%和2.1%(图2B和S2A)。为此,差异表达分析发现,在LGG的浸润T细胞中,趋化因子(如Ccl8、Cxcr6、Ifn-γ和Ccl5)上调(图S11)。相比之下,HGG中的免疫浸润T细胞表达更多与脂质代谢相关的分子,如ApoE、Apoc1、Hmox和Fabp5(图4A)。
接下来,我们研究了低级别GGS和高级别GGS之间总CD3+ T细胞的基因表达差异。LGGs中的总T细胞还表达显著增加的T细胞活化标记Ifn-γ水平(图4B和4H)。与HGG和NT相比,T细胞共刺激分子Cd28和Th1转录因子Tbx21在LGG中也上调,但未达到统计学显著性(图4B和4H)。相比之下,HGG中的总T细胞表达的T细胞活化标志物(Cd69和Ifn-γ)和效应记忆标志物(Cd44)显著少于LGG(图4B和4H)。
CD4+ T细胞在LGG中表达的T细胞活化标志物Cd69明显高于HGG (p < 0.05)。相比之下,CD4+ T细胞恶性进展为HGG后,T细胞抑制标志物Pdcd1、Lgals3、Lag3、Havcr2 (Tim3)、Th2转录因子(Gata3)和调节性T细胞(Treg)标志物(Foxp3)均出现增加(图4C);然而,可能由于细胞计数非常低,没有达到统计学意义。在CD8+ T细胞中,我们观察到HGG中Cd28和Cd69的表达明显低于LGG(图4D)。总T细胞的IPA分析也发现了Th1极化和细胞毒性的抑制(图4E)。IFNG和IRF3是HGG和LGG中下调最多的预测通路,而cite 2、IL-10RA和STAT6是HGG和LGG中上调最多的预测通路(图4F)。接下来,我们使用X细胞对TCGA数据集进行反褶积分析,研究了LGG (n = 33)和HGG (n = 58)患者之间CD8 T细胞计数和自然杀伤细胞(NK)计数的差异(图4G)。我们发现LGG患者的CD8+ T细胞和NK细胞富集评分显著高于HGG患者,这与我们从RCAS-Ntva模型中得到的结果一致。
总之,我们在RCAS-Ntva模型中的结果以及在人类组织/数据集中的验证支持,在肿瘤进展到HGG时,TME内的免疫抑制巨噬细胞簇可能限制了T细胞的功能和浸润(图4H)。
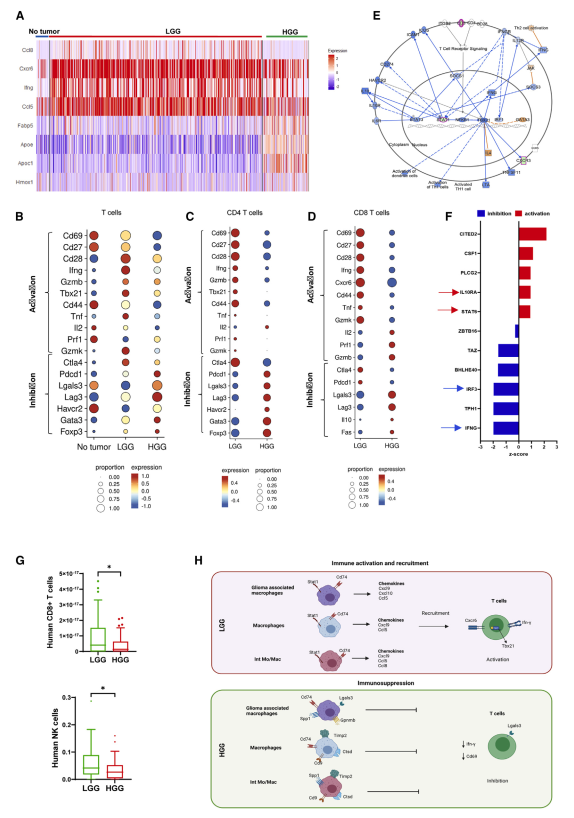
图4携带HGG的动物T细胞活化受损
结论:
我们的数据表明,巨噬细胞在低级别肿瘤阶段表现出免疫激活的特征,并在肿瘤转化为高级别时获得免疫抑制特征。在LGG和HGG之间的动态阶段,针对巨噬细胞的功能研究可能消除免疫抑制机制,并为阻止恶性进展提供治疗机会。
参考文献
Rajendran S, Hu Y, Canella A, et al. Single-cell RNA sequencing reveals immunosuppressive myeloid cell diversity during malignant progression in a murine model of glioma. Cell Rep. 2023; 42(3):112197. doi: 10.1016/j.celrep.2023.112197.






