想不想轻松减肥?一文读懂GPR119的减肥密码
胃肠道通过分泌激素和通过激活营养传感器产生信号来影响生理活动和行为。GPR119,一种脂质传感器,它间接参与肠内分泌细胞的肠促胰岛素分泌,如胰高血糖素样肽-1、葡萄糖依赖性胰岛素肽等,但它可直接刺激胰腺β细胞分泌胰岛素。鉴于GPR119有调控肥胖和糖尿病的代谢稳态的潜力,所以它作为治疗靶点吸引了很多学者的研究兴趣。然而,此前的研究表明在基础或高脂饮食条件下,敲除GPR119不影响小鼠的葡萄糖稳态和食欲。因此,本研究旨在探究GPR119信号系统在小鼠能量代谢和饮食行为中的作用。本研究结果表明,肠道微生物产生的油酸来源的油酰乙醇胺(OEA)激活胃肠道GPR119与能量短缺条件下的饱腹感控制和能量稳态有关。本研究于2022年11月发表在《Molecular Metabolism》IF:8.568期刊上。
技术路线:

主要实验结果:
1、Gpr119 KO小鼠体重减轻,能量消耗增加
采用CRISPR-Cas9基因组编辑系统生成Gpr119 KO小鼠,评估Gpr119的生理作用。在FF条件下维持的Gpr119 KO小鼠比同窝的WT小鼠表现出更低的体重(图1A)。然而,在FF条件下,WT和Gpr119 KO小鼠的生长、食物摄入量(图1C)和血糖水平(图1E)没有观察到差异。此外,在FF条件下,血浆三酰甘油(TG;图1F),非酯化脂肪酸(NEFA;图1G)和总胆固醇(图1H)水平在WT和Gpr119 KO小鼠间也无差异。因此,作者进一步评估这些小鼠的能量代谢和运动能力。
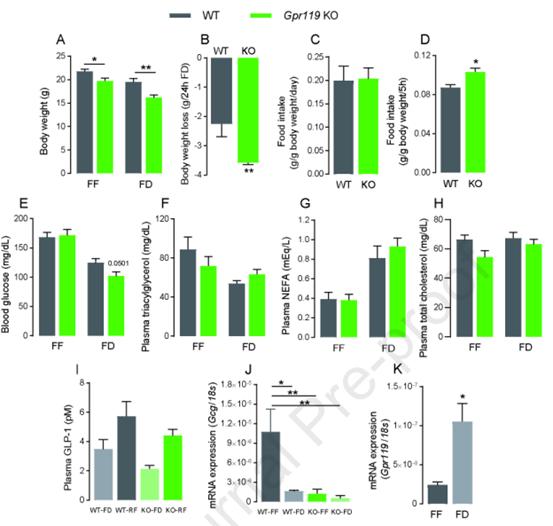
图1Gpr119 KO小鼠在自由喂养(FF)和食物剥夺(FD)条件下的体重、摄食量、血糖、血脂和GLP-1的变化
Gpr119 KO小鼠的能量消耗(图2C,暗周期)而非呼吸商(图2A和2B)和运动活性(图2E和2F)高于同窝的WT小鼠。因此,Gpr119 KO小鼠即使在摄入相同量的食物时,消耗的能量也高于WT小鼠。此外,利用体重和能量消耗的原始数据评估MMPC能量消耗分析,以检验增加的能量消耗是否主要影响体重。考虑体重作为协变量的ANCOVA基因型效应无显著差异(图2G)。与WT小鼠相比,Gpr119 KO小鼠调整后的能量消耗显著增加(图2H),这解释了Gpr119 KO小鼠与WT小鼠相比相对瘦弱的表型。
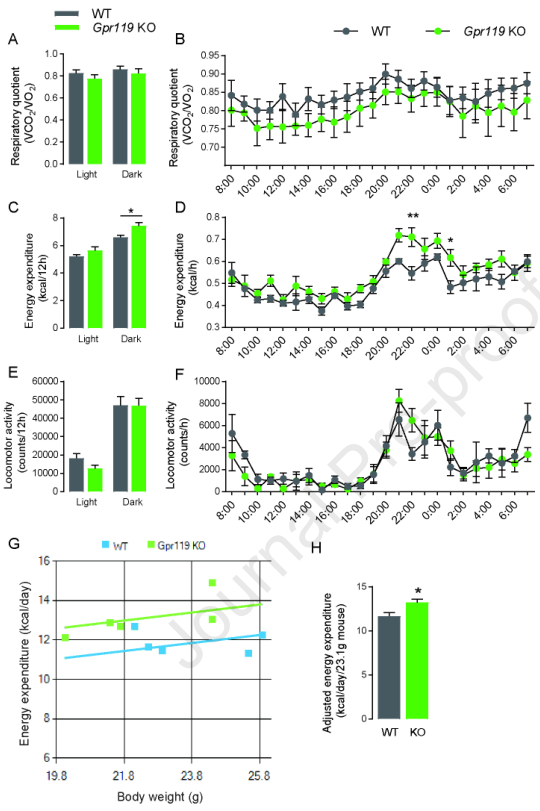
图2WT和Gpr119 KO小鼠在FF条件下的代谢分析
2、Gpr119 KO小鼠在食物剥夺后的RF中表现出贪食反应
为研究GPR119在代谢应激中的作用,将7周龄GPR119 KO小鼠和WT同窝小鼠进行24 h的食物剥夺。在FD条件下,Gpr119 KO小鼠的体重低于WT小鼠(图1A)。Gpr119 KO小鼠的体重下降明显大于WT小鼠(图1B)。有趣的是,Gpr119 KO小鼠在断食24小时后5小时的食物消耗量高于WT小鼠(图1D)。此外,Gpr119 KO小鼠的血糖水平往往低于WT小鼠(图1E)。Gpr119 KO和WT小鼠在不进食24小时后,血浆TG(图1F)、NEFA(图1G)和总胆固醇(图1H)水平无差异。这些结果表明,Gpr119 KO小鼠在食物剥夺应激下表现出贪食反应。
3、Gpr119 KO小鼠在食物剥夺后RF中的餐后间隔时间较短
根据图1中关于FD型Gpr119 KO小鼠的暴食反应的结果,使用喂养测量系统观察WT和Gpr119 KO小鼠在禁食24小时后RF 3小时内的进食模式(图3)。与图1D所示的人工摄食量测量结果(RF-5 h)一致,与WT小鼠相比,使用该系统测量的Gpr119 KO小鼠摄食量显著增加(图3A)。此外,Gpr119 KO小鼠的进餐频率(图3C)明显高于WT小鼠,而Gpr119 KO小鼠和WT小鼠之间的用餐潜伏期(图3B)和用餐总时长(图3D)没有差异。Gpr119 KO和WT小鼠在第一餐参数上没有差异,如餐量(图3E)、餐时间(图3F)、餐后间隔时间(图3G)和饱腹率(图3H)。有趣的是,与WT小鼠相比,Gpr119 KO小鼠的平均餐后间隔时间(图3K)和平均饱腹率(图3L)显著降低,而非平均餐食量(图3I)和平均持续时间(图3J)。这些结果表明,Gpr119的缺失导致RF在食物剥夺后进食饱腹感的降低,而且其影响从进食开始就延迟的。进一步测量在FD和RF条件下WT和Gpr119 KO小鼠的血浆GLP-1水平(图1I)。WT和Gpr119 KO小鼠在RF作用下GLP-1水平有升高趋势,但不同喂养条件之间没有统计学差异。表明Gpr119的缺失不影响血浆GLP-1水平。此外,验证了食物剥夺对盲肠Gcg和Gpr119表达的影响。在WT小鼠的盲肠中,食物剥夺导致Gpr119表达增加(图1K),而Gcg表达减少(图1J)。在Gpr119 KO小鼠中,Gcg的表达不受喂养条件的影响;但与WT-FF相比,其表达水平相对较低(图1J)。
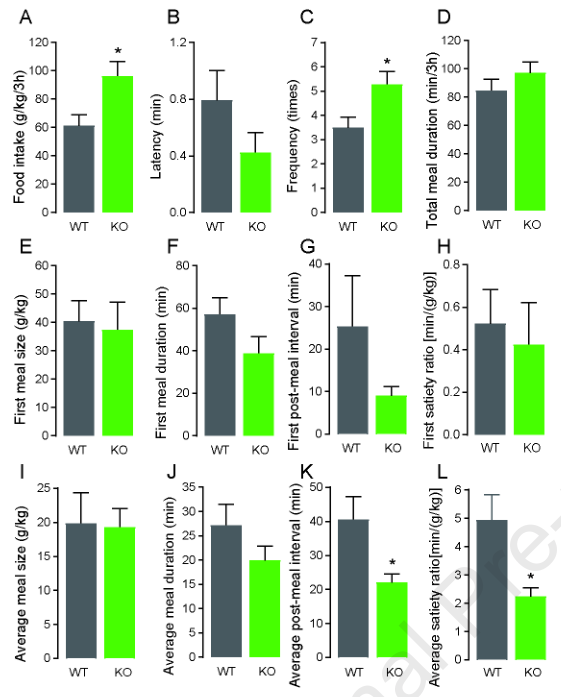
图3在再喂养条件下Gpr119 KO小鼠表现出增加的食物摄入量和减少的饱腹感
4、Gpr119不参与全身OEA引起的饱腹感
为研究GPR119是否参与系统性OEA处理诱导的饱腹感,在FF或FD条件下腹腔注射OEA后测定GPR119 KO小鼠的食物摄入量。在FF条件下,作为OEA处理的结果, WT和Gpr119 KO小鼠在暗周期的食物摄入量都显著减少(图4A),与对照小鼠相比。与图1D一致,Gpr119 KO小鼠在食物剥夺后RF 5小时内的摄食量高于对照WT小鼠,然而,OEA处理导致WT和Gpr119 KO小鼠的食物摄入量显著减少(图4B)。总之,这些结果表明,在FF或FD条件下,全身OEA诱导饱腹感不需要GPR119的激活。
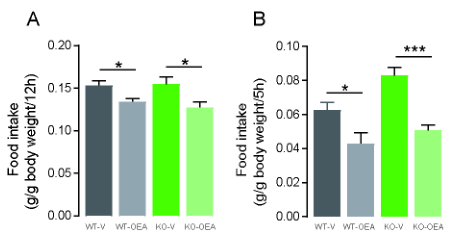
图4腹腔注射OEA可以减少WT和Gpr119 KO小鼠的食物摄入量
5、饲喂可调动肠道内容物中的OEA
在这里,作者证实了Gpr119在胃肠道下部,包括回肠、盲肠和结肠中有高表达(图5A)。作者定量计算Gpr119高表达的小鼠盲肠内容物中的OEA。结果显示,在FF条件下,WT和Gpr119 KO小鼠盲肠内容物中OEA含量分别为2.4±0.4 nmol/g和2.3±0.0 nmol/g,且WT和Gpr119 KO小鼠在禁食24 h后,盲肠内容物中OEA含量下降(图5B)。在FF条件下,WT和Gpr119 KO小鼠盲肠内容物2-OG水平相似,食物剥夺不影响WT和Gpr119 KO小鼠盲肠2-OG水平(图5C)。然后,用表达DOX诱导的人GPR119的HEK293细胞l检测OEA和2-OG的GPR119配体活性。合成的GPR119激动剂,Ar231453,使细胞cAMP水平比对照提高了7倍(图5D)。本研究饲粮中OEA的浓度为1.3±0.2 nmol/g,远远高于小鼠肠道组织和血浆中的OEA水平。因此,作者预计RF会改变OEA的腔内水平,因为饮食中含有OEA。分析显示,在喂食1h或2 h的小鼠中,盲肠和结肠的腔内OEA水平高于十二指肠、空肠和回肠(图5E)。然而,在食物被剥夺重新喂食2小时后小鼠盲肠OEA水平不如自由喂食的小鼠高(图5B)。此外,胃腔内OEA水平略高于近端肠,提示近端肠内OEA被稀释和吸收。这些结果表明,喂养导致大肠内OEA水平升高,这可能是由于饲粮OEA积累或肠道菌群产生OEA所致。
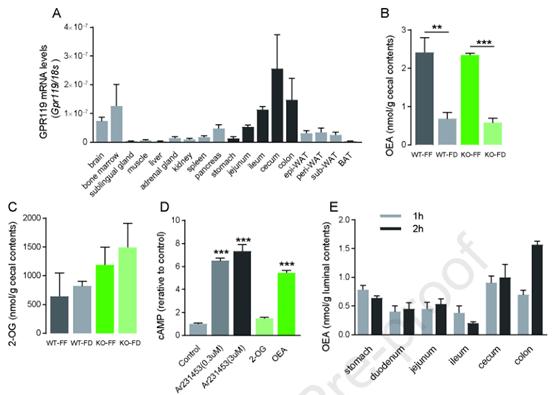
图5在喂养OEA的远端肠腔内容物中Gpr119高表达
6、大肠OEA输注改变饮食模式
接下来,研究输注到大肠的OEA是否改变小鼠的饮食模式,因为OEA在GPR119高表达的小鼠大肠中增加(图5)。在24 h的食物剥夺后,通过回肠末端插入导管注入OEA,并监测进食行为。在OEA组中,第一次餐后间隔时间明显长于对照组(图6D)。相比之下,两组间在潜伏期(图6A)、第一顿饭的大小(图6B)或第一顿饭的持续时间(图6C)上没有差异,导致注入OEA的小鼠第一顿饭的饱腹率增加(图6E)。此外,小鼠2小时内的饮食模式结果表明,总摄食量(图6F)和进餐频率(图6GB)在注入OEA的小鼠中降低。这些结果共同表明,饱腹感可由大肠的OEA感应引起.

图6大肠输注OEA可诱导小鼠饱食感
7、肠道菌群来源的OA产生的OEA调节进食行为
作者假设大肠内OEA水平升高是因为微生物合成了OA,虽然也有可能是膳食OEA在大肠内内容物中积累。为验证这一假设,首先量化注射抗生素一周的小鼠盲肠内容物中的OEA水平。与未使用抗生素的小鼠相比,经抗生素处理的小鼠的盲肠重量急剧增加,然而,各组之间的粪便中的水分含量没有差异。因此,分析了使用抗生素的小鼠盲肠中OEA和OA(18:1 FFA)的数量。抗生素治疗后,盲肠OEA水平明显下降(图7B),尽管各组之间的18:1水平没有明显差异(图7A)。这些结果表明,肠道微生物群会从到达大肠的OA中合成OEA。然而,在FF条件下的24小时内(图7C),或在食物剥夺24小时后的RF 3小时内(图7D),抗生素处理并不影响食物摄入。
接下来,研究盲肠中的肠道微生物群是否以OA为底物生物合成OEA。在小鼠被剥夺食物24小时后,通过回肠末端的植入式导管将OA直接注入大肠,并在注入OA后2小时收集的盲肠内容物中测定OEA水平。结果显示,输注OA后,粪便中的OEA水平增加(图7E),表明大肠中的微生物群从OA中生物合成OEA。因此,接下来调查从OA中生物合成OEA是否会诱发与输注OEA后观察到的类似的膳食模式的变化。结果发现灌注OA并不影响潜伏期(图7F)、首餐大小(图7H)、首餐持续时间(图7I)、首餐后间隔(图7J)或首餐饱腹率(图7K)。然后,分析第二餐的进食模式,即在OA输液后约90-120分钟内发生的。观察到OA输入明显增加第二餐后的间隔时间(图7N)。相比之下,第二餐的大小(图7L)和第二餐的持续时间(图7M)没有变化,导致第二饱腹率增加(图7O)和用餐频率的减少(图7G)。综上所述,这些结果表明,微生物群以OA为底物产生OEA,随后OEA诱导膳食饱腹感。
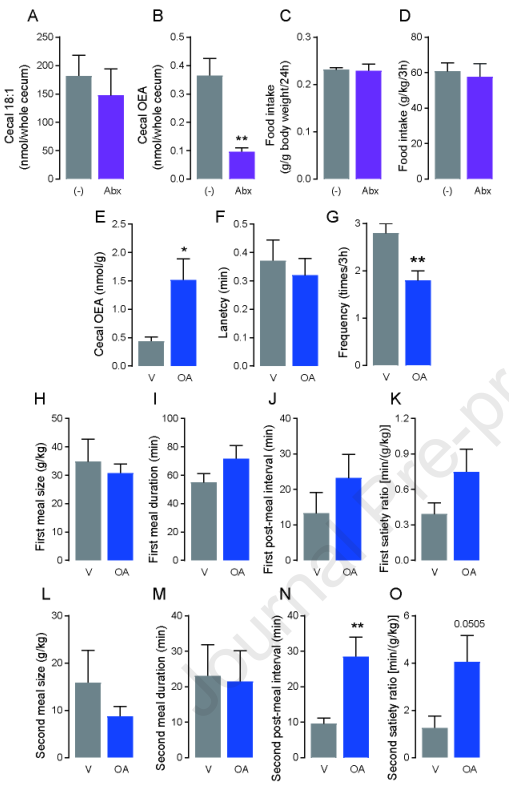
图7由菌群产生的OEA可能改变摄食行为
总之,本研究表明,大肠中的GPR119通过感知肠道微生物群产生的OEA诱导饱腹感。GPR119已经成为肥胖症和糖尿病的药物靶点,因为它通过直接作用于胰岛β细胞或通过肠道内分泌细胞分泌的增殖素来刺激胰岛素的分泌。因此,旨在加强GPR119激活的策略,如调节微生物群组成以增加OEA的产生或抑制OEA的降解,可能有助于在肥胖和其他饮食障碍中诱发餐食饱腹感。
参考文献:
Igarashi Miki., Hayakawa Tetsuhiko., Tanabe Haruka., Watanabe Keita., Nishida Akari., Kimura Ikuo.(2022). Intestinal GPR119 activation by microbiota-derived metabolites impacts feeding behavior and energy metabolism. Mol Metab, undefined(undefined), 101649. doi:10.1016/j.molmet.2022.101649






