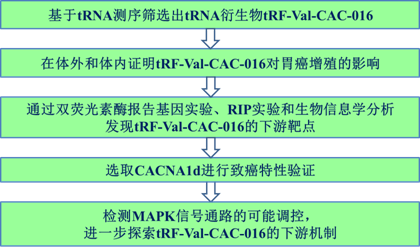
TRF-Val-CAC-016通过调控CACNA1d介导的MAPK信号通路抑制胃癌细胞增殖
超过70%的胃癌(GC)新发病例发生在发展中国家,约50%发生在东亚。中国胃癌发病和死亡人数分别占全球统计数据的42.6%和45.0%,在183个国家中发病率排名第5,死亡率排名第6。因此探索GC的治疗方法至关重要。作为一种新型的非编码RNA,tRNA衍生物在GC中起着重要作用。然而tRNA衍生物参与GC的潜在机制很少被说明。该研究发表于《Cell Communication and Signaling》,IF:7.525。
研究路线:
主要研究结果:
1.胃癌组织tRFs和tiRNAs测序谱
研究者进行了tsRNAs测序,以区分差异表达的tsRNAs(DETs)和无差异表达的tsRNAs(NDETs),最终根据谱选择tRF-Val-CAC-016。随后,研究者应用层次聚类对DETs进行分类,共得到69个上调和42个下调的DETs的层次聚类热图(图1a)。研究者使用火山图来展示差异最大的DETs,根据图谱的foldchange(FC)(log2FC≥3或log2FC≤-3,p<0.05),在图1b中显示了5个下调和6个上调的tsRNAs。显然,考虑到可行性和统计学意义,研究者选择tRF-Val-CAC-016进行进一步的研究。同时,研究者使用R gplot包完成了相关系数的热图来阐述GC样品的相似性(图1c)。
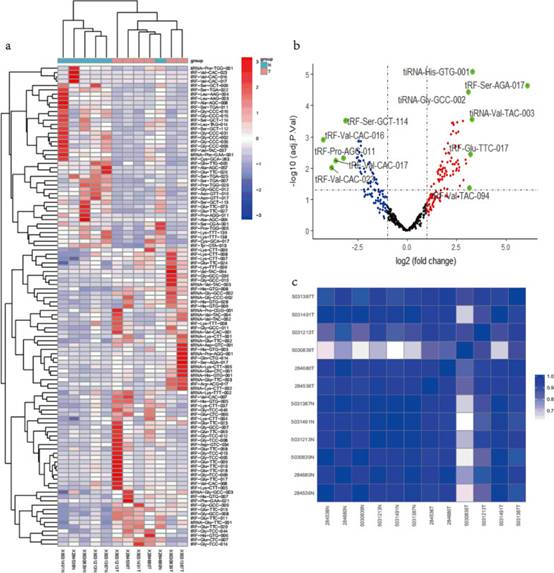
图1 tRFs和tiRNA测序谱的GC组织
2.tRF-Val-CAC-016在胃癌组织中低表达
研究者应用凝胶电泳验证tRF-Val-CAC-016的PCR产物,证明PCR引物的可行性,并验证tsRNA测序的真实性(图2a)。如图2b所示,tRF-Val-CAC-016的长度在50-100 bp之间,研究者进行了Sanger测序验证结果。荧光原位杂交检测表明tRF-Val-CAC-016定位于细胞核和细胞质,但主要位于细胞质(图2c)。随后在胃癌细胞系中检测tRF-Val-CAC-016的表达水平,最终选择NCI-N87和HGC-27(图2d)。最后,为了确认tRF-Val-CAC-016模拟物的效率,研究者进行了转染,结果与研究者的预期一致(图2e)。类似地,在40对胃癌组织中也证实了低表达水平(图2f)。同时,在临床病理特征方面,tRF-Val-CAC-016的表达与肿瘤大小和组织学类型显著相关。进一步通过对胃切除术后患者的随访,计算tRF-Val-CAC-016的预后结局,但结果并不显著(图2g)。
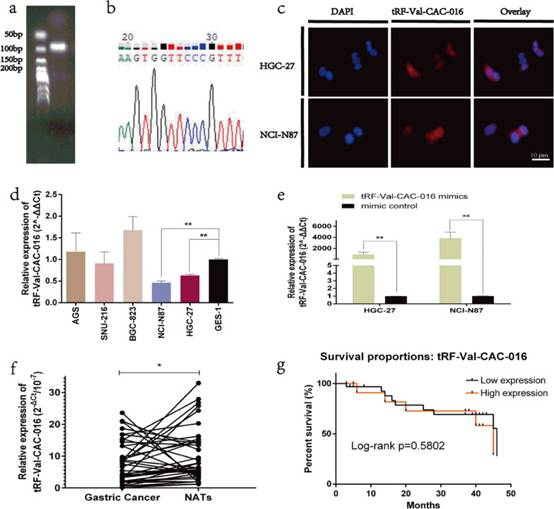
图2 tRF-Val-CAC-016在GC组织中的表达显著降低
3.tRF-Val-CAC-016抑制胃癌细胞增殖
如图3a-b所示,tRF-Val-CAC-016在CCK-8实验中显著抑制胃癌细胞的增殖。乙炔基-2'-脱氧尿嘧啶核苷(EdU)实验表明,tRF-Val-CAC-016可以抑制GC的细胞复制活性,而tRF-Val-CAC-016抑制剂增强了GC的复制活性(图3c-d)。同时,研究者发现tRF-Val-CAC-016可以调节胃癌细胞周期的检查点。如图3e-g所示,奥沙利铂在GC中主要处理G1期。而tRF-Val-CAC-016对NCI-N87和HGC-27细胞的S期均有显著的调节作用。集落形成实验中,tRF-Val-CAC-016对胃癌细胞活力的抑制作用略弱于奥沙利铂。tRF-Val-CAC-016抑制剂增强了GC细胞中的集落形成能力(图3h-i)。这些现象在免疫印迹实验中得到了严格的解释,如图3j-k所示,tRF-Val-CAC-016模拟物明显降低了CyclinD1, CyclinB, c-myc的蛋白表达。tRF-Val-CAC-016抑制剂可上调CyclinD1、CyclinB、c-myc蛋白表达。与对照组相比,奥沙利铂降低了CyclinD1、c-myc的表达。
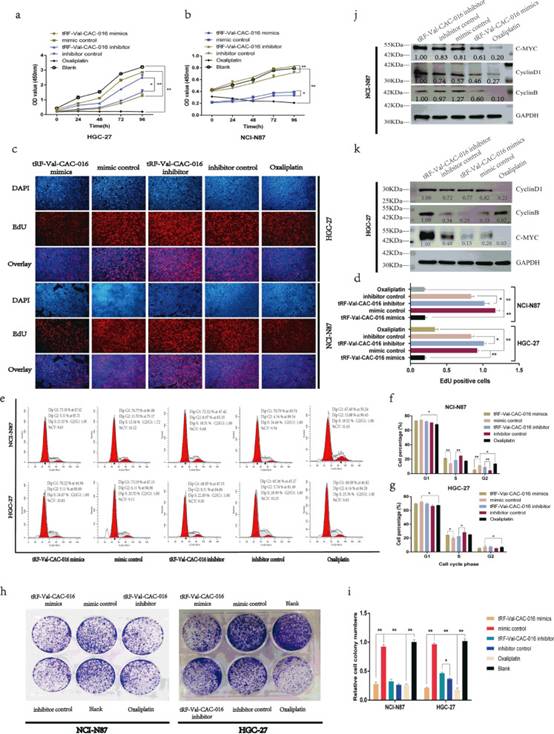
图3tRF-Val-CAC-016抑制了GC的增殖
4.生物信息学分析
应用miRanda和TargetScan数据库预测tsRNAs的靶基因。基于mRNA和tsRNAs表达谱数据的匹配,揭示了一些具有显著性的生物学位点-序列特征和相对保守的评分模型。结构评分(structure score)、能量(energy)、context_plus_score等参数用于优化tsRNAs靶基因的选择。然后对下调或上调的tsRNAs靶基因进行GO和KEGG富集分析。下调组GO分析如图4a-c所示,研究者发现MAPK信号通路显著富集(图4d)。在上调组中,GO分析如图4e-g所示,研究者发现Wnt信号通路相当突出(图4h)。然后,研究者将本研究中的生物信息学数据与GEO和TCGA数据库进行了比较,结果表明增殖相关通路经常被富集,并且揭示了钙信号通路,这与CACNA1d的功能一致。
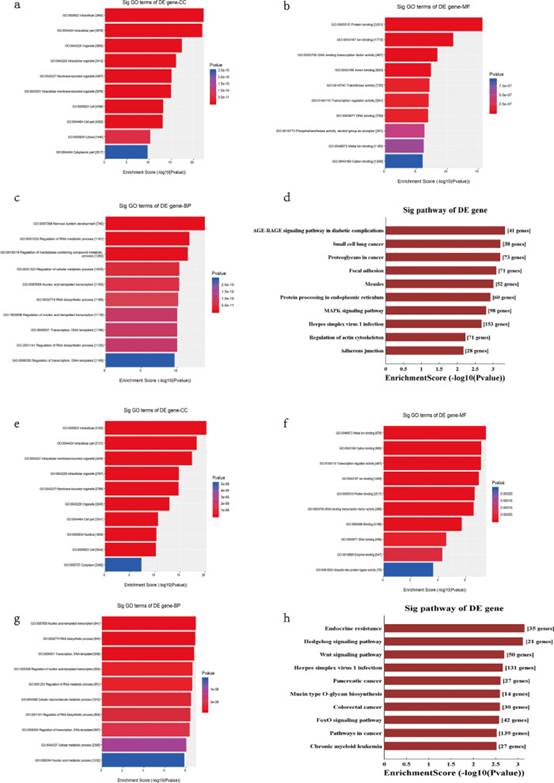
图4测序谱的GO和KEGG富集分析
5.验证了CACNA1d在胃癌组织中表达上调,并选择作为tRF-Val-CAC-016的潜在靶点
研究者引入TCGA和GEO数据库预测可能的靶点进行进一步研究。如图5a所示,维恩图取MAPK组与tRF-Val-CAC-016预测靶基因的重叠。然后研究者分析了GEO数据库(GSE65801)和TCGA-STAD数据库,发现GSE65801中的CACNA1d、PLA2G4A和TNF(图5b),TCGA-STAD中的CACNA1d和PLA2G4A显著上调(图5c)。研究者进一步应用Kaplan-Meier plotter网站,发现CACNA1d, TNF, TGFBR1, PDGFC, GADD45B与胃癌预后显著且反相关(图5d-l)。上述分析提示了CACNA1d作为tRF-Val-CAC-016可能的下游靶点的重要作用。随后,研究者获得了90对GC标本的组织微阵列(tissue microarray, TMA),包括详细的随访数据(图5m)。IHC结果见图5n。通过对随访数据的分析,研究者发现CACNA1d的表达与胃癌的预后无关(p=0.1805,图5o)。GC和NATs的代表性IHC图像示于图5p中。CACNA1d在胃癌组织中的蛋白水平显著上调(图5q)。综合分析结果取交集,选择CACNA1d作为靶基因。为了验证CACNA1d的表达和功能,研究者购买了针对CACNA1d的siRNA,并选择si-CACNA1d-1作为相比si-CACNA1d-2和si-CACNA1d-3抑制效果更好的siRNA(图5r)。相反,pcDNA-CACNA1d可显著增强CACNA1d的表达(图5s)。此外,tRF-Val-CAC-016抑制剂能够在一定程度上逆转si-CACNA1d对GC细胞的抑制功能(图5t)。类似地,pcDNA-CACNA1d对GC的作用被tRF-Val-CAC-016 mimics部分缓解(图5u)。
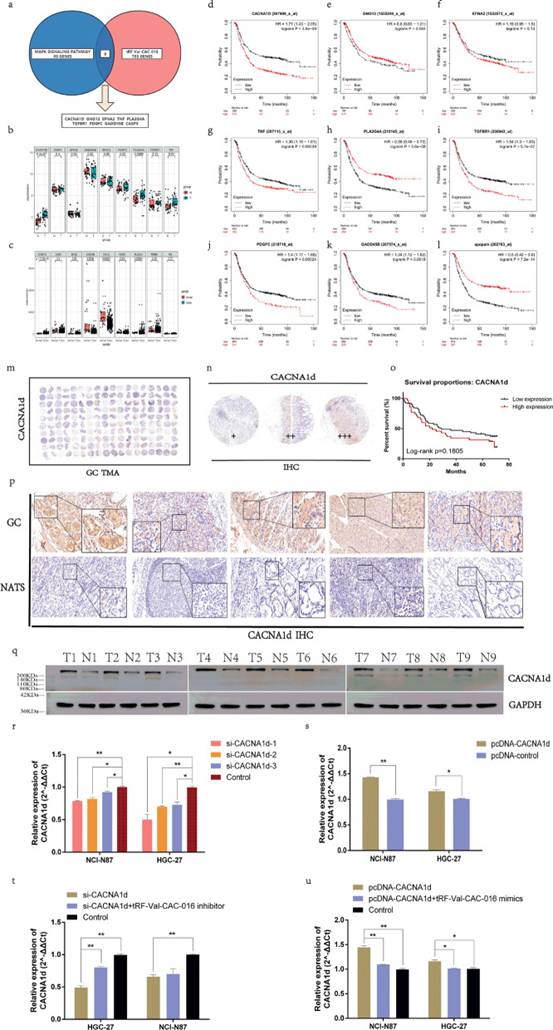
图5验证CACNA1d在GC组织中被上调,并选为tRF-Val-CAC-016的潜在靶标
6.Argonaute-2可免疫共沉淀tRF-Val-CAC-016, tRF-Val-CAC-016可通过靶向CACNA1d调节胃癌细胞增殖
测序图谱阐明了tRF-Val-CAC-016与CACNA1d mRNA之间可能的结合关系(图6a), tRF-Val-CAC-016模拟物可以显著降低RT-PCR中CACNA1d的表达(图6b)。tRF-Val-CAC-016模拟物可降低CACNA1d的蛋白水平,tRF-Val-CAC-016抑制剂可促进CACNA1d的蛋白水平(图6c)。随后,研究者发现WT-CACNA1d -3 ' UTR + tRF-Val-CAC-016 mimics组在双荧光素酶报告实验中与其他组相比,可以显著降低荧光素酶比率(图6d)。然后,研究者引入RIP(RNA结合蛋白免疫沉淀)测定,发现与IgG组相比,tRF-Val-CAC-016被Argonaute-2显著免疫沉淀(图6e)。凝胶电泳进一步验证了RIP检测的PCR产物(图6f)。此外,免疫印迹证实了清洗磁珠过程的完整性(图6g)。
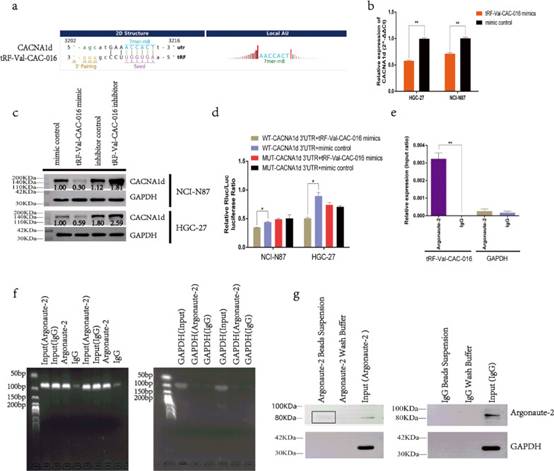
图6tRF-Val-CAC-016被Argonaute-2免疫沉淀,可通过靶向CACNA1d调节GC的增殖
7.CACNA1d可促进胃癌细胞的增殖,并可被tRF-Val-CAC-016调控
挽救实验进一步阐明了tRF-Val-CAC-016和CACNA1d之间的联系。在CCK-8实验中,si-CACNA1d可以显著降低胃癌细胞的增殖,tRF-Val-CAC-016抑制剂可以部分恢复胃癌细胞的增殖(图7a-b)。在EdU实验中,tRF-val-cac016抑制剂可以挽救si-CACNA1d对细胞复制活性的抑制作用(图7c-d)。有趣的是,si-CACNA1d导致HGC-27细胞的G1期阻滞,而NCI-N87细胞的S期阻滞,并且两者都可以被tRF-Val-CAC-016抑制剂挽救(图7e-g)。同样,tRF-Val-CAC-016抑制剂对si-CACNA1d的挽救作用也在克隆形成实验中得到了证实(图7h-i)。si-CACNA1d对CACNA1d、CyclinD1、CyclinB、c-myc蛋白表达的抑制作用被tRF-Val-CAC-016抑制剂部分恢复(图7j-k)。同样,对CACNA1d的功能进行反向验证。分别转染pcDNA-CACNA1d和pcDNA-CACNA1d + tRF-Val-CAC-016 mimics。如图8a-i所示,tRF-Val-CAC-016 mimics可以显著逆转pcDNA-CACNA1d对胃癌细胞增殖的增强作用。pcDNA-CACNA1d显著提高了CACNA1d、CyclinD1、CyclinB、c-myc的蛋白水平,而tRF-Val-CAC-016 mimics可降低这一功能(图8j-k)。
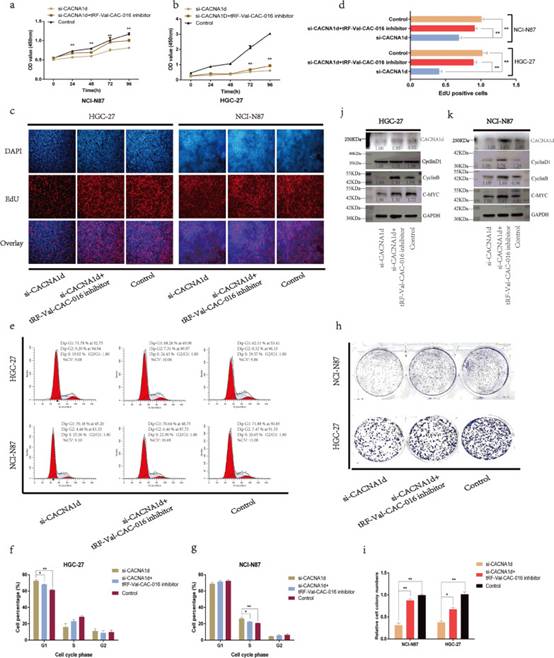
图7si-CACNA1d抑制GC增殖,可被tRF-Val-CAC-016抑制剂挽救
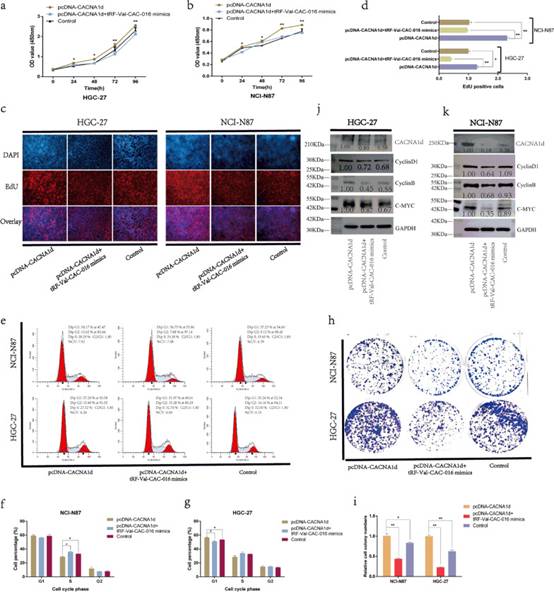
图8pcDNA-CACNA1d增强了GC的增殖,并通过tRF-Val-CAC-016模拟物进行了调节
8.MAPK信号通路抑制剂(p38 MAPK-IN)可逆转tRF-Val-CAC-016抑制剂对胃癌细胞增殖的促进作用
为了证明MAPK信号通路的作用,研究者使用p38 MAPK-in来挽救tRF-Val-CAC-016抑制剂对胃癌增殖的增强作用。这表明p38 MAPK-IN能够部分阻断该通路的传导,表现为tRF-Val-CAC-016抑制剂对胃癌的影响减弱。如图9a-b所示,在CCK-8实验中,tRF-Val-CAC-016抑制剂增强了GC的增殖,p38 MAPK-IN可以部分逆转这一作用。同时,tRF-Val-CAC-016抑制剂促进了细胞的复制活性,p38 MAPK-IN也可以降低这种活性(图9c-d)。流式细胞术检测细胞周期(图9e-g)和免疫印迹法检测CACNA1d、CyclinD1、CyclinB、c-myc(图9h-i)也发生了逆转现象。
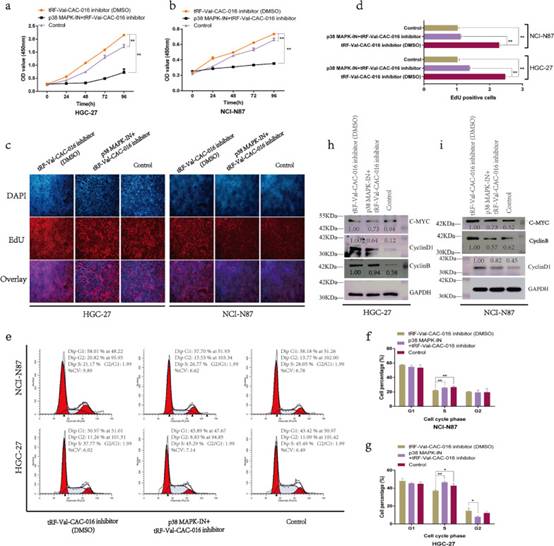
图9MAPK信号通路抑制剂(p38 MAPK-IN)显著逆转了tRF-Val-CAC-016抑制剂对GC增殖的增强
9.tRF-Val-CAC-016抑制NCI-N87移植瘤的增殖
皮下移植实验探讨tRF-Val-CAC-016在体内的作用。结果表明,在异种移植物的体重和肿瘤体积方面,tRF-Val-CAC-016降低了小鼠的肿瘤生长能力(图10a-d)。这些切除肿瘤的PCR结果显示,与激动剂对照组和生理盐水(NS)组相比,tRF-Val-CAC-016激动剂显著抑制了增殖(图10e),这也发生在这些小鼠肿瘤的免疫印迹试验中(图10f)。此外,对ki-67和CACNA1d的免疫荧光染色实验表明,tRF-Val-CAC-016降低了胃癌的增殖能力,进一步证实了CACNA1d蛋白的表达和定位(图10g-h)。同时,免疫组织化学(IHC)检测也证明了在tRF-Val-CAC-016激动剂组中CACNA1d的低表达(图10i)。
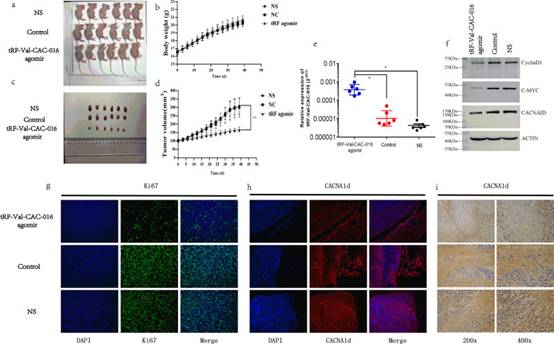
图10tRF-Val-CAC-016抑制NCI-N87异种移植物中的肿瘤增殖
10.tRNA衍生物tRF-Val-CAC-016通过靶向CACNA1d调节经典MAPK信号通路
如图11a所示,机理图清楚地解释了tRF-Val-CAC-016对MAPK信号通路的影响模式。在NCI-N87的免疫印迹实验中,tRF-Val-CAC-016模拟物抑制CACNA1d(Cav1.3)、ERK、p-ERK和p-p38的表达。tRF-Val-CAC-016抑制剂增强了CACNA1d(Cav1.3)、ERK、p-JNK、p38、cyclinB、cyclinD1、c-myc的表达(图11b)。si-CACNA1d可抑制CACNA1d(Cav1.3)、JNK、p-p38、cyclinD1和c-myc的表达水平,该作用可被tRF-Val-CAC-016抑制剂逆转(图11c)。pcDNA-CACNA1d增加了CACNA1d(Cav1.3)、ERK、p-ERK、p-JNK、p38、p-p38、cyclinB、cyclinD1和c-myc的表达,这些表达被tRF-Val-CAC-016模拟物拯救(图11d)。在HGC-27中,tRF-Val-CAC-016模拟物降低,而tRF-Val-CAC-016抑制剂促进了CACNA1d (Cav1.3)、ERK、p-ERK、JNK、p-JNK、p38、p-p38、cyclinB、cyclinD1、c-myc的蛋白水平(图11e)。si-CACNA1d下调CACNA1d(Cav1.3)、ERK、JNK、p-JNK、p38、p-p38、cyclinB和cyclinD1,该作用可被tRF-Val-CAC-016抑制剂逆转(图11f)。pcDNA-CACNA1d增强CACNA1d(Cav1.3)、ERK、p-ERK、JNK、p-JNK、p38、p-p38、cyclinB、cyclinD1和c-myc,而tRF-Val-CAC-016 mimics则表现出减弱作用(图11g)。
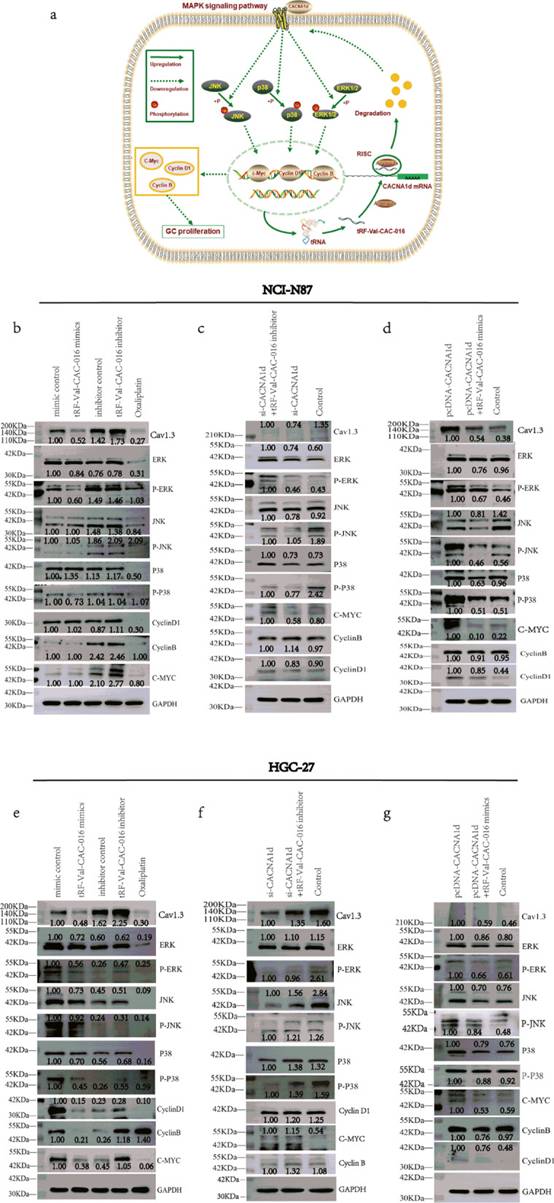
图11tRNA衍生物tRF-Val-CAC-016通过靶向CACNA1d调节MAPK信号通路
结论:
本研究首次阐明了tRF-Val-CAC-016在胃癌中的功能。对tRF-Val-CAC-016参与机制的讨论在一定程度上较为全面。tRF-Val-CAC-016在胃癌组织中表达显著下调,临床病理分析显示其表达与组织学类型和肿瘤大小相关。此外,tRF-Val-CAC-016通过调节CACNA1d介导的MAPK信号通路的转导而抑制胃癌的增殖。综上所述,tRF-Val-CAC-016有望成为胃癌潜在的诊断标志物和新的治疗靶点。
参考文献:
Xu W, Zheng J, Wang X, Zhou B, Chen H, Li G, Yan F. tRF-Val-CAC-016 modulates the transduction of CACNA1d-mediated MAPK signaling pathways to suppress the proliferation of gastric carcinoma. Cell Commun Signal. 2022 May 19;20(1):68. doi: 10.1186/s12964-022-00857-9.






