tRNA m7G修饰通过RPTOR/ULK1/自噬轴促进食管鳞状细胞癌的发生
食管癌是一种恶性肿瘤,全世界每年有超过40万人死于食管癌。转运RNA (Transfer RNAs, tRNAs) 是信使RNA上识别密码子和连接信使RNA翻译氨基酸的调节因子。然而,tRNA m7G修饰在ESCC中的具体功能和分子机制尚不清楚。本研究发现tRNA m7G甲基转移酶复合体蛋白METTL1和WDR4在食管鳞状细胞癌 (ESCC) 组织中显著上调,于是作者探索METTL1和WDR4在ESCC中的调控作用。本文于2022年3月发表于《Nature Communications》,IF=14.919。
本文技术路线:

本文主要内容:
1 、METTL1 /WDR4在ESCC中上调,并与ESCC不良预后相关
作者使用ESCC样本队列检测METTL1/WDR4的表达。数据显示,与相应的对照组相比,在ESCC样本中METTL1/WDR4表达和m7G tRNA修饰均升高(Fig 1a,b)。此外,免疫组化(IHC)染色显示,METTL1在ESCC肿瘤组织中的表达高于肿瘤周围组织(Fig 1c–e),METTL1的表达与肿瘤的高分级和高分期显著相关(Fig 1f–h),说明METTL1在ESCC进展中的所必需的。进一步研究ESCC患者中METTL1表达与预后的关系。生存分析显示,METTL1高表达与较差的总生存和无病生存状态相关(Fig 1i,j)。同样,WDR4在ESCCs中也上调,并与预后不良相关(Fig 1k,l)。总之, METTL1和WDR4在ESCC中显著上调,并与ESCC进展和不良预后相关。
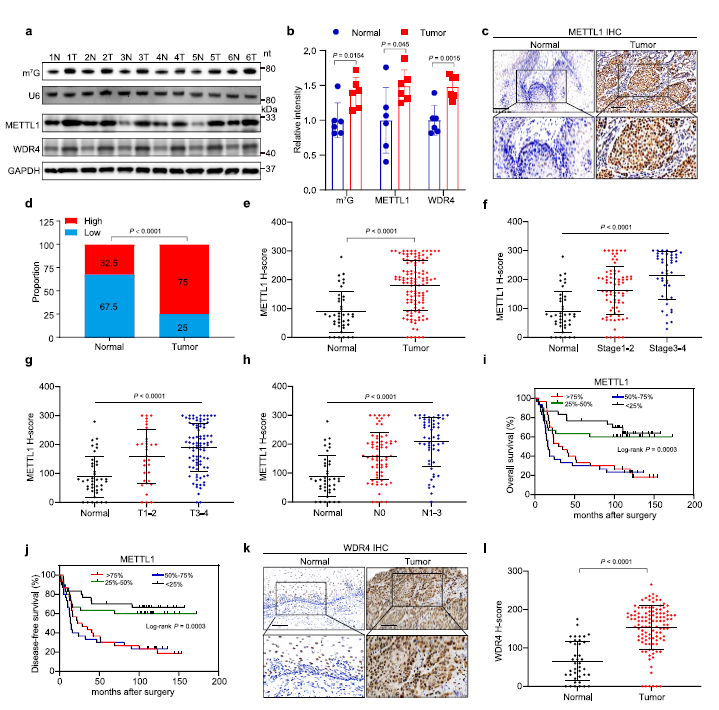
Fig1 ESCC患者METTL1升高,是ESCC患者的不良预后因素
2、靶向METTL1表达可抑制ESCC进展
ESCC中METTL1表达的升高,作者推测METTL1在ESCC进展中起重要的致癌作用。为了验证这一假设,首先使用两个短发夹RNA(shM1-1和shM1-2)在KYSE150 (K150)和KYSE30 (K30) ESCC细胞中进行METTL1敲低(Fig. 2a),抑制METTL1的增殖(Fig 2b)和集落形成能力(Fig 2c,d)。流式细胞术分析显示shM1-1和shM1-2可导致ESCC细胞凋亡增加 (Fig. 2e,f)。然后,利用异种移植小鼠模型,探讨METTL1在体内ESCC进展中的作用。与注射shGFP ESCC细胞的小鼠相比,注射METTL1敲除细胞的小鼠的肿瘤生长明显减慢,肿瘤大小和重量明显降低(Fig 2g–i)。免疫组化染色显示shM1-1和shM1-2组肿瘤中METTL1表达降低,Ki67染色水平降低,证实下调METTL1可降低ESCC体内增殖活性(Fig 2j,k)。总之,作者的研究揭示了METTL1在体外和体内ESCC进展中的基本功能。
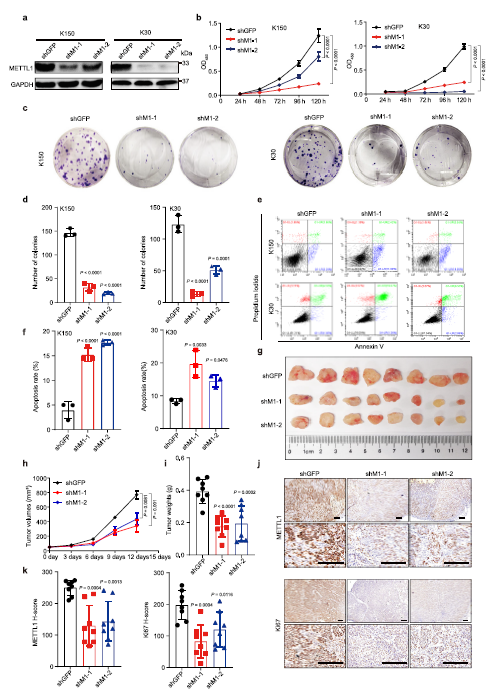
Fig2体外和异种移植模型中,METTL1基因敲低可抑制ESCC进展
3、METTL1调控ESCCs中m7G tRNA修饰、tRNA表达和mRNA翻译
在作者的TRAC seq数据中,作者在可变环中发现了19个m7G修饰的带有ABGWY基序序列的tRNAs (Fig 3a)。METTL1的消耗显著降低了m7G修饰水平(Fig 3b,c),RNA质谱也证实了METTL1中tRNA m7G修饰水平的降低。作者的RNA质谱也证实了METTL1敲除细胞中tRNA m7G修饰水平的降低(Fig 3d)。此外,METTL1的缺失降低了大多数m7G修饰的tRNAs的表达水平,而非m7G修饰的tRNAs,其表达几乎没有受到影响(Fig 3e,f)。与测序数据一致,作者的m7G Northern印迹杂交和Northwestern印迹杂交分析证实,在METTL1敲除细胞中,m7G修饰水平降低,m7G修饰的tRNAs表达降低 (Fig 3g)。此外,过表达野生型METTL1,而非其催化死亡突变体,增加了m7G tRNA的整体修饰水平和m7G修饰的tRNA的表达(Fig 3h),证实METTL1通过其tRNA m7G甲基转移酶活性调控tRNA的修饰和表达。同样,抑制WDR4导致m7G修饰水平和m7G修饰的tRNA表达下降;WDR4的过表达增加了K150和K30 ESCC细胞中m7G tRNA修饰和m7G修饰的tRNA 的表达(Fig 3i,j)。这些数据支持了METTL1/WDR4在调控tRNA m7G修饰和表达中的基本功能。
鉴于tRNAs在mRNA翻译中起作用,作者接下来确定METTL1是否对ESCC细胞mRNA翻译有影响。多聚体分析表明,在METTL1敲低细胞中mRNA翻译活性降低,反映在多聚核糖体峰减少(Fig 3k)。 此外,嘌呤霉素摄取量测定也证实了这一点。ESCC细胞中METTL1基因的敲除降低了mRNA的翻译活性(Fig 3L)。在METTL1缺失的细胞中,重新表达野生型METTL1而不是突变型METTL1可以挽救mRNA的翻译效率(Fig 3l),证明m7G的催化功能对METTL1促进mRNA翻译至关重要。总的来说,作者的数据表明,METTL1介导的m7G tRNA修饰对ESCC中tRNA的表达和mRNA的翻译至关重要。
为了研究异常m7G修饰介导的翻译障碍的影响,作者使用METTL1敲除和控制ESCC细胞进行了多核糖体结合mRNA测序(Fig 3m)。作者的数据显示,翻译效率(TEs)降低的mRNA有明显更多的密码子被m7G修饰的tRNAs解码(Fig 3n)。Go和KEGG分析结果表明,下调的mRNA显著富集在在自噬生物学过程和mTOR信号通路 (Fig 3o,p)。值得注意的是,与其他检测到的mRNA相比,TEs降低,参与自噬生物学过程或mTOR信号通路的mRNA,有更多的密码子被m7G修饰的tRNA解码 (Fig 3q)。
接下来作者探讨METTL1在调节自噬负调控和mTOR信号通路基因表达中的作用,结果显示,METTL1减少了它们的蛋白质表达,但对它们的mRNA几乎没有影响(Fig 3r,s)。此外,多核糖体qPCR检测进一步证实了RPTOR的翻译效率(Fig 3I)。mTOR信号通路通过pULK1负调控自噬。研究发现,METTL1的消耗降低了pULK1的水平,增加了氯喹(CQ)处理和未处理的K150和K30细胞中LC3-II/LC3-I比例(Fig 3u,v)。总之,METTL1以m7G相关密码子依赖的方式促进mTOR信号相关基因的翻译和自噬通路的负调控。
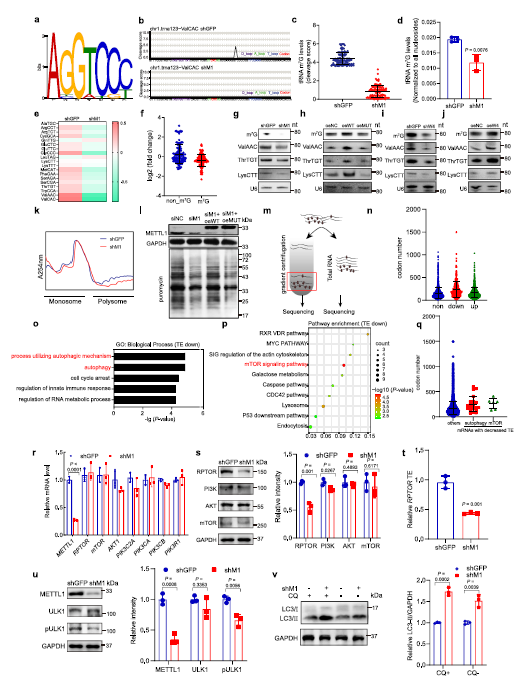
Fig 3 METTL1调控tRNA m7G修饰、tRNA表达和致癌mRNA翻译
4、 RPTOR是METTL1的重要下游靶点
作者进一步发现,RPTOR的重新表达挽救了METTL1衰竭的增殖和集落形成能力ESCC细胞(Fig. 4a–d)。此外,RPTOR过表达增加了ULK1蛋白的磷酸化水平,降低了METTL1耗竭细胞的LC3-II/LC3-I比值,并消除自噬通量(Fig. 4e–h)。总的来说,这些数据表明RPTOR是METTL1的重要下游靶点,进一步证实METTL1介导的tRNA m7G修饰通过调控RPTOR促进ESCC进展。
鉴于在METTL1敲除的ESCC细胞中,RPTOR可以挽救ULK1的磷酸化水平,减少自噬,作者接下来在METTL1敲除的ESCC细胞中敲除ULK1,以确定METTL1和RPTOR是否通过调节ULK1介导的自噬来促进ESCC进展(Fig. 4i)。数据表明,抑制ULK1可以挽救METTL1枯竭的ESCC细胞的生长(Fig. 4j),进一步证明METTL1和RPTOR通过ULK1调控ESCC的进展。此外,自噬通量检测表明,敲除ULK1可以消除METTL1缺失的ESCC细胞中增加的自噬通量(Fig. 4k–m)。总的来说, RPTOR/自噬轴在介导METTL1在ESCC进展中的功能中具有重要作用。
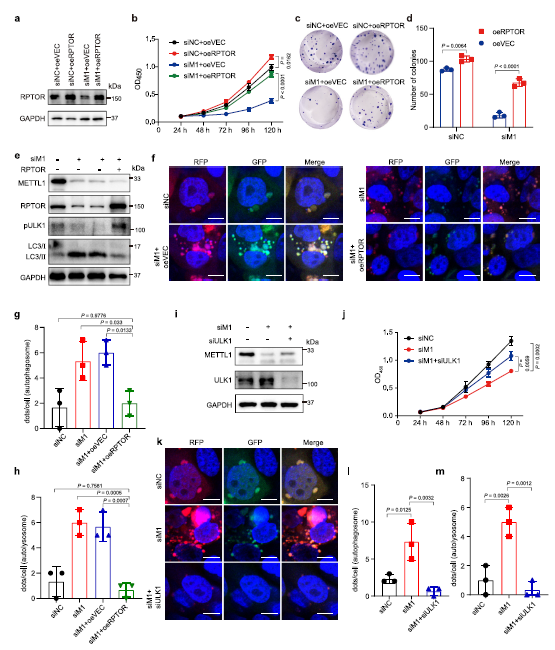
Fig4 METTL1/RPTOR/ULK1轴在ESCC进展中起重要作用
5、METTL1的敲除(cKO)可在体内抑制ESCC的肿瘤发生
为了直接探究m7G tRNA修饰在体内ESCC肿瘤发生中的作用,作者构建了上皮组织特异性Mettl1条件敲除)小鼠模型(Keratin14-CreER; Mettl1fl/fl, cKO。用他莫西芬诱导Mettl1敲除后,用DNA烷基化剂二乙基亚硝胺(DEN)和多激酶抑制剂索拉非尼(sorafenib)诱导cKO小鼠和对照组小鼠发生ESCC肿瘤(Fig 5a)。在DEN治疗8周,sorafenib治疗12周后,作者发现对照小鼠的食道有明显的病理改变,而metttl1 cKO小鼠的病变面积和ESCC数量明显减少(Fig 5a–e)。组织学分析显示,与对照组相比,cKO小鼠肿瘤组织中METTL1和Ki67染色水平降低(Fig 5f,g)。
作者还发现Mettl1 cKO降低了Mettl1 cKO小鼠肿瘤中m7G tRNA修饰,降低了RPTOR蛋白水平(Fig 5h-j),而RPTOR mRNA水平保持不变(Fig 5k)。值得注意的是,cKO组肿瘤中LC3蛋白水平明显高于对照组(Fig 5l,m),cKO组的LC3蛋白水平明显高于对照组,说明METTL1基因敲除导致体内自噬增加。
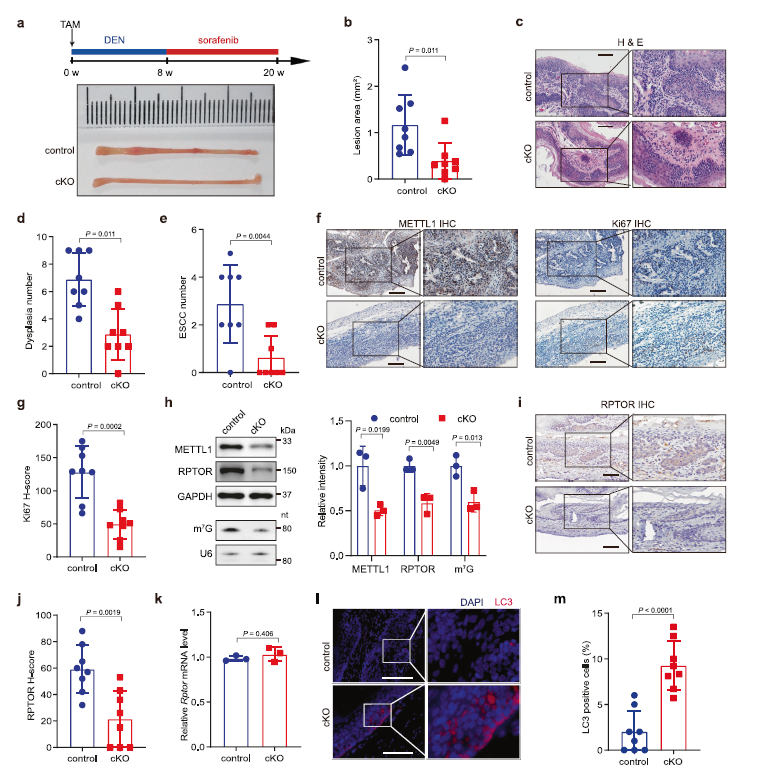
Fig5 敲除METTL1可抑制ESCC体内肿瘤发生
6、METTL1 /WDR4介导的m7G tRNA修饰促进 ESCC进展
为了进一步加强m7G tRNA修饰与ESCC进展之间的功能联系,作者进行了功能获得研究(Fig 6a)。数据表明,过表达野生型METTL1而非其催化死亡的突变体可以促进ESCC细胞的生长和集落形成 (Fig 6b–e)。此外,过表达而非突变的METTL1可以上调RPTOR蛋白的表达,减少细胞凋亡和自噬 (Fig 6f–i)。总之,METTL1在调节靶向表达和ESCC进展中,tRNA m7G的催化功能是必不可少的。
然后作者在ESCC细胞中过表达WDR4,进一步证实了作者的结论,m7G tRNA修饰促进了WDR4的表达ESCC进展。作者的数据显示过表达WDR4稳定了METTL1蛋白的表达,增加了下游靶蛋白RPTOR的表达 (Fig 6j)。功能分析表明,过表达WDR4可促进ESCC细胞生长和集落形成 (Fig 6k–m)。这些数据说明ESCC进展中WDR4是一个重要的致癌基因。总之, MRTTL1 /WDR4介导的m7G tRNA修饰在调节ESCC进展中的重要致癌功能。
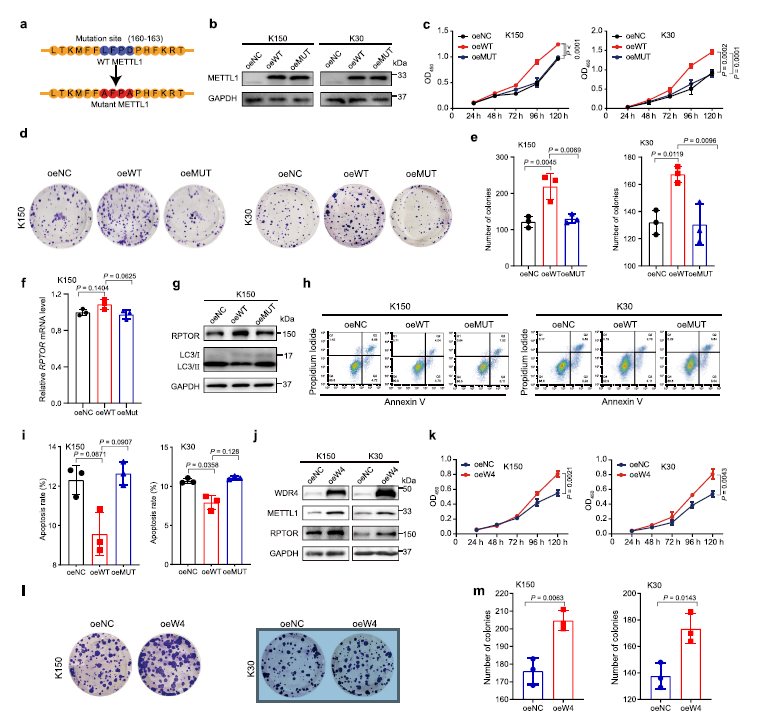
Fig 6 METTL1或WDR4过表达促进ESCC进展
7、METTL1在体内促进ESCC肿瘤的发生
在DEN/sorafenib治疗18周后,Mettl1 CKI小鼠的食道出现了巨大的肿瘤负荷,而对照组小鼠的食道只出现了少量和小的病变(Fig 7a-c)。此外,CKI小鼠异常增生和鳞状细胞癌的数量明显高于对照组(Fig 7d–f)。组织学分析显示,cKI小鼠肿瘤中METTL1表达水平和增殖活性均高于对照组(Fig 7g,h)。此外, cKI小鼠肿瘤中m7G tRNA修饰和m7G修饰的tRNA表达水平均高于对照组小鼠(Fig 7i)。此外,在Mettl1 cKI小鼠肿瘤中,RPTOR蛋白水平升高,但其mRNA水平没有升高(Fig 7j–m)。综上所述,METTL1和m7G tRNA修饰促进了ESCC体内肿瘤的发生和发展。
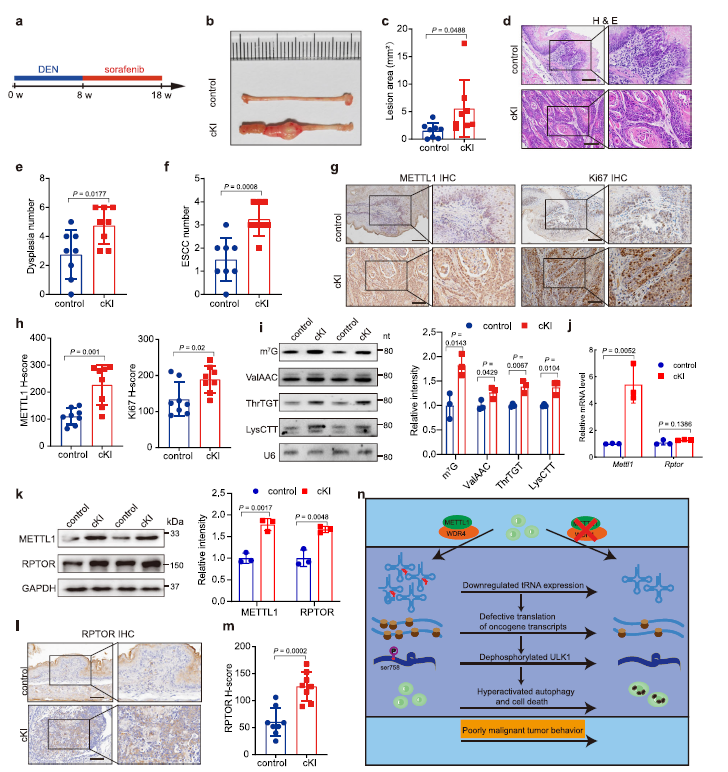
Fig7 METTL1过表达促进ESCC体内肿瘤发生
本研究揭示了METTL1介导的ESCC肿瘤发生的机制,发现METTL1/WDR4介导tRNA m7G修饰在选择性致癌mRNA翻译和ESCC进展中发挥着重要的生理功能,为建立新的ESCC治疗策略提供了分子基础。
参考文献:
Han H, Yang C, Ma J, Zhang S, Zheng S, Ling R, Sun K, Guo S, Huang B, Liang Y, Wang L, Chen S, Wang Z, Wei W, Huang Y, Peng H, Jiang YZ, Choe J, Lin S. N7-methylguanosine tRNA modification promotes esophageal squamous cell carcinoma tumorigenesis via the RPTOR/ULK1/autophagy axis. Nat Commun. 2022 Mar 18;13(1):1478. doi: 10.1038/s41467-022-29125-7. PMID: 35304469.






