首次发现线粒体自噬有利于细胞死亡和主动脉瓣钙化
在过去的15年里,一些观察试图阐明钙化性主动脉瓣狭窄(CAVS)的细胞自我消化过程的失调,但得到的结果仍然存在争议。本研究旨在明确CAVS患者的自噬趋势,分析影响线粒体质量控制机制的其他可能参与的决定因素,并探索CAVS治疗中可能的药物干预途径。本研究于2021年8月发表在《Cardiovascular Research》IF:10.787期刊上。
技术路线:

主要实验结果:
1、钙化的瓣膜增加了自噬,和持续的细胞死亡
为了确定CAVS患者中的自噬趋势,作者首先检测了钙化的主动脉瓣(AV)的自噬水平。由于部分瓣叶钙化程度高,并非44例CAVS患者的AVs全部产生活细胞,其产率约为50%。茜素红染色证实了CAVS的钙化表型(Figure 1A)。然后通过免疫荧光、GFP-LC3构建的HAVICs转染和western blot检测特异性自噬标志物,如p62、LC3-II和BECN1,来评估自噬。每个细胞的GFP-LC3点数(Figure 1B)、BECN1和LC3-II表达的增加以及p62表达水平的降低(Figure 1C)均证实钙化AV中自噬水平高于未钙化AV。
为了区分自噬过程的增加是由于自噬通量的有效激活还是由于自噬体溶酶体融合的抑制,用BAF-A1处理细胞,BAF-A1是溶酶体酸化的抑制剂,广泛用于模拟自噬通量的阻断(Figure 1D)。BAF-A1暴露后,在ARA和CAVS细胞中LC3-II的表达均增加,这些数据也被免疫荧光证实(Figure 1E)。这一发现证实了CAVS瓣膜比ARA标本具有更持久的自噬水平,并证明了这一特征并非由于自噬通量的改变。通过增加PARP、RIP和CAS3等切割蛋白的数量,以及Annexin V和PI探针荧光信号的表达,可见CAVS组细胞死亡显著增加(Figure 1F– H)。在活细胞中的下游分析也表明存在失调的Ca2+动力学。与ARA组相比,CAVS细胞的胞质Ca2+减少,无论是基础Ca2+还是对激动剂的反应(Figure 1I)。
以上结果表明,与未钙化ARA相比,CAVS患者的HAVICs细胞自噬水平更高,且是因为自噬体溶酶体抑制而非自噬通路增加,并且细胞死亡更多。
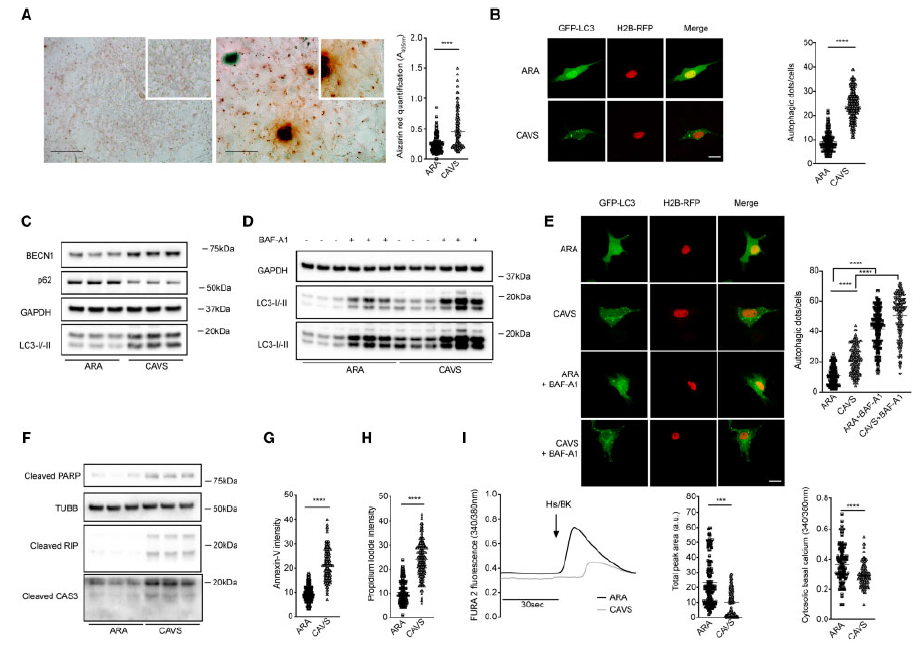
图1评估CAVS和ARA患者来源的HAVICs的自噬
2、CAVS中的线粒体功能和线粒体自噬
在不同病理条件下的研究表明,细胞内Ca2+通量和自噬是细胞生物能的正确维持的决定因素。特别是自噬程度和Ca2+均可激活和调节线粒体氧化磷酸化和ATP生成。鉴于Ca2+动态水平的改变和CAVS中自噬的增加,作者决定确定这些细胞中线粒体呼吸的状态。利用Seahorse XF分析仪检测到与ARA相比,CAVS患者线粒体OCR明显下降(Figure 2A),ATP产量减少,最大呼吸能降低(Figure 2B),提示线粒体解偶联。这些变化伴随着乳酸生成的增加(Figure 2C),这可能是为了通过糖酵解活动产生无氧ATP。
图2中报告的数据涉及旨在控制HAVICs线粒体质量和功能的过程。为了保持有功能和健康的线粒体群,细胞必须用更有功能的线粒体替换有缺陷的线粒体。这样的线粒体转换是由几种机制保证的,最重要的是线粒体自噬和线粒体生物发生的比率。为了研究线粒体的转换,使用了荧光质粒MITO TIMER,该质粒以绿色标记新合成的线粒体,而荧光随着线粒体种群的老化而变为红色。荧光显示,与ARA瓣相比,CAVS的线粒体明显老化,功能较差(Figure 2D)。通过测量PGC1α的表达来评估线粒体的生物发生,而PGC1α在CAVS中表达强烈下调(Figure 2E)。综上所述,细胞死亡的增加伴随着线粒体生物发生的减少和老化,表明线粒体转换存在缺陷。
然后,研究了分离的HAVICs的线粒体自噬,数据表明,通过溶酶体跟踪器(溶酶体标记物)和线粒体标记物荧光探针之间的共定位分析,线粒体自噬显著增加(Figure 2F)。最近,Saito等展示了在体内能量应激(如缺血)时,线粒体如何通过一种替代途径被激活,该途径不包括Parkin和PINK1,但涉及ULK1/Rab9/RIP1/Drp1轴。事实上,该多蛋白复合物的形成由磷酸化级联(ULK1的S555, Rab9的S179, Drp1的S616)触发,允许Drp1依赖的线粒体破碎和线粒体自噬。虽然本研究没有发现缺血现象,但考虑到线粒体自噬在体内可以通过其他途径发生,所以作者研究了在CAVS中观察到的线粒体自噬是否遵循ULK1/Rab9/RIP1/ drp1依赖途径。为此,分析了ULK1在S555位点和Drp1在S616位点的磷酸化状态,结果显示在ARA和CAVS样品之间没有显著差异(Figure 2G)。
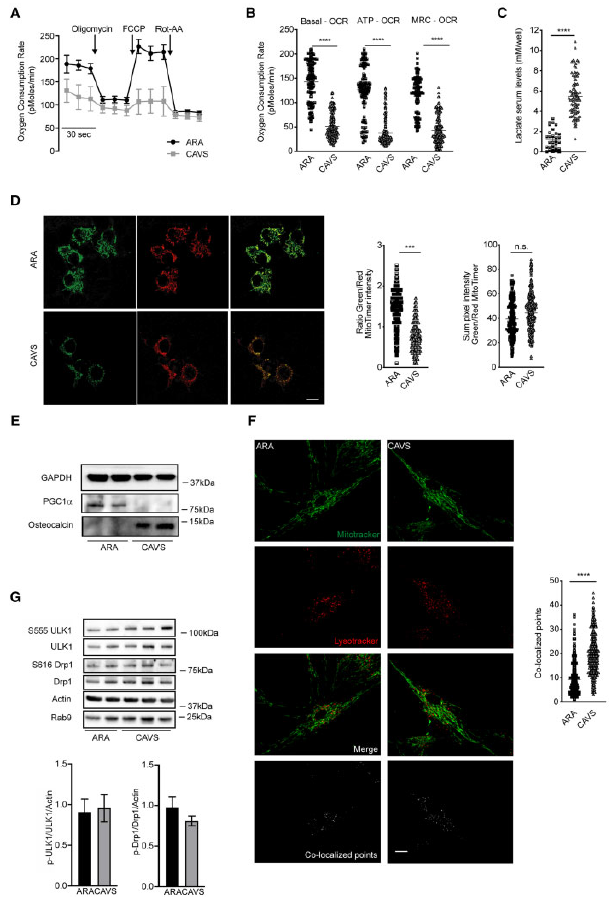
图2 HAVICs的线粒体自噬
3、自噬和线粒体自噬在CAVS患者血清中上调,并与晚期心脏病相关
为了进一步评估CAVS的自噬,作者在图1和图2中检测并定量了来自同一队列患者的血清中的自噬生物标志物ATG5和BECN,即44例AS患者,15例ARA患者(表1),以及另外45名健康志愿者。
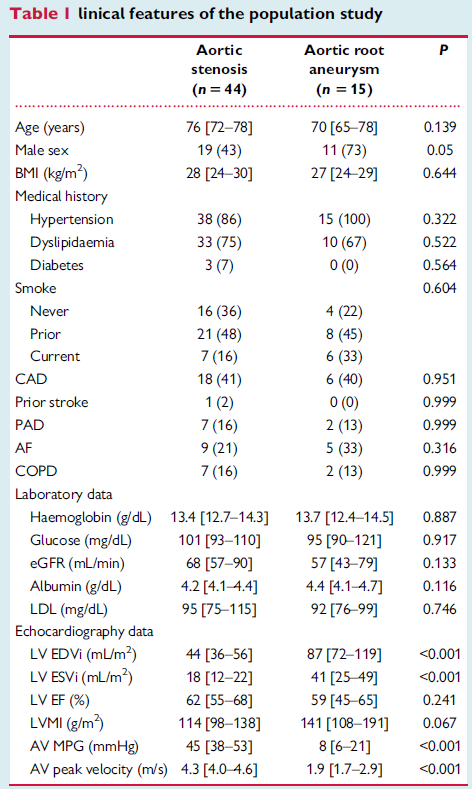
结果显示,健康志愿者与ARA组及CAVS组之间ATG5值均呈升高趋势,而BECN1水平无显著性差异,仅ARA组与CAVS组及健康志愿者与CAVS组之间差异显著。总的来说,CAVS患者的循环自噬蛋白显著高于对照组和ARA患者(Figure 3A and B)。与其他两组相比,CAVS的炎症细胞因子IL-1β和IL-18水平也显著升高(Figure 3G and H)。与此同时,为了证实图2所示的结果,利用同一队列患者的生物标志物Parkin、PINK1、ATG7和OPTN对CAVS血清中的线粒体自噬进行了研究。结果发现和健康对照和ARA相比,这些指标都在CAVS组上调表达(Figure 3C–F)。根据ATG5 (17 ng/mL)、BECN1 (5 ng/mL)、ATG7 (8 ng/mL)、OPTN (6 ng/mL)的中位值对CAVS患者进行分层。如图3I和3J所示,ATG5、BECN1、ATG7、OPTN水平高于中位值的患者左室收缩末期容积(LV ESVi)较大,这是临床危重晚期的指标。随后作者探究这一人群中瓣膜钙化级别和自噬和线粒体自噬水平之间的相关性。结果发现线粒体自噬OPTN和茜红素正相关,OPTN/PINK1和CT-AVC正相关(Figure 3K and L)。
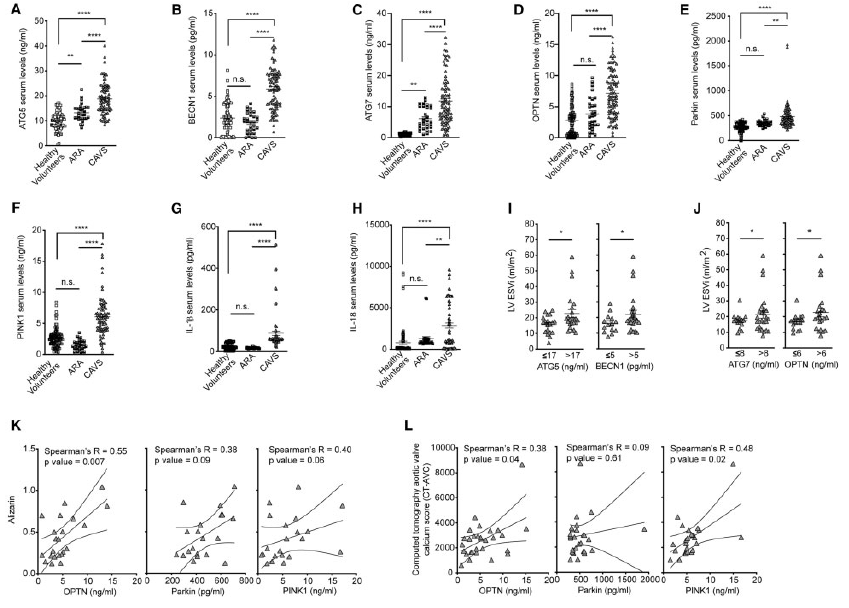
图3 患者血清中自噬和线粒体自噬标志物和炎症细胞因子检测及钙化分级
4、诱导自噬可以恢复大部分的CAVS表型特征
前面的数据表明,CAVS的特征是自噬增加、细胞死亡增多和线粒体吞噬水平增加,老化线粒体无法更新。然后,作者验证其假说:进一步促进自噬可以促进死亡细胞的清除和改善钙化表型。图3A表明100 nM雷帕霉素处理3 h可抑制MTOR和P70S6K的磷酸化。图4B-4C表明CAVS细胞用雷帕霉素处理增加了自噬点(用GFP-LC3检测)和线粒体自噬(溶酶体荧光和线粒体荧光共定位表示)。通过PARP、CAS3和RIP标记物以及流式检测评估雷帕霉素诱导的自噬和线粒体自噬减少了细胞死亡(Figure 4D– F)。用雷帕霉素长期治疗7天改善钙化表型,通过茜素红染色检测发现含钙骨细胞信号降低(Figure 4G)。雷帕霉素也部分恢复了细胞内Ca2+的整体动态。事实上,当用雷帕霉素处理CAVS样本时,观察到基础细胞内Ca2+水平显著恢复。尽管如此,雷帕霉素并不能改善激动剂刺激后Ca2+的增加(Figure 4H)。
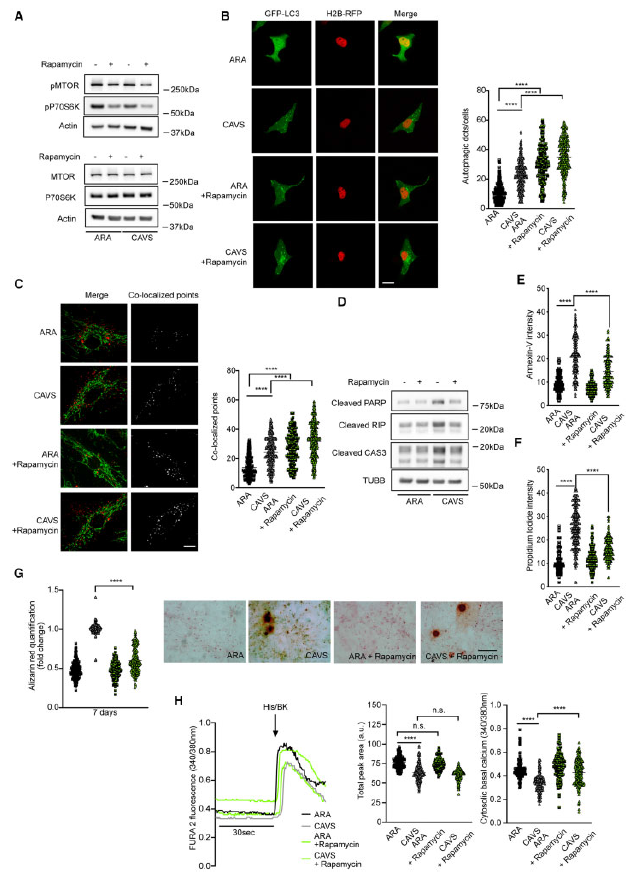
图4雷帕霉素对自噬和线粒体自噬过程的调节
总之,本研究发现自噬和线粒体自噬通路在CAVS中是活跃的,并且增加了。还首次表明,主动脉钙化引起重要的线粒体改变,包括老化的线粒体群体,抑制生物发生,Ca2þ失调,和低ATP形成。这种改变可能是细胞死亡和成骨驱动的钙化过程的部分原因,这表明,尽管自噬和自噬在高水平上表达,但这些分解代谢过程的激活不足以抵消危险的表型。因此,至少在体外,通过用雷帕霉素增强它们,可以减少细胞死亡,并部分恢复Ca2þ失调。
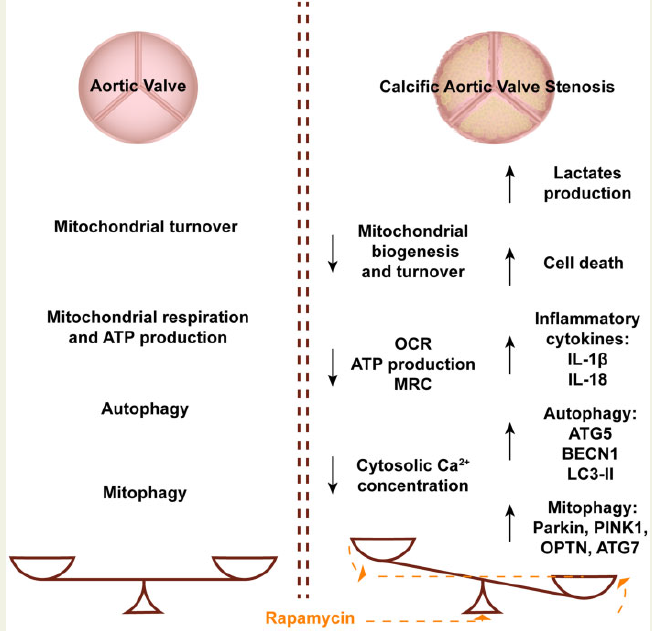
图5 模拟机制图
参考文献:
Morciano Giampaolo., Patergnani Simone., Pedriali Gaia., Cimaglia Paolo., Mikus Elisa., Calvi Simone., Albertini Alberto., Giorgi Carlotta., Campo Gianluca., Ferrari Roberto., Pinton Paolo.(2021). Impairment of mitophagy and autophagy accompanies calcific aortic valve stenosis favoring cell death and the severity of disease. Cardiovasc Res, undefined(undefined), undefined. doi:10.1093/cvr/cvab267






