hsa_circ_0005358抑制宫颈癌转移
转移是宫颈癌致死的主要原因,但迄今为止,还没有有效的治疗方法来阻止转移。circRNAs被发现与癌症转移有关。在本研究中,我们在宫颈癌组织中发现了一个来自宿主基因Gli1的表达下调的circRNA (hsa_ circ_0005358),该circRNA在有颈外转移的组织中表达量低于无颈外转移的组织。上调hsa_circ_0005358可显著抑制宫颈癌细胞的体外迁移和侵袭,下调hsa_circ_0005358则相反。小鼠模型显示过表达hsa_ circ_0005358的宫颈癌细胞在体内具有较弱的转移潜能。RNA下拉分析、质谱分析和RNA免疫沉淀验证了hsa_circ_0005358通过其215-224序列发挥作用,该序列与PTBP1相互作用。RNA测序分析显示,CDCP1是hsa_circ_0005358和PTBP1的共同靶点。我们进一步证实,hsa_circ_0005358隔离了PTBP1,阻止其稳定CDCP1 mRNA,减少CDCP1蛋白翻译,最终抑制肿瘤转移。我们的研究结果揭示了hsa_ circ_0005358在肿瘤转移中的作用,这可能为转移性宫颈癌患者提供一种潜在的治疗方法。本文于2021年11月发表于“Molecular Therapy: Nucleic Acids”(IF=8.886)。
技术路线
结果
1)hsa_circ_0005358的识别和特征
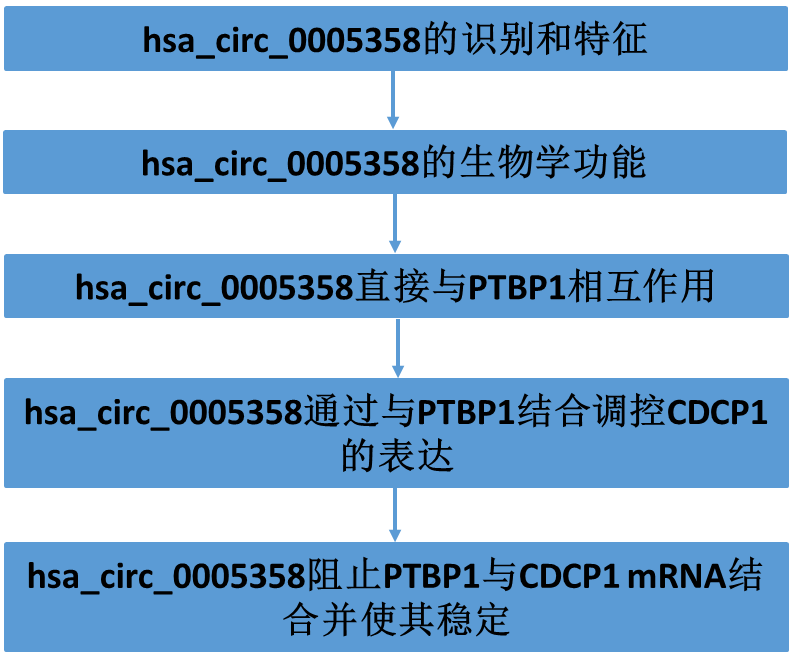
在我们前期的研究中,对12份颈标本进行了circRNA测序分析(GEO: GSE147009),其中包括6个正常宫颈组织和6个宫颈癌组织。测序结果显示共有257个circRNA在宫颈癌组织中显著下调 (图1A)。我们集中研究了宫颈癌组织中15个差异最大的下调circRNA。考虑到hsa_circ_0005358是宫颈癌组织中表达最明显的circRNA之一,且在不同的引物中特异性最大,我们选择hsa_circ_0005358进行进一步研究。基因组结构表明,hsa_circ_0005358是由人类Gli1基因(chr12:57,861,115-57,862,007)生成的(图1B)。我们利用SiHa和CaSki两株宫颈癌细胞株的cDNA和gDNA进行了PCR。如果没有特定的环状连接,当使用发散性引物时,gDNA不能扩增PCR产物(图1C)。我们还设计了两对引物对全长hsa_ circ_0005358进行扩增,并通过DNA凝胶电泳对扩增产物进行了验证(图1D)。在northern blot实验中,使用靶向特异性连接的探针在SiHa和CaSki细胞中检测到了内源性hsa_circ_0005358的表达(图1E)。此外,RNase R处理后,其宿主基因的mRNA表达显著减少,hsa_circ_0005358对RNase R消化具有抗性(图1F),这表明hsa_circ_0005358 RNA是一种稳定的环状结构。RNA荧光原位杂交(FISH)(图1G)和亚细胞分离试验(图1H)显示,hsa_ circ_0005358主要位于SiHa和CaSki细胞的细胞核中,但也存在于细胞质中。综上所述,hsa_circ_0005358在宫颈癌细胞中是一个稳定的circRNA。
2)Hsa_circ_0005358在体内外均可作为宫颈癌转移行为的抑制因子
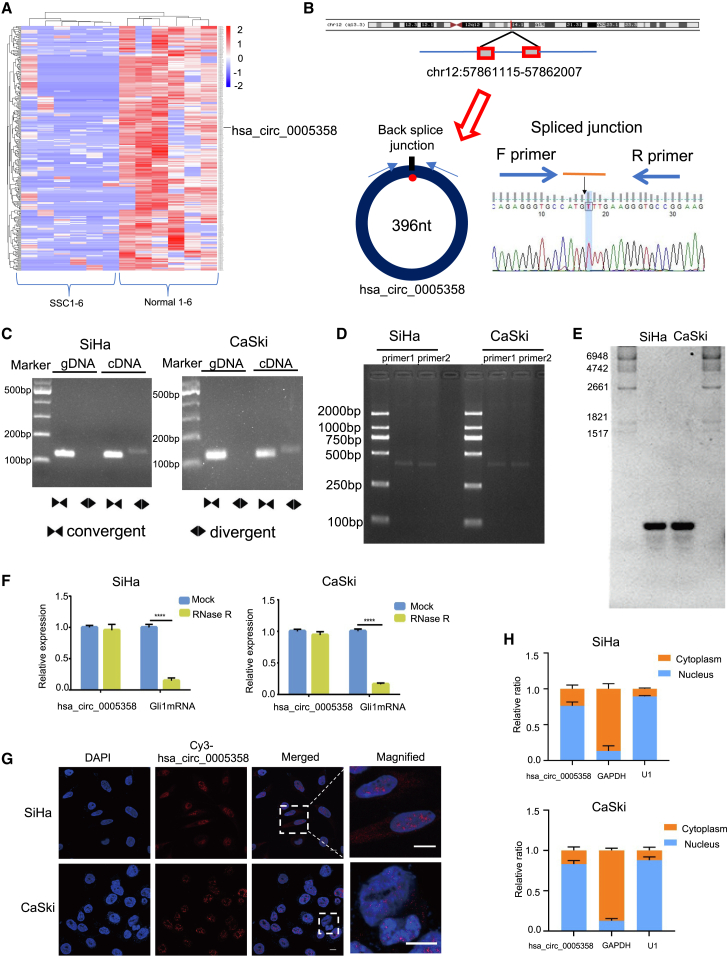
为了探究hsa_circ_0005358的生物学功能,我们构建了一个过表达hsa_circ_0005358的质粒。采用Transwell法检测细胞迁移和侵袭能力。过表达hsa_circ_0005358后,与对照细胞相比,SiHa和CaSki细胞的迁移和侵袭率均显著降低(图2A和2B)。伤口愈合检测显示,过表达hsa_ circ_0005358可导致间隙闭合减慢(图2C)。CCK-8检测显示hsa_circ_0005358过表达和不过表达的细胞的增殖能力无显著差异(图2D),说明过表达hsa_circ_0005358的细胞迁移和侵袭能力的降低并不是细胞增殖率降低的结果。
为了证实hsa_circ_0005358在体内对肿瘤转移的抑制作用,我们将稳定过表达hsa_circ_0005358或对照载体的SiHa细胞经尾静脉注射到雌性SCID小鼠体内,并利用体内成像技术,每周通过发光监测肿瘤转移情况。我们发现hsa_circ_0005358在注射4周后,与对照组相比,过表达hsa_circ_0005358显著抑制SiHa细胞的转移(图2E和2F)。H&E染色组织学显示肺转移灶的典型形态(图2G)。hsa_circ_0005358过表达组的转移结节数量明显少于对照组(图2H)。此外,与正常宫颈组织相比,hsa_circ_0005358在宫颈癌组织中明显缺失,而宫颈外侵袭或淋巴结转移(FIGO II期或以上)的肿瘤样本中hsa_ circ_0005358的表达量明显低于宫颈肿瘤样本(FIGO I期)(图2I)。综上所述,hsa_ circ_0005358是宫颈癌转移的抑制因子。
3)hsa_circ_0005358直接与PTBP1相互作用
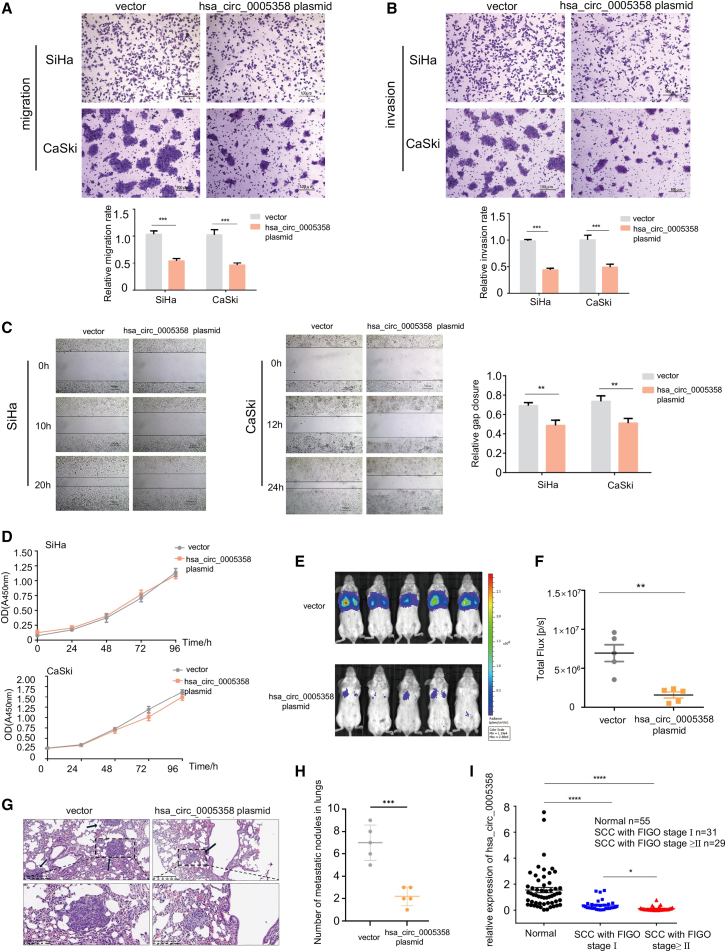
hsa_circ_0005358序列的生物信息学分析表明hsa_circ_0005358可能与RBP相互作用。为了探索hsa_circ_0005358的蛋白伴侣,我们进行了RNA-pull-down分析。结果显示在hsa_circ_0005358探针道中约55-70 kDa处有一条明显的条带(图3A)。质谱结果证实,该差异带的主要成分为PTBP1,这是宫颈癌中上调的基因。western blot分析(图3B)和RIP分析(图3C)显示hsa_circ_0005358和PTBP1之间存在相互作用。RNA-pull-down分析(图3D)和RIP分析(图3E)表明,hsa_circ_0005358过表达时,hsa_circ_0005358与PTBP1之间的相互作用更强。接着,我们利用生物信息学分析预测了hsa_circ_0005358和PTBP1之间的5个潜在结合位点,然后构建了5个针对每个结合位点的突变circRNA质粒(Mut1-Mut5)和另一个包含所有潜在突变结合位点的质粒(Mut6)(图3F)。这些突变都没有影响hsa_circ_0005358的圆形结构。如图3 G和3 H,Mut1、Mut2和Mut3质粒的过表达显著抑制了SiHa和CaSki细胞的迁移和侵袭,而Mut4、Mut5和Mut6则丧失了这种功能,说明Mut4和Mut5所在的序列215-224是hsa_- circ_0005358功能所必需的。我们将序列215-224突变的hsa_circ_0005358质粒命名为Mut-hsa_circ_0005358(图3I)。RNA下拉分析显示,PTBP1在SiHa和CaSki过表达Mut-hsa_circ_0005358的细胞中富集程度低于过表达野生型hsa_circ_0005358的细胞(图3J)。RIP检测和qRT-PCR显示,Mut-hsa_circ_0005358不能被PTBP1捕获(图3K)。过表达Mut-hsa_circ_0005358的细胞表现出与对照细胞相似的迁移和侵袭能力(图3L和3M)。我们的结果表明,hsa_circ_0005358通过序列215-224直接与PTBP1结合来实现功能。
4)hsa_circ_0005358通过与PTBP1结合调控CDCP1的表达
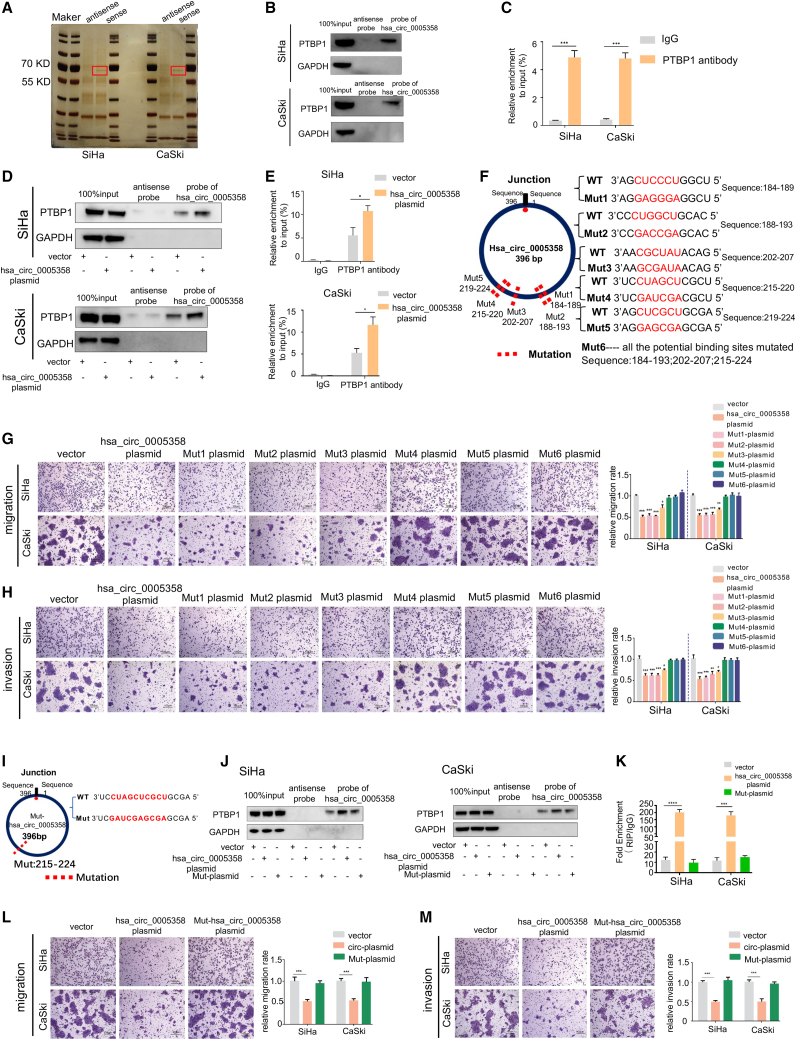
由于hsa_circ_0005358作为诱饵作用于PTBP1,我们对hsa_circ_0005358过表达/未过表达的SiHa细胞和PTBP1沉默/未沉默的SiHa细胞进行了两次 RNA-seq分析。RNA-seq分析获得了99个RNA-seq-1的差异表达转录本和6027个RNA-seq-2的差异表达转录本。RNA-seq-1和RNA-seq-2的重叠进行了分析,并在聚类热图中显示(图4A和图4B)。重叠基因中,有38个在hsa_ circ_0005358过表达和PTBP1沉默的细胞中表达趋势相似。我们根据报道的这些基因的功能,进一步减少候选基因的数量,并选择15个基因在SiHa和CaSki细胞中进行qRT-PCR进一步验证(图4C和4D)。LAMC2、CDCP1和SYTL2这三种mRNA的表达在过表达hsa_circ_0005358或沉默PTBP1的SiHa和CaSki细胞中均显示出一致的变化趋势(图4E)。接下来,我们检测了三种蛋白的表达,发现CDCP1蛋白在过表达hsa_circ_0005358或沉默PTBP1的SiHa和CaSki细胞中的表达量比其他两种蛋白的表达量下降更明显(图4F)。结果提示hsa_circ_0005358和PTBP1共同调控CDCP1的表达。
我们同时在SiHa和CaSki细胞中上调hsa_circ_0005358和CDCP1的表达,发现hsa_circ_0005358过表达导致两种细胞株的迁移和侵袭率降低,而CDCP1的上调抵消了这些影响(图4G-4I)。此外,我们想知道hsa_circ_0005358是否以PTBP1依赖的方式调控CDCP1的表达。Mut-hsa_circ_0005358的过表达与CDCP1的表达水平类似于载体组(图4J)。结合Mut-hsa_circ_0005358的表型,如图3L和3M所示,这些结果表明上调的hsa_circ_0005358通过与PTBP1结合抑制CDCP1的表达,从而减弱宫颈癌细胞的侵袭性转移行为。
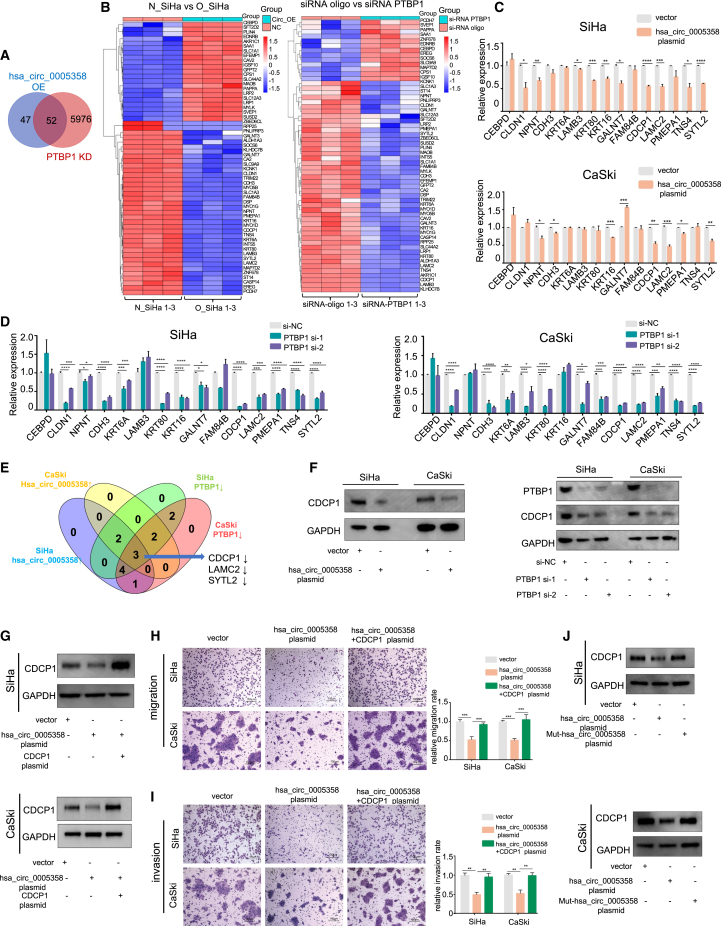
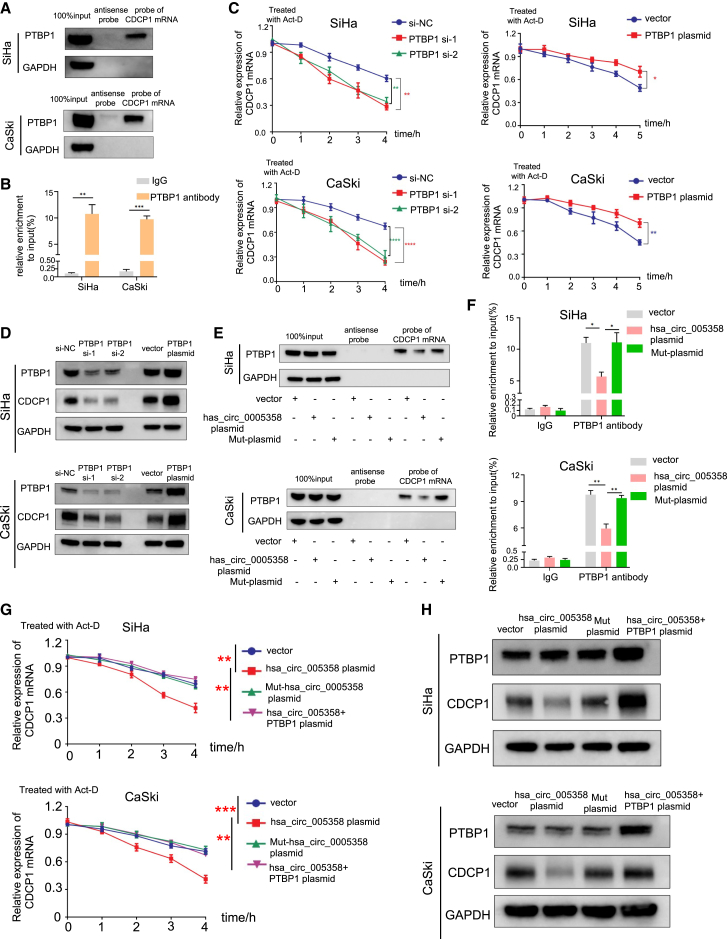
5)hsa_circ_0005358阻止PTBP1与CDCP1 mRNA结合并使其稳定
考虑到在我们的RNA-seq分析中,PTBP1基因的下调抑制了CDCP1 mRNA的表达,而Clip-seq数据库暗示PTBP1直接与CDCP1 mRNA结合,我们推断,PTBP1与CDCP1 mRNA的结合可能增强了CDCP1 mRNA的稳定性。下拉试验和RIP试验验证了在SiHa和CaSki细胞中PTBP1与CDCP1 mRNA结合(图5A和5B)。接着,我们使用Act-D检测SiHa和CaSki细胞中CDCP1 mRNA水平的衰减率。qRT-PCR检测结果显示,与对照组相比,在SiHa和CaSki细胞中,PTBP1基因下调加速了内源性CDCP1 mRNA的降解,降低了CDCP1蛋白水平,而PTBP1基因上调则相反(图5C和5D)。结果表明,PTBP1结合并稳定CDCP1 mRNA,从而提高CDCP1蛋白的表达。下拉试验和RIP试验表明,hsa_circ_0005358的过表达,而不是Mut-hsa_circ_005358的过表达,减少了CDCP1 mRNA对PTBP1的招募(图5E),降低了PTBP1抗体富集的CDCP1 mRNA水平(图5F),表明hsa_circ_0005358阻断了PTBP1与CDCP1 mRNA的结合。接下来我们检测Act-D处理后不同条件下CDCP1 mRNA的表达情况。如图5G和图5H所示,hsa_circ_0005358过表达,而不是Mut-hsa_circ_0005358过表达,加速了CDCP1 mRNA的衰减和蛋白合成的减速,hsa_circ_0005358和PTBP1共转染逆转了这一趋势。综上所述,hsa_circ_0005358抑制了PTBP1与CDCP1 mRNA的结合和稳定,从而降低了CDCP1蛋白水平。
结论:在宫颈癌中,circRNA hsa_-circ_0005358的恢复阻碍了PTBP1与CDCP1 mRNA的结合和稳定,导致CDCP1下调和肿瘤转移抑制。我们的发现揭示了一种新的肿瘤转移机制,这可能为转移性宫颈癌患者提供一种潜在的治疗方法。
参考文献:Cen Y, Zhu T, Zhang Y, Zhao L, Zhu J, Wang L, Xu J, Ding T, Xie X, Wang X, Lu W. hsa_circ_0005358 suppresses cervical cancer metastasis by interacting with PTBP1 protein to destabilize CDCP1 mRNA. Mol Ther Nucleic Acids. 2021 Nov 29;27:227-240. doi: 10.1016/j.omtn.2021.11.020. PMID: 34976440; PMCID: PMC8693350.






