CST6蛋白和多肽抑制乳腺癌骨转移
骨转移是乳腺癌的常见症状,目前的靶向治疗效果有限。破骨细胞在促进骨溶解和肿瘤细胞的转移生长中起着关键作用。此前,我们发现CST6是骨转移性乳腺癌细胞中显著下调的分泌蛋白。功能分析显示CST6在动物模型中具有抑制乳腺骨转移的作用。然而,CST6在骨转移中的作用机制和治疗潜力尚不清楚。我们研究发现CST6通过抑制破骨细胞的生成来抑制骨溶解性转移。癌细胞来源的CST6通过内吞作用进入破骨细胞,抑制半胱氨酸蛋白酶CTSB,导致CTSB水解底物SPHK1上调。SPHK1通过抑制RANKL诱导的p38激活来抑制破骨细胞的成熟。重组CST6蛋白在体内和体外均能有效抑制骨转移。我们进一步鉴定了几种模仿CST6功能的肽段,以抑制癌细胞诱导的破骨细胞形成和骨转移。CTS6重组蛋白和多肽的临床前分析证实了它们在乳腺癌骨转移治疗中的潜力。本文于2021年10月发表在“Theranostics”(IF: 11.556)期刊上。
技术路线

结果
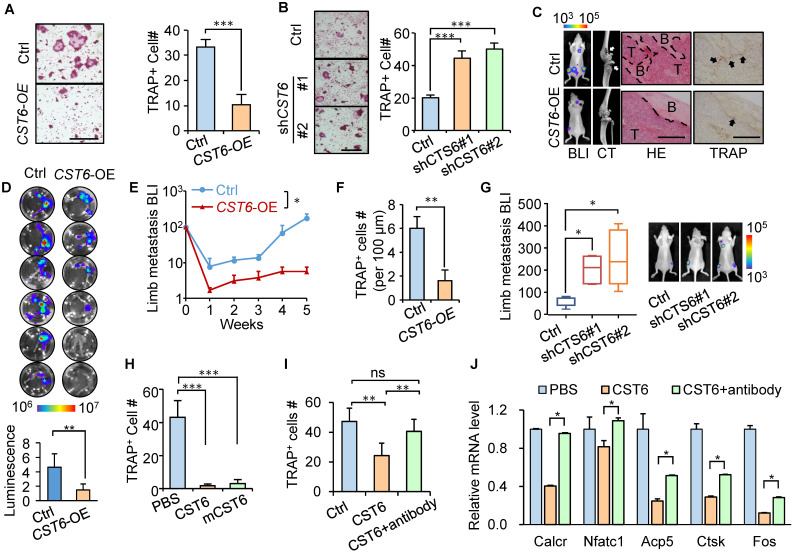
1)CST6抑制乳腺癌细胞的破骨细胞形成和骨定植
之前我们发现CST6抑制乳腺癌骨转移,并观察到在表达CST6的癌细胞引起的转移中破骨细胞的减少。为了进一步评估肿瘤来源的CST6对破骨细胞形成的影响,CST6在SCP2中过表达。TRAP染色显示,CST6过表达大大降低了CM诱导的骨髓细胞破骨细胞的成熟(图1A)。相反,敲除CST6增强SCP4 CM诱导骨髓细胞破骨细胞发生的能力(图1B)。重要的是,通过将这些癌细胞心内注射到小鼠体内的异种移植瘤转移分析显示,CST6显著减少了肿瘤-骨界面上TRAP+破骨细胞的数量,抑制了骨基质的破坏,导致骨转移的抑制(图1C-G)。这些数据验证了肿瘤来源的CST6在骨微环境中调节骨转移的破骨细胞的作用。
为了阐明细胞外CST6调控破骨细胞的直接细胞靶点,我们表达和纯化了人CST6重组蛋白,然后用含有CST6蛋白的RANKL培养基培养小鼠骨髓细胞,进行破骨细胞生成实验。结果显示,人重组CST6显著抑制RANKL诱导的骨髓细胞向破骨细胞的分化,且呈剂量依赖关系(图1H)。小鼠重组CST6蛋白对破骨细胞的发生也有类似的抑制作用(图1H)。我们进一步使用破骨前细胞RAW264.7细胞株进行破骨细胞生成分析,并观察重组CST6蛋白对细胞破骨分化的抑制作用(图1I)。一些破骨细胞分化的标记基因,包括Caclr, Nfatc1, Acp5, Ctsk和Fos,也被CST6下调(图1J)。此外,重组CST6对破骨细胞生成的抑制可以被CST6中和抗体挽救(图1I, J)。总的来说,这些数据表明CST6直接靶向破骨细胞谱系的细胞,而不是肿瘤细胞,以调节破骨细胞的发生。
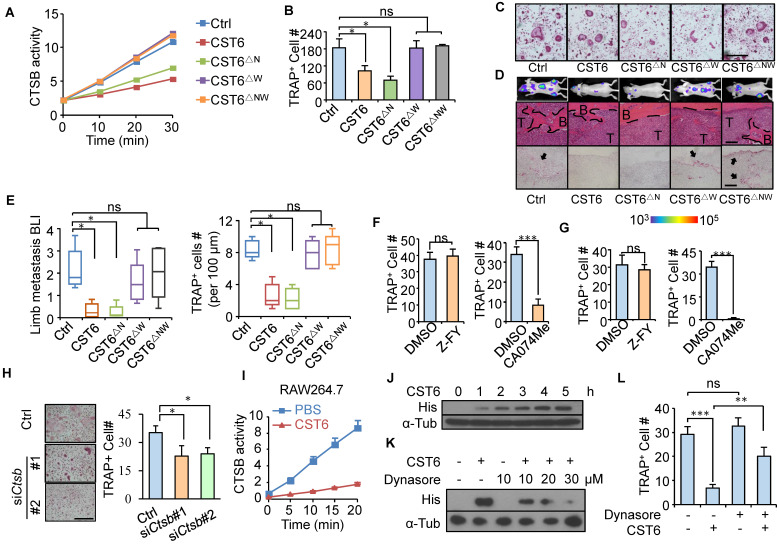
2)CST6抑制CTSB酶活性抑制破骨细胞
为了研究CST6调控破骨细胞生成的蛋白酶靶标,我们克隆了CST6蛋白的点突变N64A (CST6△N)和W135A (CST6△W)。酶活性测定证实,CST6△N和CST6△W分别只能抑制组织蛋白酶和LGMN,而双突变体CST6△NW对蛋白酶均无抑制作用(图2A)。值得注意的是,CST6△N和CST6△NW完全失去抑制破骨细胞生成能力,而CST6△N抑制破骨细胞的成熟(图2B, C)。体内转移研究还表明,W135A突变,但不是N64A突变减少CST6对破骨细胞和骨转移的抑制作用(图2D,E)。进一步,我们发现选择性的CTSB抑制剂CA-074Me能够抑制原代骨髓细胞和RAW264.7细胞的破骨细胞分化(图2F, G)。此外,用siRNA在小鼠原代骨髓细胞中敲除CTSB也显著抑制破骨细胞的发生(图2H)。综上所述,CTSB抑制可介导CST6在破骨细胞形成中的作用。
组织蛋白酶是溶酶体蛋白酶,在酸性环境中仅在细胞内起作用。为了验证胞外来源的CST6对破骨细胞胞内CTSB活性有抑制作用,将RAW264.7细胞置于含重组CST6蛋白的培养基中培养。结果表明,CST6处理确实抑制了RAW264.7细胞内的CTSB活性(图2I)。更重要的是,在细胞外处理CST6后,观察到CST6蛋白在RAW264.7细胞内逐渐积累(图2J)。用内吞抑制剂Dynasore处理RAW264.7后,CST6在细胞内的积累呈剂量依赖性(图2K)。内吞抑制也挽救了CST6抑制的RAW264.7细胞的破骨细胞发生(图2L)。这些结果提示细胞外CST6蛋白可通过内吞作用被破骨前期细胞内化,抑制CTSB和破骨细胞分化。
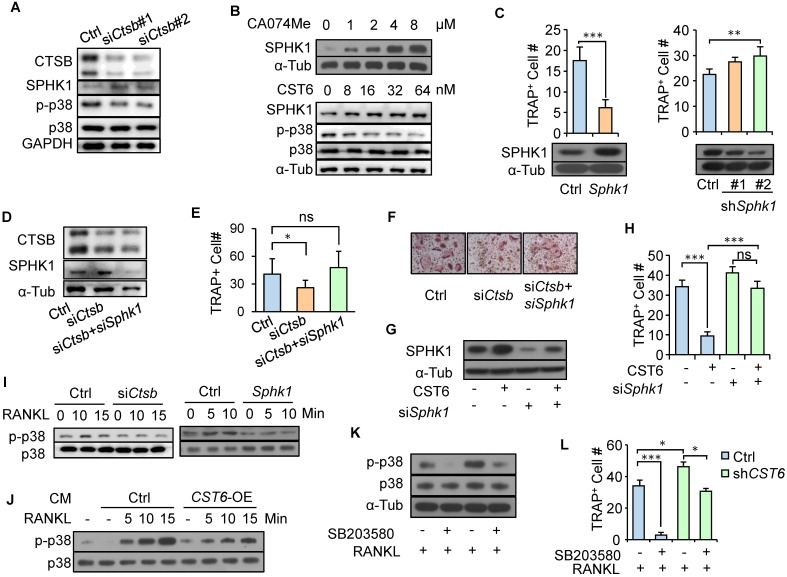
3)CST6在破骨细胞中稳定SPHK1并抑制p38
为了进一步阐明CTSB在破骨细胞调控中的下游机制,我们搜索了肽酶数据库MEROPS,发现SPHK1是CTSB的底物之一。我们观察到CTSB敲除增加了SPHK1在原代骨髓细胞中的表达(图3A)。用CST6蛋白或CTSB抑制剂CA-074Me处理RAW264.7细胞或以剂量依赖的方式稳定细胞内SPHK1蛋白(图3B)。在RAW264.7中过表达SPHK1显著抑制细胞向破骨细胞的分化,而敲低SPHK1则表现出相反的效果(图3C)。值得注意的是,在原代骨髓细胞中同时敲除SPHK1和CTSB(图3D)可以逆转CTSB抑制引起的破骨细胞发生的抑制(图3E, F)。同样,敲除SPHK1也可以恢复被重组CST6抑制的RAW264.7的破骨细胞发生(图3G,图3H)。这些结果表明CST6通过上调SPHK1来抑制破骨细胞的发生。
先前的研究表明,RANKL诱导的p38信号通路激活对破骨细胞的成熟至关重要,SPHK1使p38失活。我们观察到RANKL处理导致破骨前期细胞的p38磷酸化,而CTSB敲除和SPHK1在破骨前期细胞中的过表达阻断了RANKL的这种作用,抑制了p38磷酸化(图3I)。此外,用CST6过表达癌细胞的CM处理破骨前期细胞也降低了破骨前期细胞中RANKL诱导的p38磷酸化(图3J)。为了进一步验证p38信号通路在CST6抑制破骨细胞发生中的作用,我们使用p38抑制剂SB203580治疗在癌细胞CM中培养的RAW264.7细胞。我们发现,在癌细胞中敲除CST6可以增强CM诱导的p38磷酸化和RAW264.7破骨细胞的成熟,而SB203580处理则表现出相反的效果(图3K, L)。综合来看,我们的数据表明,CST6可以抑制CTSB的活性并稳定SPHK1,导致p38活化和破骨细胞成熟的抑制。
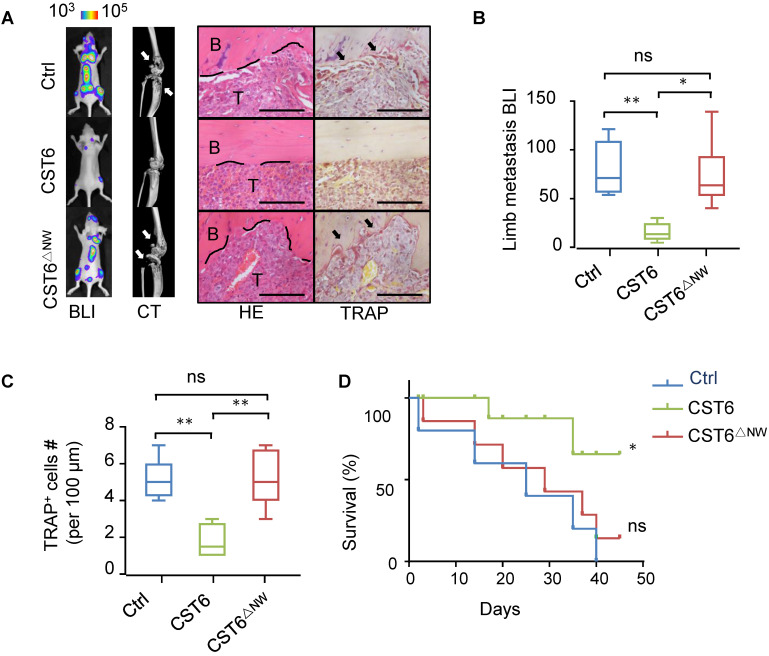
4)重组CST6蛋白抑制乳腺癌骨转移
我们检测了重组CST6蛋白是否可以用于治疗乳腺癌骨转移。裸鼠预先接种SCP2癌细胞,每天静脉滴注1 mg/kg重组CST6蛋白。以重组突变蛋白CST6△NW为阴性对照。CST6治疗可有效缓解小鼠骨转移(图4A,B),减少破骨细胞生成和骨破坏(图4A,C),延长小鼠生存(图4D)。这些数据为CST6作为一种蛋白质药物治疗骨转移性疾病的潜力提供了论据。
5)CST6多肽抑制破骨细胞形成和乳腺癌骨转移
多肽具有广阔的临床应用前景。因此,我们想要筛选更小分子尺寸的模拟CST6的肽段作为骨转移的候选药物。我们设计了一系列不同长度的多肽。我们发现分别为86和51个氨基酸长度的两个含QLVAG的多肽GQ86和DQ51对CTSB有显著抑制作用(图5A),并且抑制骨髓细胞的破骨细胞形成,并具有与全长CST6蛋白相似的剂量依赖性作用(图5B)。此外,这些重组蛋白和肽的破骨抑制性能与唑来膦酸相似或优于唑来膦酸(图5B)。接着,我们进一步评估了多肽在小鼠体内抑制SCP2细胞骨转移的作用。GQ86和DQ51在1 mg/kg的处理浓度下均能显著抑制骨转移和破骨细胞成熟,其效果与全长CST6相似(图5C-E)。多肽治疗也恢复了动物的体重并延长了动物的生存期(图5F, G)。我们进一步将多肽与唑来膦酸和硼替佐米这两种治疗溶骨性骨病变的临床药物进行了比较。数据显示,多肽在抑制骨转移和延长动物生存方面的疗效与这两种药物相似(图5H, I)。
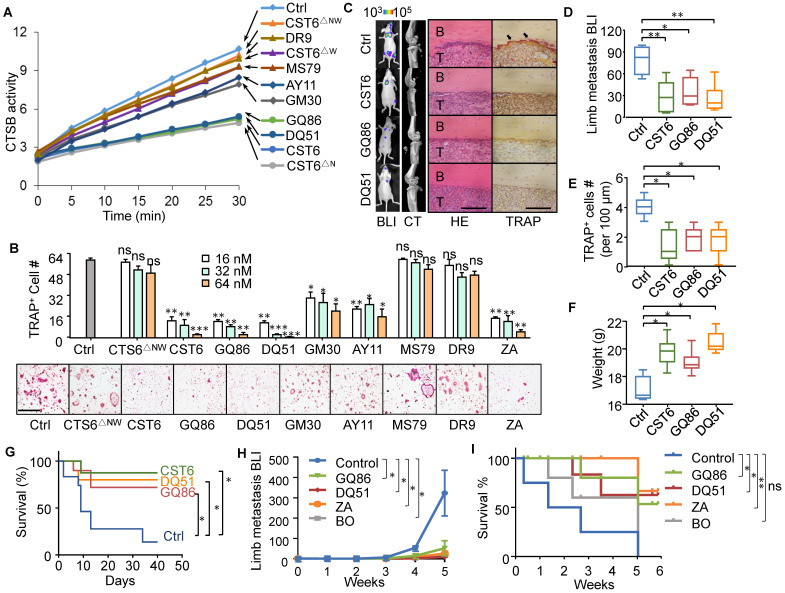
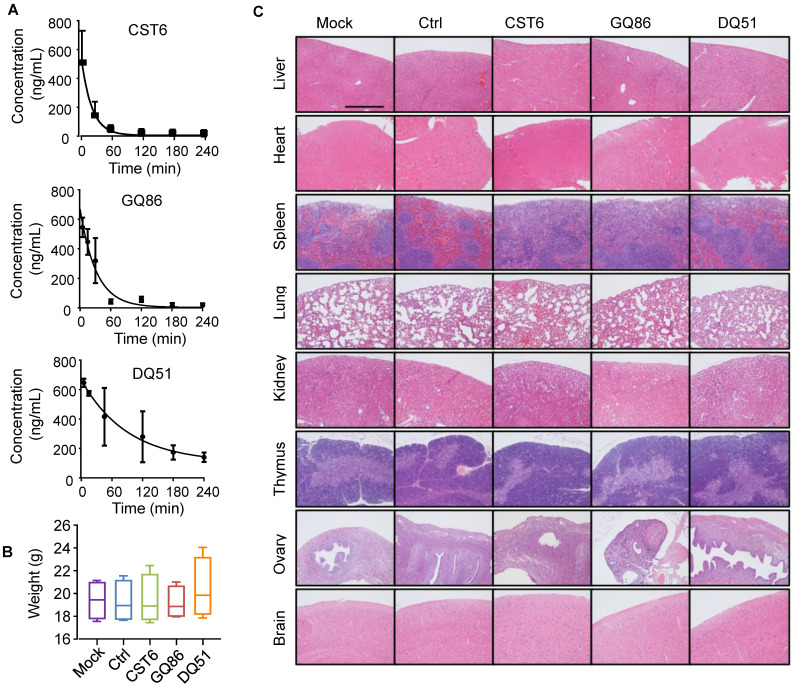
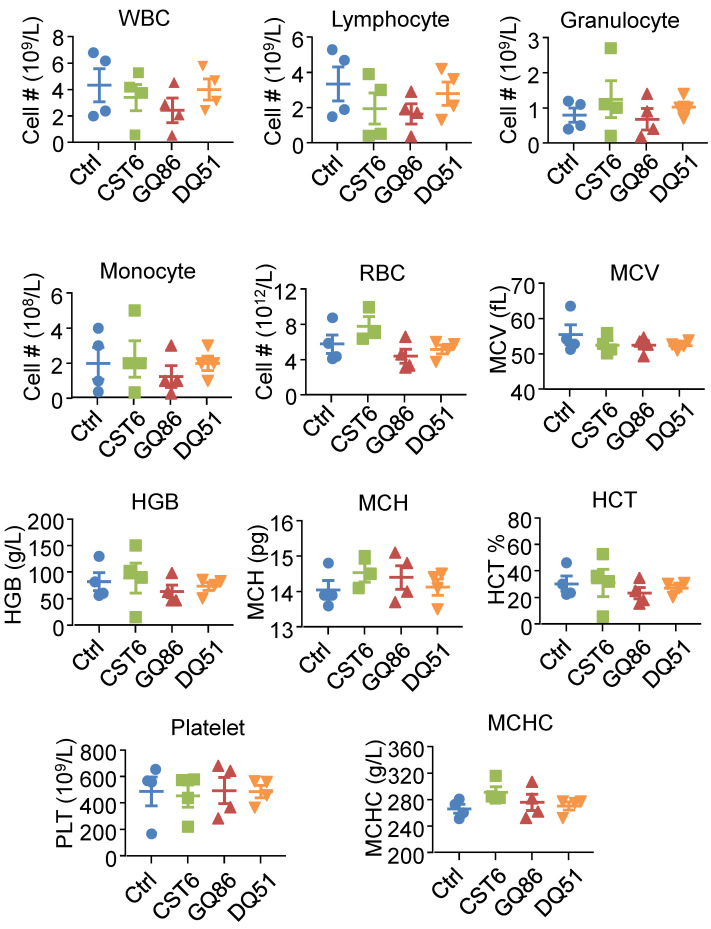
我们对CST6蛋白和多肽进行了药理评价。在小鼠中,DQ51比GQ86和CST6显示出更长的血浆半衰期(图6A)。急性毒性分析显示,DQ51 (250 mg/kg)的最大耐受剂量(MTD)略高于GQ86和CST6 (200 mg/kg)。重要的是,这些候选药物的MTD和中位致死剂量(LD50, 322.00-360.10 mg/kg)均显著高于有效抑制骨转移的剂量(1 mg/kg)。每天静脉注射1 mg/kg剂量的多肽进行慢性毒性评估,4周后动物未见明显异常。治疗后,患者全身和心脏、肝脏、脾脏、肺、肾、肾上腺、胸腺、卵巢、大脑等各器官的重量均无差异(图6B)。这些器官的组织学检查也未见异常(图6C)。血液学分析也显示治疗小鼠基本正常(图7)。这些数据表明CST6和相关肽,特别是DQ51治疗溶骨性骨转移的药物安全性。
结论:CST6-CTSB-SPHK1信号通路在破骨细胞分化中的作用,为利用CST6多肽治疗骨病提供了一个有前途的途径。
参考文献:
Li X, Liang Y, Lian C, Peng F, Xiao Y, He Y, Ma C, Wang Y, Zhang P, Deng Y, Su Y, Luo C, Kong X, Yang Q, Liu T, Hu G. CST6 protein and peptides inhibit breast cancer bone metastasis by suppressing CTSB activity and osteoclastogenesis. Theranostics. 2021 Oct 11;11(20):9821-9832. doi: 10.7150/thno.62187. PMID: 34815788; PMCID: PMC8581426.






