FGF21减轻铁过量引起的肝损伤和纤维化
铁死亡在一些疾病中发挥作用,如铁过量引起的肝脏疾病。铁死亡已成为一种潜在的治疗相关疾病的策略。许多抗氧化剂已被证实可以控制铁死亡,但调控铁死亡的细胞自主机制仍不清楚。在本研究中,我们发现铁过量通过过度诱导HO-1表达促进了肝细胞铁死亡,促进了肝损伤和纤维化的进展,并伴有体外和体内FGF21蛋白水平的上调。重组FGF21和FGF21过表达都能通过抑制铁死亡显著保护铁过量诱导的肝细胞线粒体损伤、肝损伤和纤维化。相反,FGF21的缺失加重了铁过量诱导的铁死亡。值得注意的是,FGF21诱导的HO-1抑制和NRF2激活为这一现象提供了机制解释。综上所述,我们确定FGF21是一种新的铁死亡抑制因子。FGF21激活可能为铁过量诱导的铁死亡相关疾病的潜在治疗提供了一种有效的策略。本文于2021年9月发表在“Redox Biology”(IF: 11.799)期刊上。
技术路线
结果
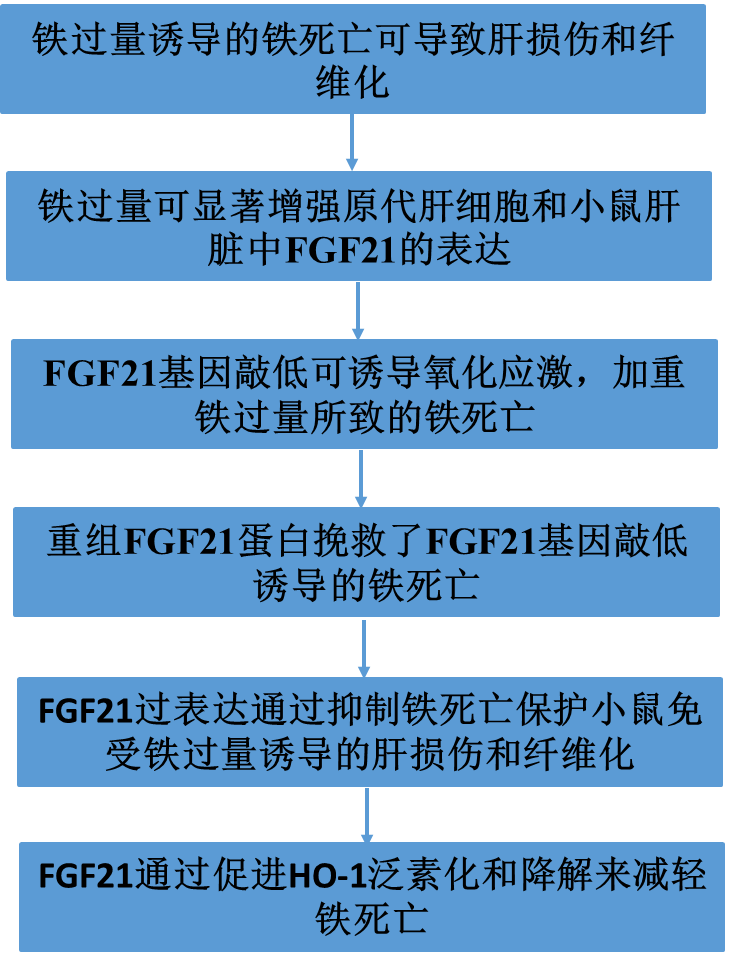
虽然铁是几乎所有生物必需的微量营养素,但其高氧化还原活性可能是活性氧的来源,使铁具有潜在的细胞毒性。右旋糖酐铁注射导致体重下降(图1A),铁在肝脏(图1B)中积累。与对照组相比,右旋糖酐铁注射组的铁代谢相关基因、蛋白和血液学参数明显改变,表现为Hamp1、Fth、Ftl和Fpn表达上调,Tfr1表达下调(图1C)。此外,右旋糖酐铁注射导致肝损伤(图1D和E)和纤维化(图1F)。铁过量可诱导肝脏中羟基自由基(OH.−)、MDA(脂质过氧化产物)和谷胱甘肽(GSH)的积累(图1G-I)。铁过量显著增加了铁死亡相关基因Ptgs2的mRNA表达(图1J)。我们还发现铁过量强烈地抑制了NRF2的磷酸化并降低GPX4蛋白的表达水平,可能导致原代肝细胞和小鼠肝脏中ROS清除能力受损(图1K)。相比之下,铁过量显著上调了原代肝细胞和小鼠肝脏中的SLC7A11和HO-1蛋白水平(图1K)。这些结果表明铁过量导致铁死亡,这可能导致随后的肝损伤和纤维化。
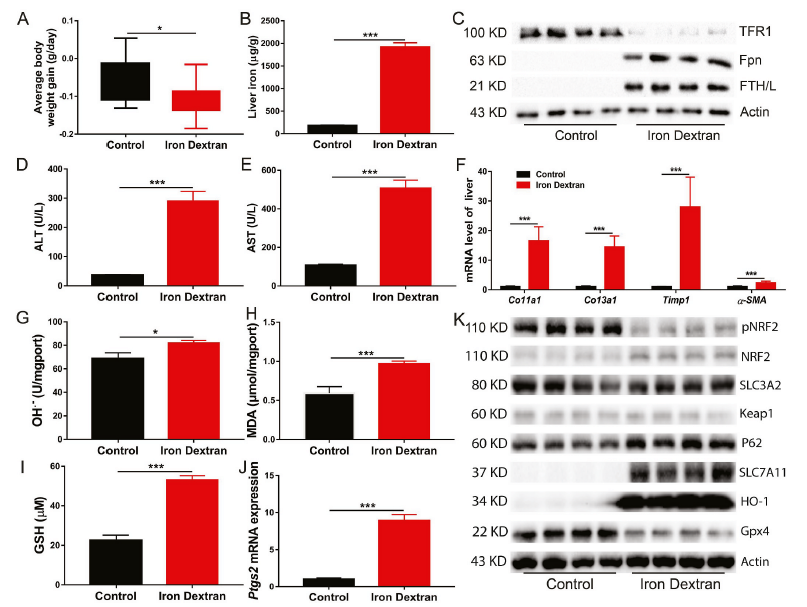
FGF21被认为是一种缓解氧化应激的因子。因此,在铁过量条件下,我们检测了原代肝细胞和小鼠肝脏中FGF21的mRNA和蛋白水平。100 μM或1000 μM FAC处理原代肝细胞24 h后,与对照组相比,FGF21 mRNA和蛋白表达水平显著升高(图2A-C)。与体外实验结果一致的是,铁过量显著增强了右旋糖酐铁注射小鼠肝脏中FGF21蛋白的表达(图2D)。
为了确定FGF21激活在铁过量诱导的铁死亡中的作用,将FGF21重组蛋白添加到添加了1000 μM FAC的原代肝细胞培养基中。研究发现,与单独的FAC处理相比,FGF21处理进一步上调了Fpn、Fth和Ftl的mRNA表达。此外,FGF21的添加挽救了铁过量导致的Nrf2和Gpx4 mRNA表达的下降(图2E)。FGF21下调铁过量诱导的铁死亡相关基因Ptgs2的mRNA表达(图2E)。这些结果表明FGF21可能通过改变细胞铁代谢和氧化还原平衡来抑制铁死亡。流式细胞术结果证实了这一发现。在FGF21处理的原代肝细胞中,FGF21降低了细胞内LIP、ROS、MDA和脂质过氧化水平,但增加了GSH,这可能有助于抑制铁过量诱导的铁死亡(图2F-J)。此外,与对照组肝细胞相比,FAC处理的肝细胞有更小、破裂的线粒体。通过FGF21治疗,可以完全挽救FAC诱导的线粒体损伤和形态学改变(图2K)。

3)FGF21基因敲低可诱导氧化应激,加重铁过量所致的铁死亡
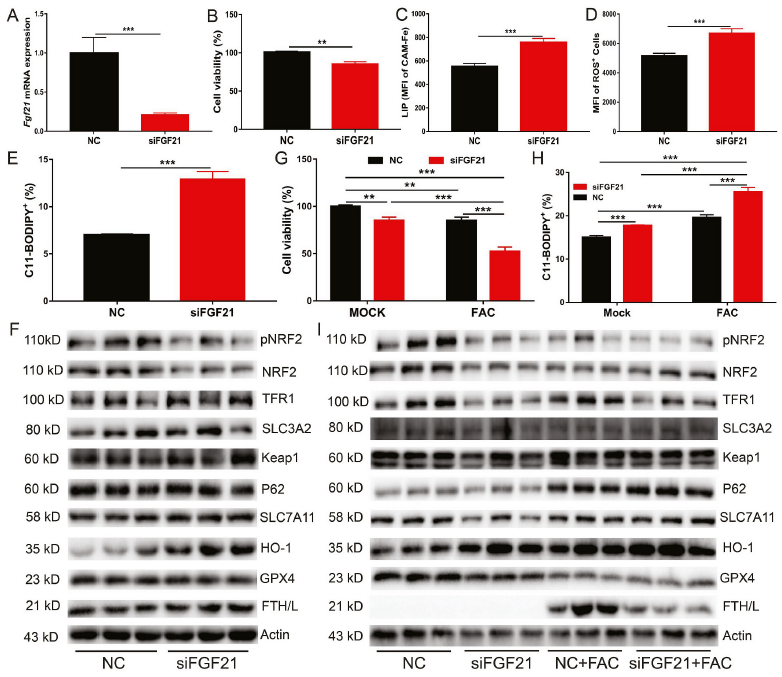
为了进一步阐明FGF21在铁过量诱导的铁死亡中的作用,我们使用FGF21 siRNA下调了原代肝细胞中的FGF21(图3A)。与重组FGF21蛋白处理或腺病毒介导的FGF21过表达相比,FGF21敲低显著损害了细胞活力(图3B),并显著增加了细胞内LIP、ROS和C11-BODIPY水平(图3C-E)。FGF21敲低也抑制NRF2的磷酸化以及NRF2和GPX4的蛋白表达。相比之下,FGF21的敲除显著增加了HO-1蛋白的表达(图3F)。随后,将FGF21敲除的原代肝细胞用1000 μМ FAC处理24小时,发现与对照细胞相比,FGF21敲除细胞的铁死亡增加(图3G和H)。经FAC处理后HO-1蛋白水平进一步升高。然而,在FGF21敲低的原代肝细胞中,添加FAC降低了FTH/L蛋白的表达(图3I)。综上所述,这些结果表明FGF21是一种新的铁死亡抑制因子。
4)重组FGF21蛋白挽救了FGF21基因敲低诱导的铁死亡
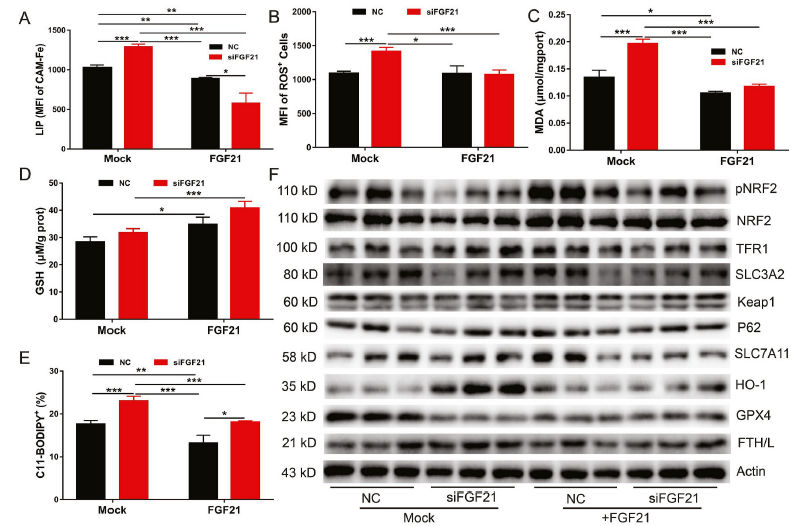
我们采用外源性FGF21治疗研究其是否可以减轻FGF21基因敲低引起的铁死亡。我们将FGF21基因敲低的原代肝细胞用200 ng/ml FGF21重组蛋白处理24 h,然后通过检测LIP、ROS和脂质过氧化(C11-BODIPY)水平来评估肝细胞的铁死。如预期的那样,外源性FGF21治疗完全挽救了FGF21基因敲减引起的铁死亡,降低了细胞内LIP、ROS、脂质过氧化和MDA水平,但增加了GSH(图4A-E)。与我们之前的研究结果一致,FGF21处理增加了正常和FGF21敲低原代肝细胞的NRF2磷酸化和总NRF2蛋白水平。有趣的是,外源性FGF21治疗可以逆转FGF21敲低的原代肝细胞HO-1蛋白水平的升高(图4F)。
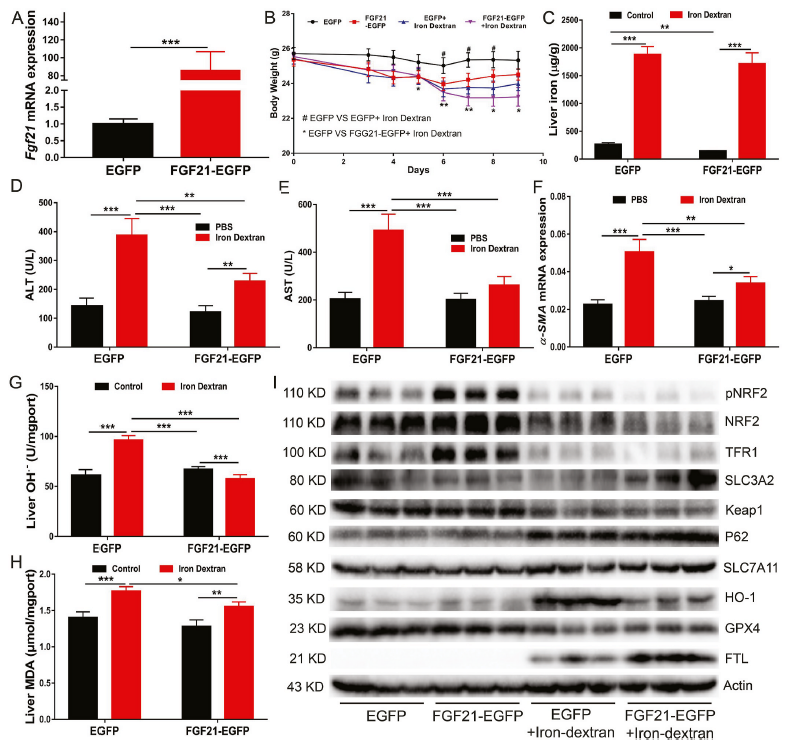
5)FGF21过表达通过抑制铁死亡保护小鼠免受铁过量诱导的肝损伤和纤维化
为了进一步阐明FGF21在铁过量诱导的铁死亡中的作用,我们利用重组腺病毒表达系统构建了肝脏中过表达FGF21的小鼠模型。与对照组相比,FGF21过表达小鼠的肝脏中FGF21 mRNA水平大约增加了80倍(图5A)。FGF21过表达减弱铁过量诱导的体重减轻(图5B)。出乎意料的是,与给予PBS的EGFP对照组小鼠相比,肝脏FGF21过表达小鼠的血清和肝脏铁含量降低(图5C)。对TFR1蛋白水平(图5I)的评估也显示,FGF21过表达改善了WT小鼠的铁代谢。然而,在给予右旋糖酐铁后,WT和过表达FGF21小鼠之间的铁代谢差异消失了(图5C)。随后,研究发现FGF21过表达可降低铁过量小鼠的血清ALT和AST水平(图5D和E),并减轻肝损伤和纤维化(图5F)。此外,FGF21过表达也降低了肝脏中的OH-和MDA水平(图5G和H)。肝脏中FGF21过表达降低了PBS给药小鼠HO-1的表达,增加了FTH/L的表达(图5 I)。这些结果表明FGF21过表达可以通过抑制WT小鼠的铁死亡来保护小鼠免于铁过量诱导的肝损伤和纤维化。
6)FGF21通过促进HO-1泛素化和降解来减轻铁死亡
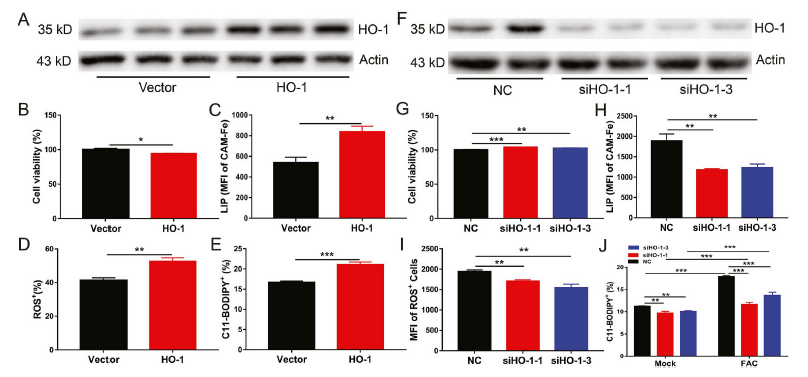
为了阐明FGF21介导的HO-1抑制在肝细胞保护铁死亡的作用,我们将表达HO-1的质粒转染原代肝细胞(图6A)。HO-1过表达可增加细胞死亡和细胞内LIP、ROS和脂质过氧化水平(图6B-E)。与此观察相一致的是,即使在铁过量的情况下,HO-1敲低也能降低原代肝细胞铁死亡和细胞内LIP、ROS和脂质过氧化水平(图6F-J)。这些结果表明HO-1是肝细胞内铁死亡的激活因子。
为了揭示FGF21调控HO-1蛋白水平的潜在机制,我们分析了FGF21过表达小鼠的肝脏(图7A)和FGF21处理的原代肝细胞(图7B)中HO-1 mRNA的表达水平。FGF21没有改变HO-1 mRNA的表达水平,表明FGF21以转录独立的方式抑制HO-1的表达。接下来,我们使用氯己亚胺(CHX,一种化学蛋白合成抑制剂)来评估FGF21介导的HO- 1蛋白表达下调的转录独立机制。研究发现FGF21影响HO-1蛋白的稳定性,FGF21的处理缩短了HO-1的半衰期,从而加速了其降解(图7C)。随后,FGF21也被发现促进HO-1泛素化。与载体对照相比,FGF21过表达增加了HEK293T细胞中HA标记的HO-1蛋白的泛素化(图7D)。综上所述,这些发现表明FGF21通过促进HO-1的泛素化和降解来减弱铁过量诱导的铁死亡。
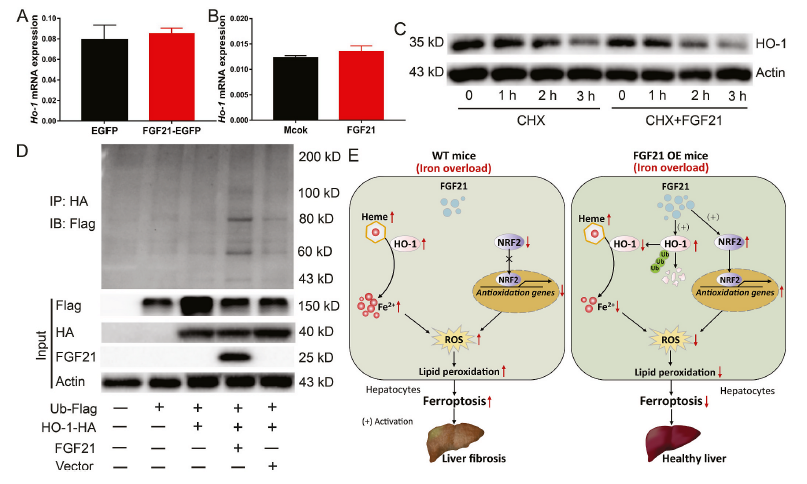
结论:构成性HO-1活化是铁过量诱导肝细胞铁死亡的一种新介质,FGF21可以通过刺激HO-1泛素化和随后的降解来保护肝细胞免受铁过量诱导的铁死亡。FGF21-HO-1途径可用于治疗铁过量诱导的铁死亡相关疾病。
参考文献:
Wu A, Feng B, Yu J, Yan L, Che L, Zhuo Y, Luo Y, Yu B, Wu D, Chen D. Fibroblast growth factor 21 attenuates iron overload-induced liver injury and fibrosis by inhibiting ferroptosis. Redox Biol. 2021 Oct;46:102131. doi: 10.1016/j.redox.2021.102131. Epub 2021 Sep 11. PMID: 34530349; PMCID: PMC8445902.






