TNF-α介导的ELMO1 m6A修饰引发强直性脊柱炎间充质干细胞的定向迁移
强直性脊柱炎(AS)是一种常见的风湿性疾病,间充质干细胞(Mesenchymal stem cells, MSC)是在体内发现的一种多能成体干细胞。AS患者的间质干细胞 (AS-MSC)导致了病态的成骨和韧带联合形成。本文中,作者阐明了TNF-α能介导ELMO1表达,在脊椎关节炎的治疗中发挥积极作用。本文于2021年5月发表在《 Nature communications》杂志上IF=12.121。
技术路线:

1.TNF-α诱导AS-MSC体外定向迁移
从15名AS患者中分离出活动期的间质干细胞(AS-MSC),从15名年龄和性别相匹配的健康供体中获得HC-MSC。之前的研究表明,AS-MSC增强单核细胞迁移,增加促炎巨噬细胞极化。在本研究中,迁移实验结果显示,当与巨噬细胞共培养时,AS-MSC的迁移数量远远大于HC-MSC(Fig 1a),且这种差异能被TNF-α中和抗体纠正 (Fig 1a)。说明巨噬细胞能通过分泌TNF-α增强AS-MSC的迁移能力。通过100 ng/ml TNF-α处理, AS-MSC迁移数量明显大于HC-MSC。在低浓度TNF-α刺激下,HC-MSC和AS-MSC之间没有观察到差异(0,10,和50 ng / ml) (Fig. 1b)。伤口愈合实验表明,与HC-MSC相比, 100 ng/ml TNF-α处理的AS-MSC迁移面积越大 (Fig. 1c)。通过趋化试验进一步研究研究定向迁移能力。结果显示,AS-MSC比HC-MSC更有可能向TNF-α迁移。AS-MSC的运移指数、速度和方向性均较高于HC-MSC(Fig. 1d)。这些结果表明,相对高浓度的TNF-α可增强体外AS-MSC的定向迁移。
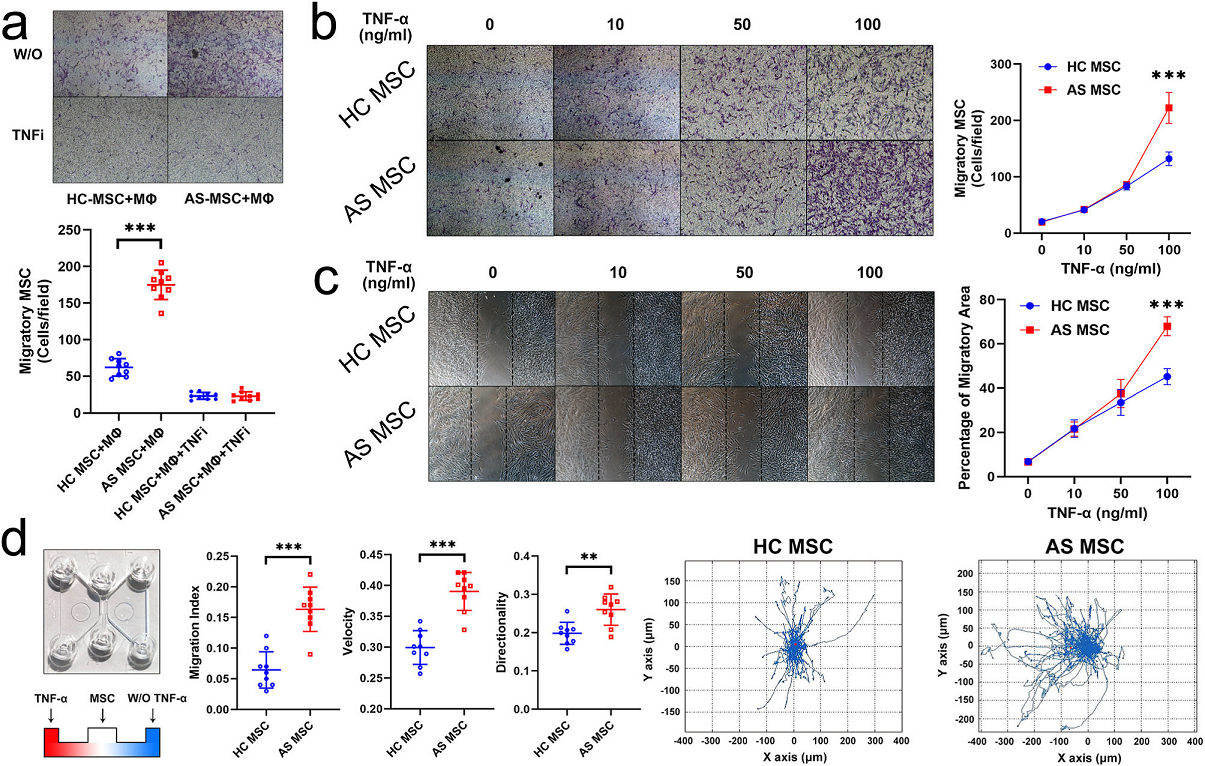
Figure 1.TNF-α诱导AS-MSC体外定向迁移增强
2.TNF-α可加速AS-MSC在体内的定向迁移
为了进一步研究TNF-α是否诱导AS-MSC在体内迁移,作者将MSC/Fluc移植并将TNF-α注射到裸鼠中,随后进行生物发光实验和免疫组化实验(Fig 2a)。从第0天到第5天,MSC的迁移面积逐渐增大。在MSC注射后第3天到第5天,AS-MSC的生物发光面积大于HC-MSC(Fig 2b)。此外,免疫组化分析显示,AS-MSC迁移数量,远远大于HC-MSC(Fig. 2C)。这些结果表明,高浓度TNF-α处理后,AS-MSC在体内的迁移能力强于HC-MSC。
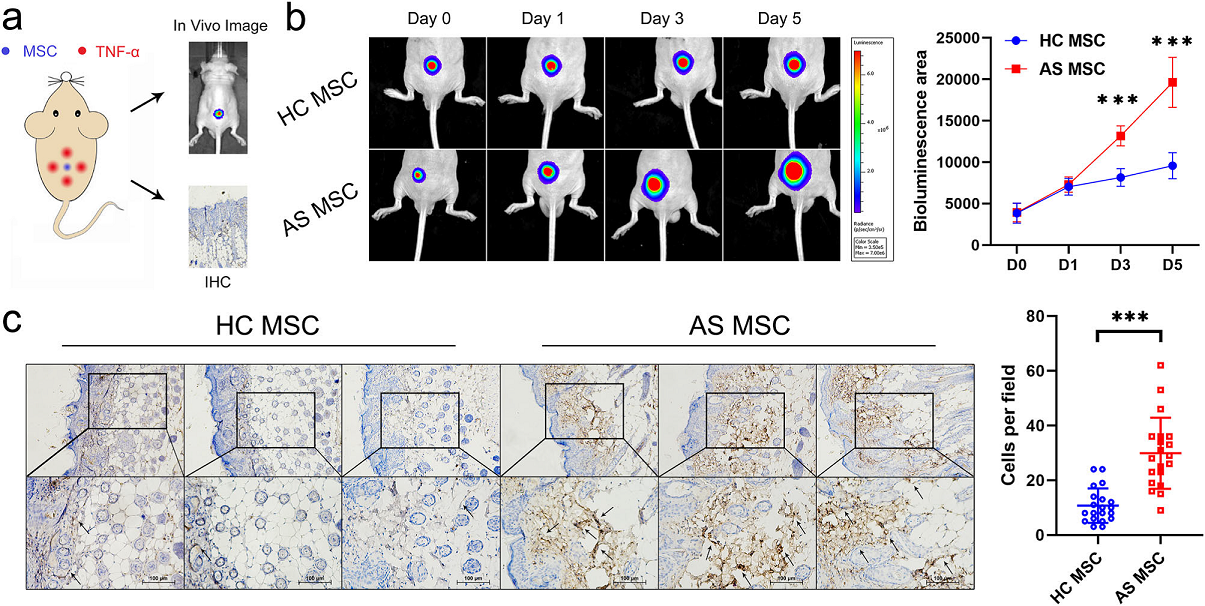
Figure 2. TNF-α可加速AS-MSC在体内的定向迁移
将未经100 ng/ml TNF-Α处理和经过100 ng/ml TNF-α处理的HC-MSC和AS-MSC进行转录组测序。聚类分析显示,是否采用 TNF-α和TNF-α处理的在AS-MSC和HC-MSC之间都观察到显著差异(Fig.3a)。 PCA显示用100ng/ml TNF-α处理的AS-MSC表达谱也与HC-MSC存在显著差异(Fig.3b)。通过维恩图分析,鉴定出489个关键的差异表达mRNA(Fig. 3c)。通过GO分析,发现这489个mRNA在炎症反应、趋化性和生物过程类的趋化因子介导的信号通路中富集,KEGG分析显示,前3位富集途径为“细胞因子-细胞因子受体相互作用”、“趋化因子信号通路”和“细胞粘附分子(Fig. 3d)。进一步研究发现,AS-MSC中ELMO1显著上调,它是趋化因子信号通路的中心交点(Fig. 3e)。PCR结果也与测序数据一致,在TNF-α处理后,MSC中ELMO1的表达增加,TNF-α处理的AS-MSC中ELMO1的表达远高于TNF-α处理的HC-MSC(Fig.3F)。通过western blotting发现蛋白水平上也明显提高 (Fig. 3g)。细胞免疫荧光检测结果表明,TNF-α刺激后AS-MSC的ELMO1荧光强度高于HC-MSC (Fig. 3h)。已有研究发现,ELMO1通过与其他细胞的DOCK蛋白结合,激活Rac1并促进趋化作用。 MSC中活性Rac1水平也随着TNF-α浓度的增加而增强。而AS-MSC中的活性Rac1水平显著高于100 ng/ml TNF-α处理的HC-MSC(Fig.3i)。
此外,通过Co-IP和LC-MS/MS分析鉴定的蛋白-蛋白相互作用,结果表明MSC中的ELMO1主要结合DOCK1、DOCK4、DOCK5、ELMO2和NCKAP1, HC-MSC和AS-MSC中的相互作用也是相同。此外,抑制DOCK1可以抵消因ELMO1过表达而上调的活性Rac1水平,这表明在TNF-α处理的MSC中,ELMO1结合DOCK1促进Rac1活性。
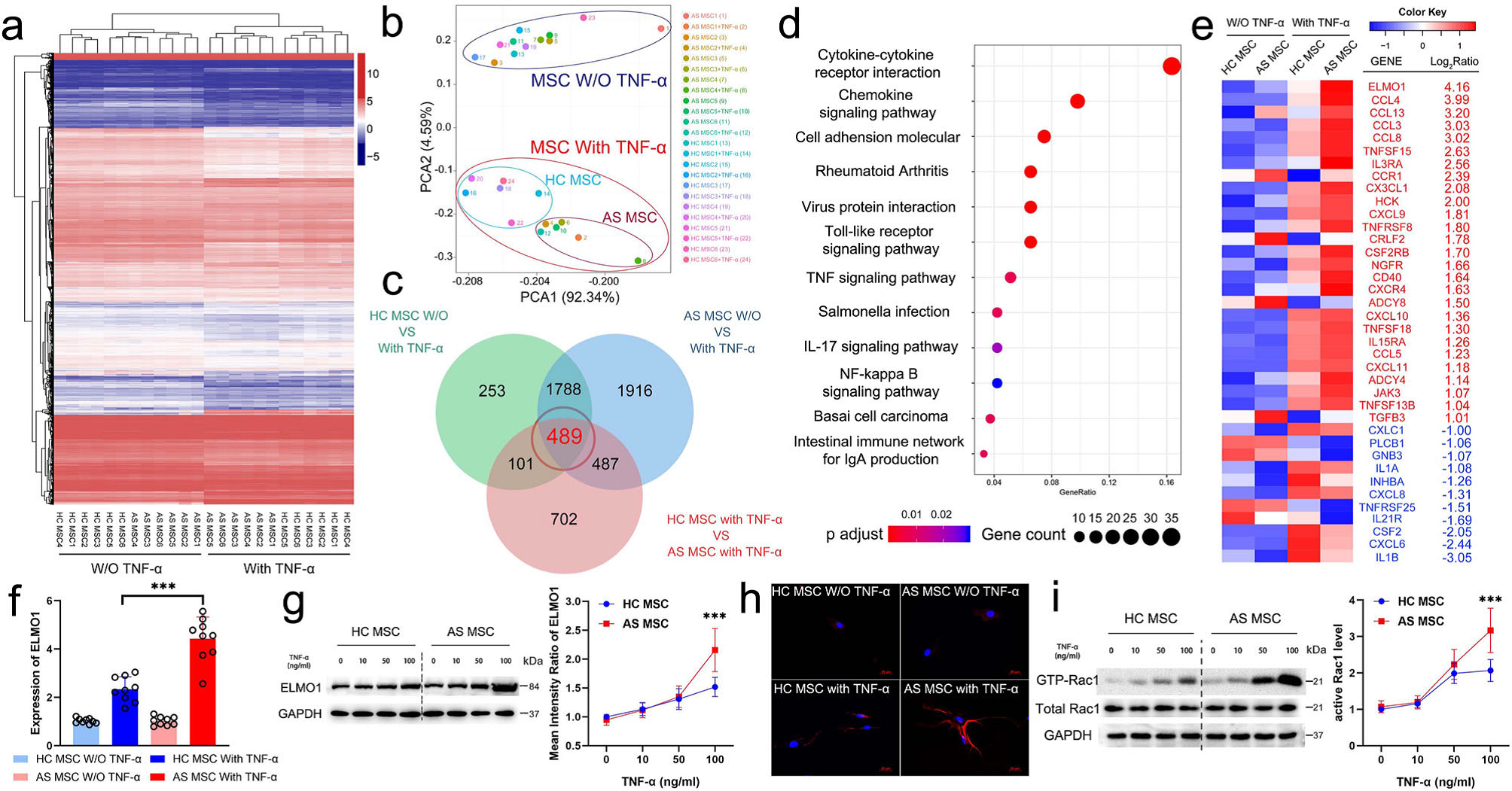
Figure 3. TNF-α导致AS-MSC中ELMO1表达升高
4.TNF-α介导的ELMO1表达促进MSC迁移
在用100 ng/ml TNF-处理的AS-MSC中抑制ELMO1, Transwell实验中迁移细胞数量和创面愈合实验中的迁移面积的结果与HC-MSC相同(Fig. 4a, b)。此外,lv - ELMO1转染的AS-MSC在裸鼠体内的生物发光面积也较lv - NC转染的AS-MSC少,与HC-MSC无差异(Fig.4c)。在经过TNF-α处理的lv - elmo1转染的AS-MSC中,下游活性Rac1水平也明显减弱,达到与TNF-α处理的HC-MSC相同的水平。
作者构建了OE-ELMO1载体,并在基因和蛋白水平上证实了过表达效率,NC组与OE-ELMO1组增殖能力相当。Transwell和伤口愈合实验显示,当ELMO1在HC-MSC中表达增加时,它们的迁移能力在100 ng/ml TNF-α刺激下显著提高,几乎达到AS-MSC的能力。通过对生物发光迁移区域的评价进一步证实了这一结果。与AS-MSC相似,OE-ELMO1转染的HC-MSC活性Rac1水平高于对照组HC-MSC(Fig.4 h)。这些结果表明TNF-α能刺激介导的ELMO1异常上调导致AS-MSC迁移增强。
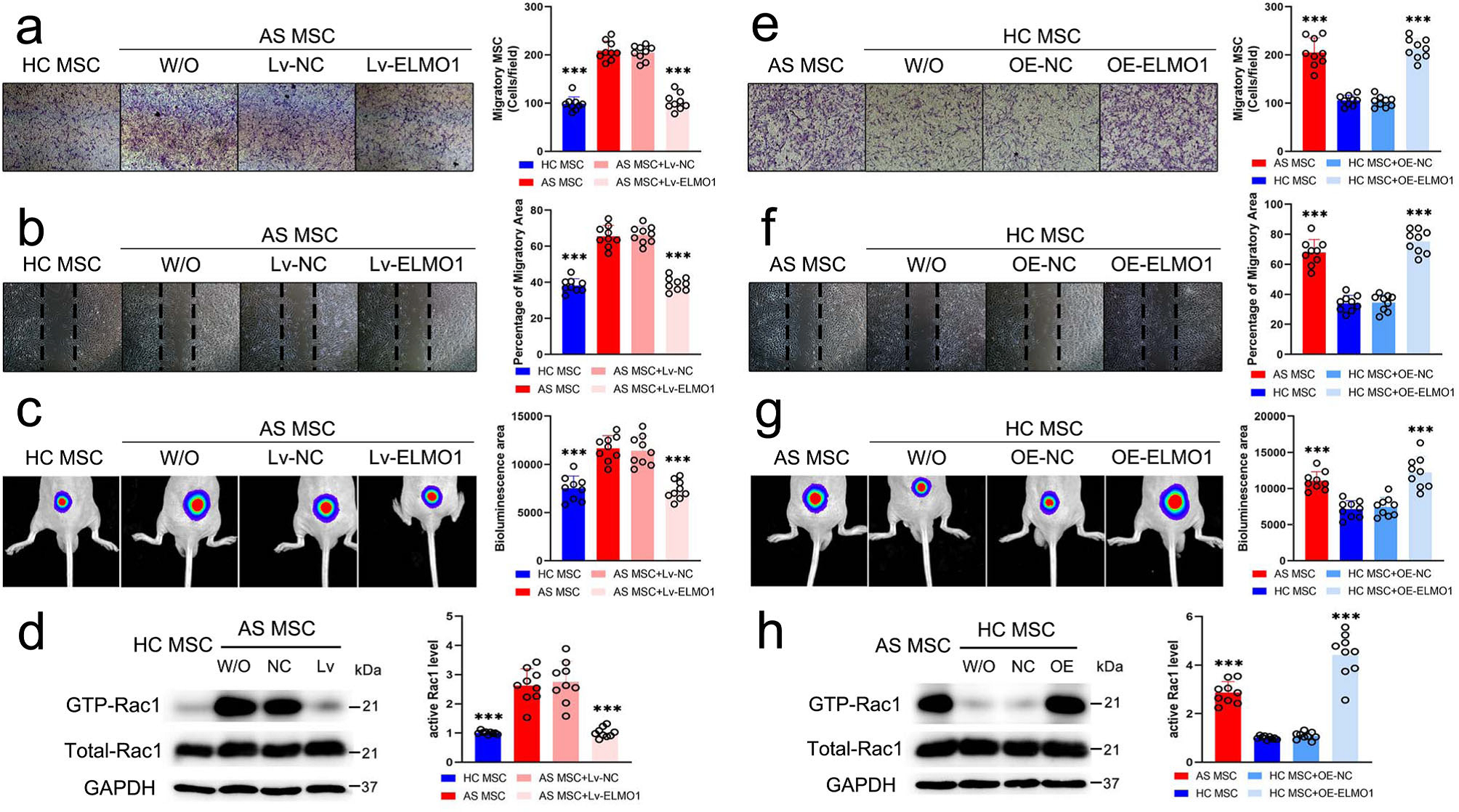
Figure 4. TNF-α介导的ELMO1表达促进MSC迁移
5.ELMO1作为AS的治疗靶点
进一步研究发现,AS小鼠中,CD105+间充质干细胞的ELMO1表达量高于健康对照组(Fig. 5a)。然后对SKG小鼠通过腹腔注射3mg凝胶多糖进行处理,诱导小鼠AS特征,并进行Av-ELMO1治疗。经过Av-ELMO1注射治疗后,与对照组相比,注射组关节炎评分明显降低,发病时间延迟(Fig. 5b,c)。此外,通过监测临床表现、H&E染色和micro-CT观察发现Av-ELMO1组局部炎症和异位骨化异位骨化。观察踝关节局部组织时,观察到Av-ELMO1组CD105+间充质干细胞迁移的数量显著降低。此外,Av-ELMO1组中的SKG小鼠CD68+巨噬细胞的数量和TNF-α表达量降低(Fig. 5g)。
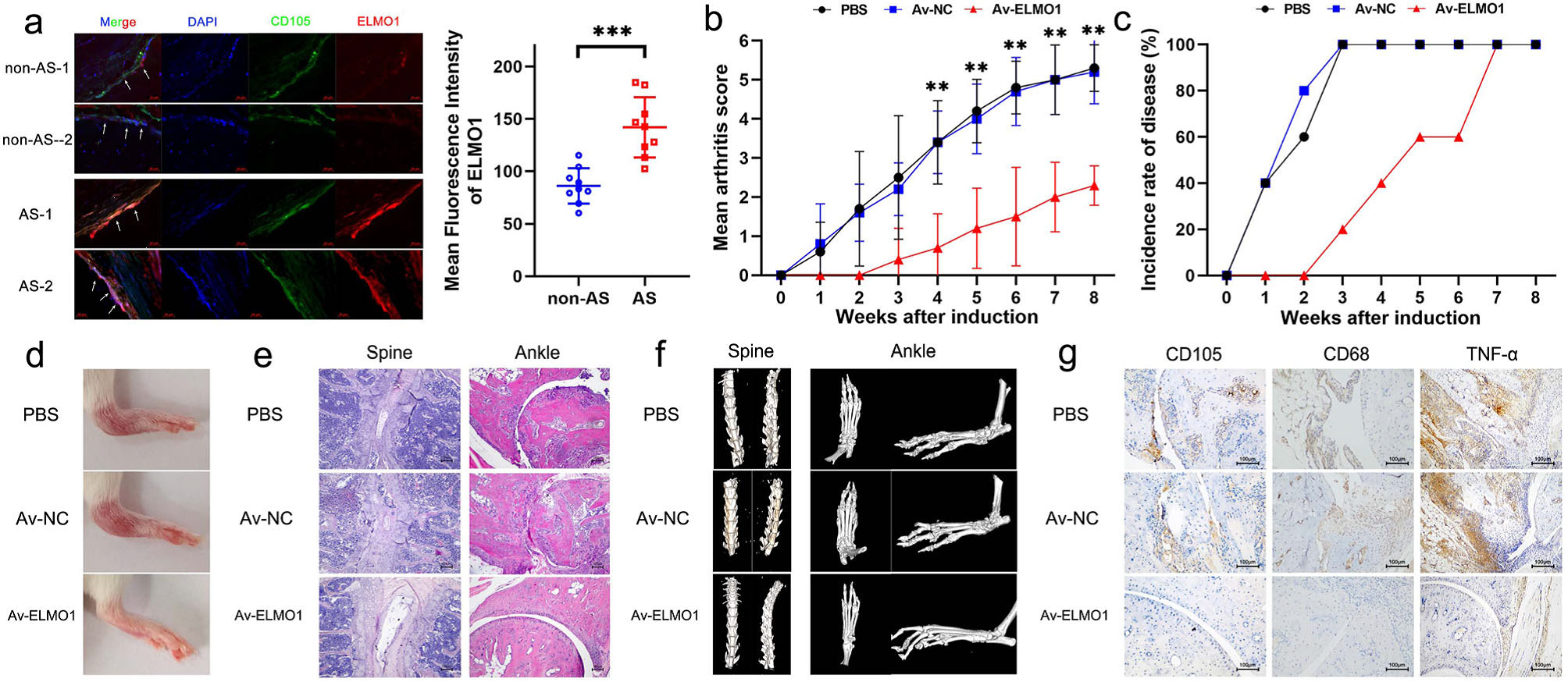
Figure 5. ELMO1作为AS的治疗靶点
6. TNF-α处理AS-MSC样品后, METTL14表达下降进而导致m6A水平降低,ELMO1 RNA降解
已有研究发现m6A修饰可降低mRNA的稳定性及表达。作者发现ELMO1的m6A修饰水平随着TNF-α浓度而改变,经过100 ng/ml TNF-α处理后,AS-MSC中ELMO1 m6A修饰水平远低于HC-MSC(Fig. 6a)。此外,在100 ng/ml TNF-α刺激下,AS-MSC的ELMO1 mRNA半衰期比HC-MSC更长,说明AS-MSC的mRNA稳定性更好(Fig. 6b, c)。
然后检测m6A相关甲基转移酶和去甲基化酶的表达水平。结果表明,TNF-α处理后,METTL 3,ALKBH5和FTO表达增加,METTL14和TNF-α表达降低。当用100 ng/ml TNF-α处理AS-MSC时,METTL14表达低于HC-MSC。而其他与m6a相关的甲基转移酶和去甲基化酶无显著差异(Fig. 6d, e)。与此同时,AS样品中CD105+ MSC中的METTL14表达明显低于健康对照组(Fig. 6f)。这些结果表明,TNF-α会导致AS-MSC中METTL14表达降低,m6A水平下降,ELMO1 RNA降解。
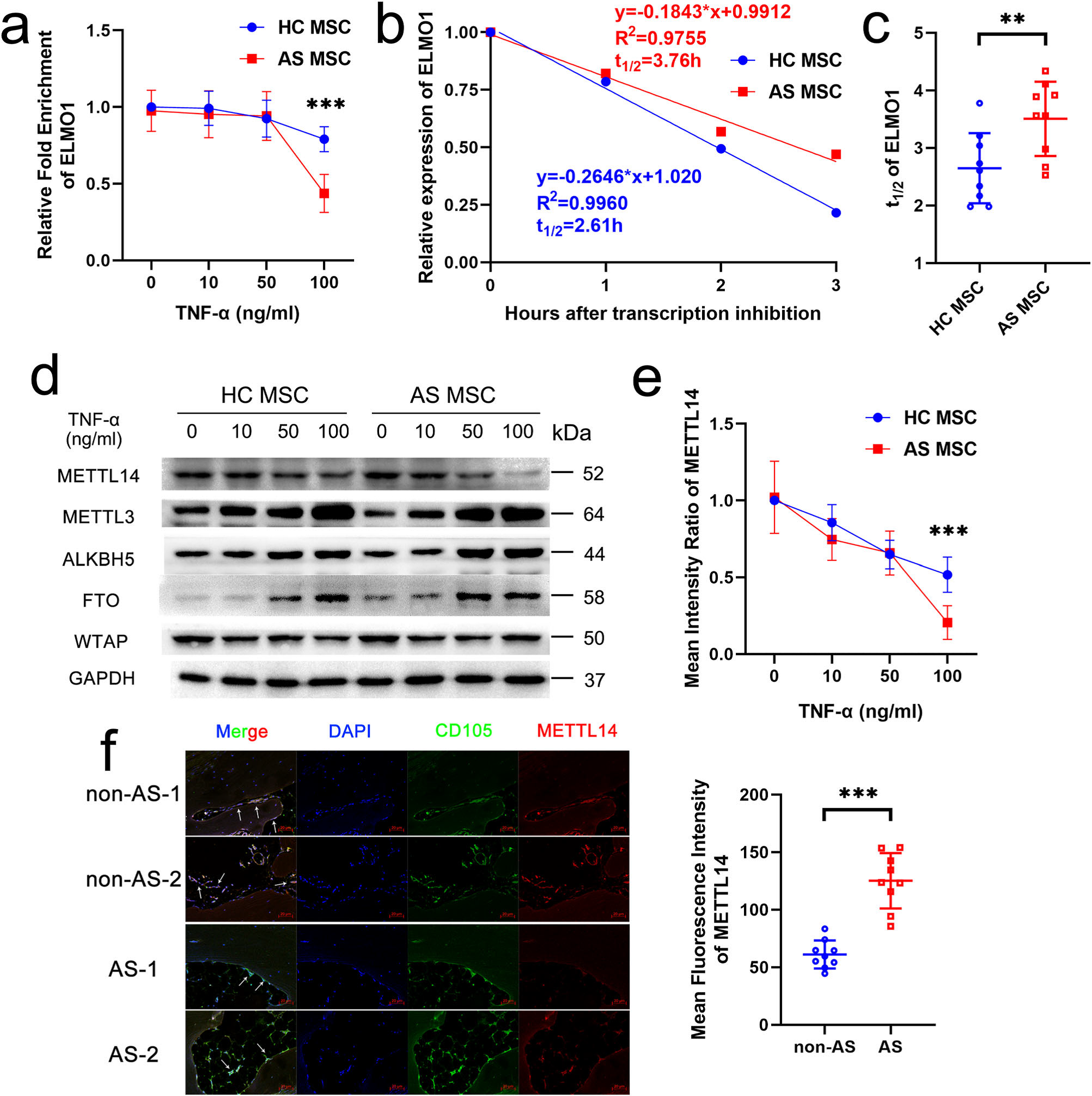
Figure 6在TNF-α处理的AS-MSC中,降低METTL14表达导致ELMO1的m6A修饰和RNA降解降低
7.抑制METTL14表达可增加ELMO1表达,促进MSC定向迁移
作者接下来构建了LV-METTL14载体(LV- M14),进一步在蛋白水平上证实了Lv-M14对MSC中METTL14的抑制作用,并且增强了ELMO1的表达,但未影响MSC增殖(Fig. 7a)。m6A RIP PCR结果显示,转染lv - m14的MSC中ELMO1的m6A修饰水平明显低于转染lv - nc的MSC(Fig. 7B)。与对照组相比,MSC中抑制METTL14的表达延长了ELMO1 mRNA的半衰期(Fig. 7c,d)。转染Lv-M14后MSC中Rac1水平上调(Fig. 7e)。接下来,作者研究抑制METTL14是否会影响MSC的迁移能力,在伤口愈合试验中,Lv-M14组染色的迁移MSC数量和迁移面积远高于对照组Lv-NC对照组(Fig. 7f, g)。此外,转染lv - m14的MSC裸鼠中生物发光区域也增加了(Fig. 7h)。
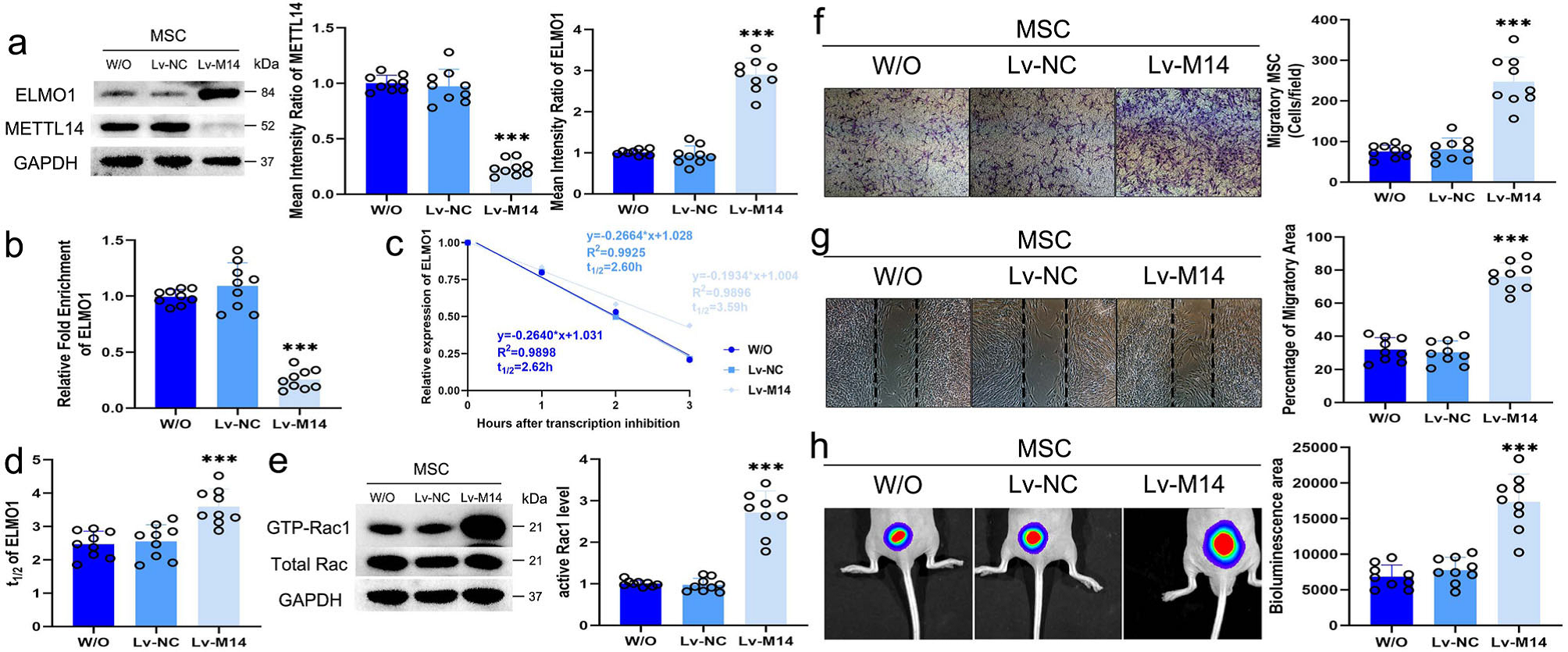
Figure 7抑制METTL14表达可增加ELMO1表达,促进MSC定向迁移
8. METTL14过表达能抑制ELMO1水平,抑制MSC定向迁移
进一步研究发现,过表达METTL14可明显抑制MSC中ELMO1的表达(Fig. 8a)。过表达METTL14 会引起ELMO1的提高m6A修饰水平(Fig. 8b)。此外,转染OE-M14后,MSC中ELMO1 mRNA半衰期缩短(Fig. 8c, d),且 MSC中Rac1活性水平降低(Fig. 8e)。体外Transwell迁移,伤口愈合试验以及体内生物发光面积测量显示当METTL14过表达时,MSC迁移能力受到抑制(Fig. 8F–H)。结果表明,METTL14能增强ELMO1的m6A修饰,加速ELMO1 mRNA的变性,进而降低了ELMO1的表达,抑制MSC迁移。

Figure 8. METTL14过表达下调ELMO1水平,抑制MSC定向迁移
9. METTL14作用于ELMO1 3 'utr区特定的m6A修饰位点
作者进一步研究了METTL14如何加快ELMO1 mRNA的看降解。CLIP-PCR结果显示,ELMO1在METTL14组比IgG组更富集,提示METTL14能特异性结合MSC中ELMO1 mRNA转录本(Fig. 9a)。先前的一项研究表明METTL14主要与mRNA的3'UTR结合,促进mRNA变性。在双荧光素酶报告基因实验中,与对照组相比,野生型中带有ELMO1 3’utr的报告基因质粒的荧光素酶活性明显降低,而突变型METTL14则没有(Fig. 9b)。接下来,作者构建了带有突变ELMO1 3'UTR的报告质粒用来验证ELMO1的m6A修饰位点(Fig. 9c)。
发现与对照组相比,只有突变的1型ELMO1 3’UTR的报告质粒的荧光素酶活性恢复到正常水平。进行2,3型ELMO1 3’ UTR突变的报告质粒的荧光素酶活性与野生型ELMO1 3’ UTR报告质粒的荧光素酶活性相当(Fig. 9d)。通过CLIP检测,发现ELMO1 mRNA结合得失YTHDF2和YTHDF3,而不是YTHDF1、YTHDC1和YTHDC2。
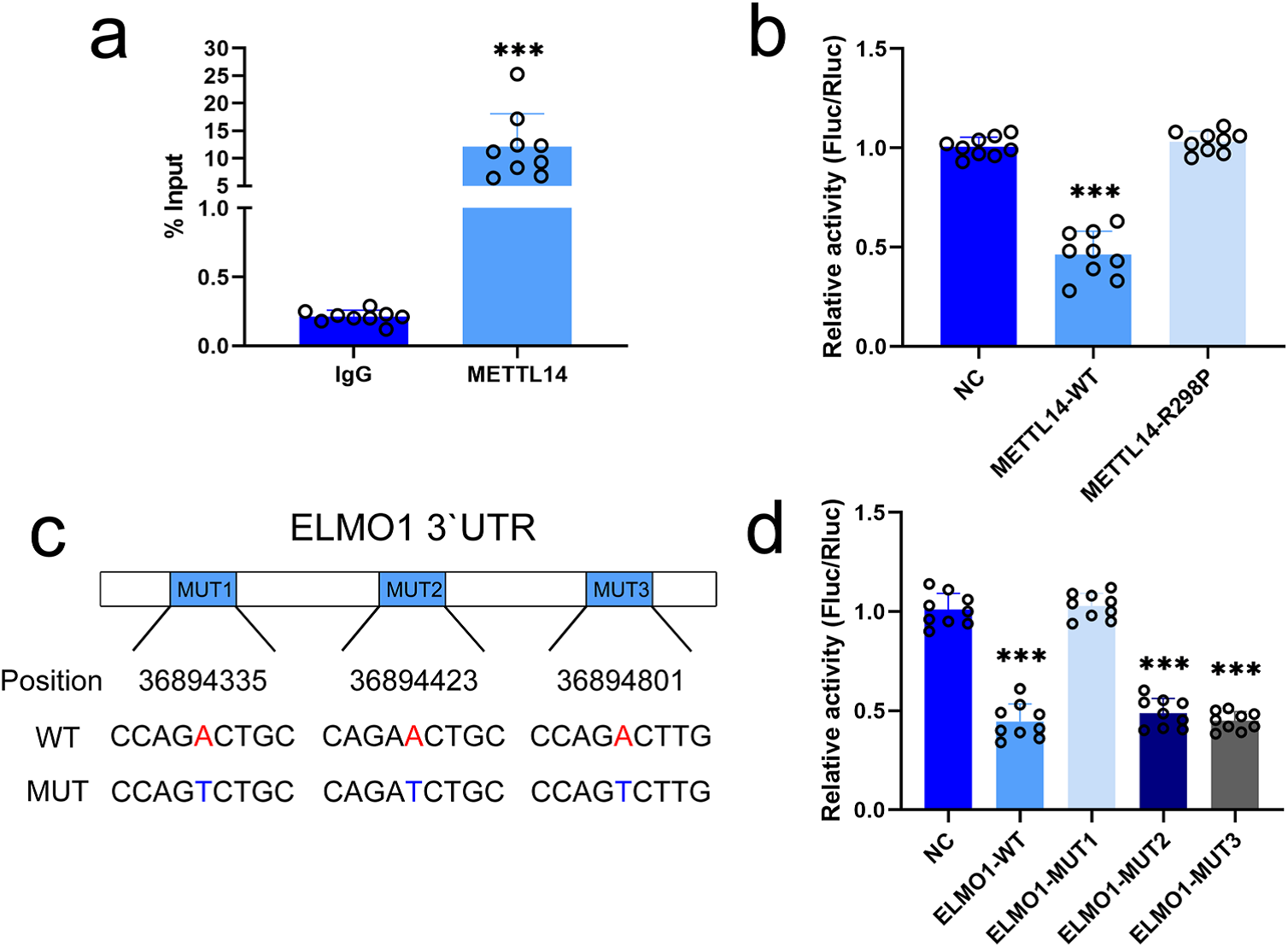
Figure 9.作用于ELMO1 3'UTR的特异性m6A修饰位点
本文中,作者发现TNF-α通过METTL14依赖的ELMO1 m6A修饰加速AS-MSC的定向迁移。
参考文献:
1. Xie Z, Yu W, Zheng G, Li J, Cen S, Ye G, et al. TNF-alpha-mediated m(6)A modification of ELMO1 triggers directional migration of mesenchymal stem cell in ankylosing spondylitis. Nat Commun. 2021;12(1): 5373. doi: 10.1038/s41467-021-25710-4.






