来自肾小管细胞的外泌体miR-21促进肾纤维化
输尿管梗阻引起的肾积水与肾纤维化和进行性慢性肾病(CKD)有关。外泌体介导的细胞-细胞通讯被认为与各种疾病有关,包括肾纤维化。然而,对于外泌体如何调节梗阻肾脏的肾纤维化知之甚少。2021年8月发表于Theranostics(IF=11.556)的文章“Exosomal miR-21 from tubular cells contributes to renal fibrosis by activating fibroblasts via targeting PTEN in obstructed kidneys“对此进行了介绍。研究发现肾纤维化的增加与单侧输尿管梗阻(UUO)的延长天数有关,外泌体分泌在UUO肾和TGF-β1刺激的NRK-52E细胞中显著增加。从TGF-β1刺激的NRK-52E细胞中纯化的外泌体可激活成纤维细胞并加重肾纤维化。此外,Rab27a敲除或GW4869处理抑制外泌体分泌可消除成纤维细胞激活,改善肾纤维化。TGFβ1-Exos中外泌体miR-21较Ctrl-Exos明显升高,且PTEN是miR-21的靶点。在体外,上皮外泌体miR-21的促进或抑制相应地加速或消除成纤维细胞的激活,而在体内,miR-21缺陷的外泌体通过PTEN/Akt途径缓解UUO后肾纤维化。我们的研究结果表明,来自肾小管上皮细胞的外泌体miR-21可能通过miR-21/PTEN/Akt通路激活成纤维细胞,从而加速肾纤维化的发展。
技术路线
结果
1)UUO诱导的肾纤维化模型中TGF-β1的表达和外泌体的产生增加
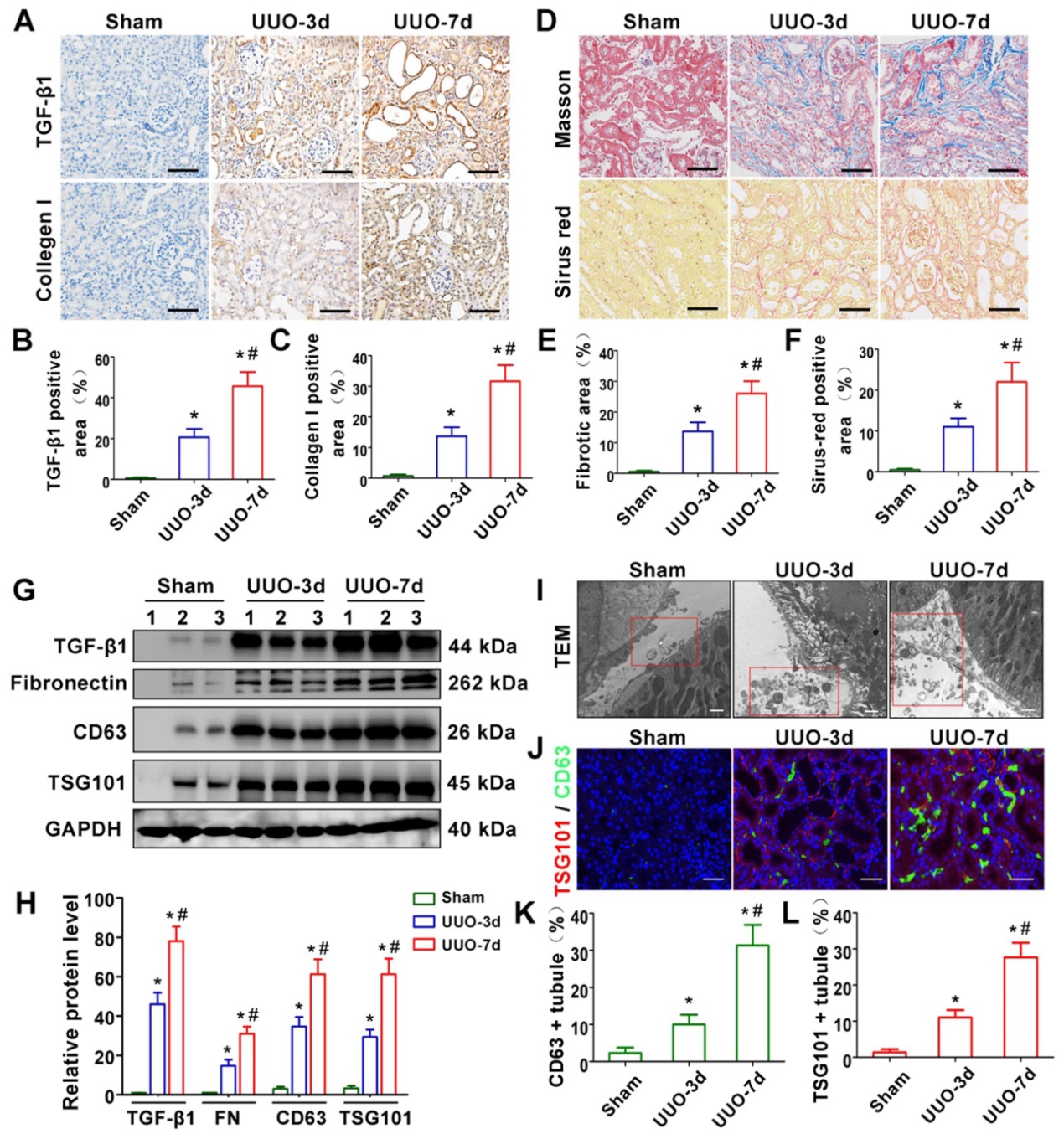
我们首先通过Masson三色染色、Sirius红染色、western blotting和免疫组化方法评估UUO-3d和UUO-7d模型肾纤维化和TGF-β1的表达(图1A-H)。结果提示,TGF-β1表达和肾纤维化与梗阻天数呈正相关。为了进一步阐明外泌体是否在UUO模型中发挥作用,我们进行了透射电镜、免疫荧光和western blotting检测。透射电镜显示UUO后细胞外囊泡分泌明显增加。此外,许多细胞外囊泡的外泌体直径为30-150 nm(图1I)。CD63和TSG101(外泌体标记物)的Western blot(图1G和H)和免疫染色(图1J-L)显示,外泌体在UUO-3d组中明显增加,在UUO-7d组中进一步增加。此外,外泌体主要分布在肾小管上皮周围(图1J)。
2)TGF-β1促进肾小管上皮细胞分泌外泌体,并在体外激活成纤维细胞
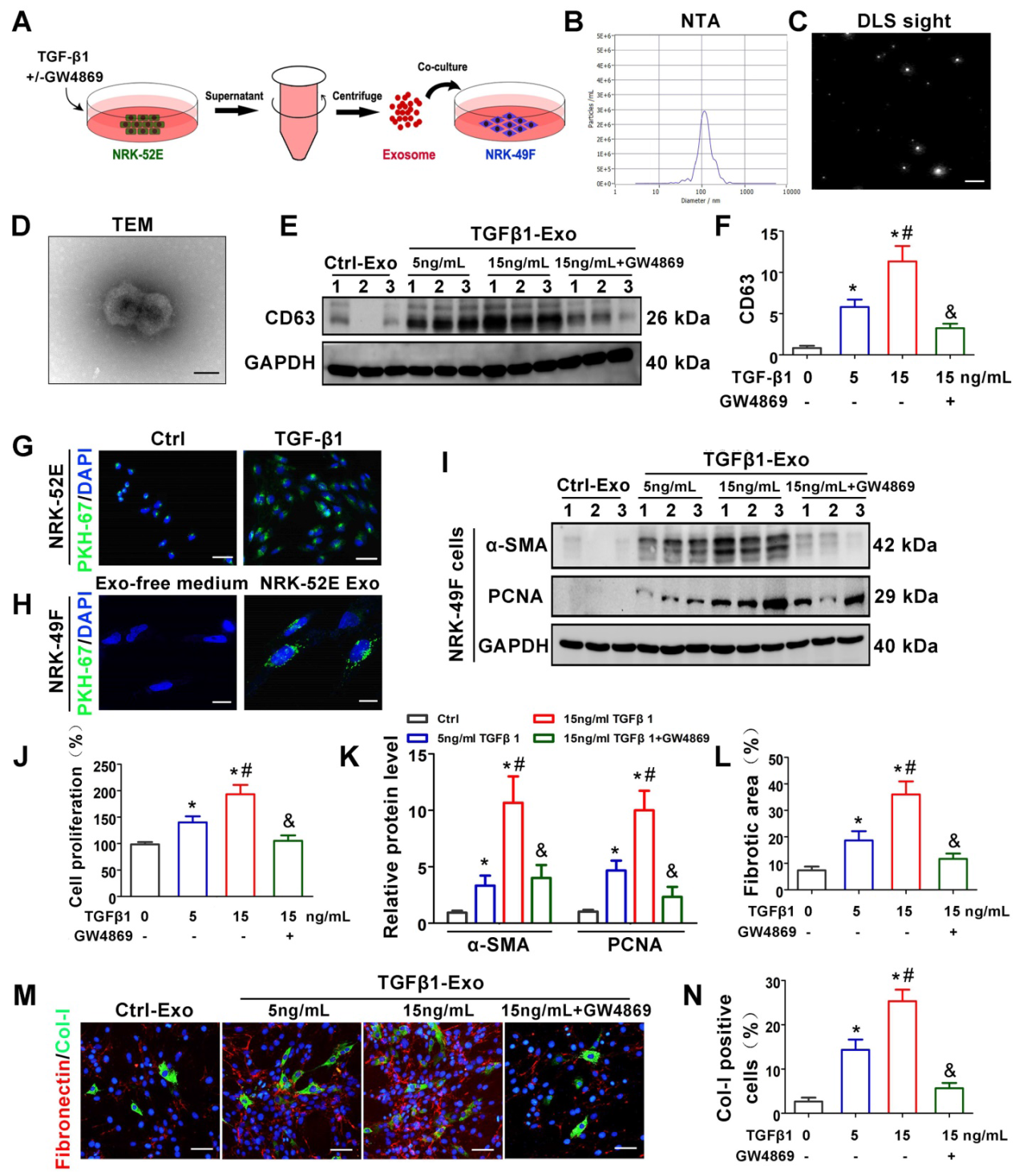
我们研究了肾小管来源的外泌体在介导成纤维细胞激活中的潜在作用。TGF-β1作为主要的成纤维因子,用于刺激UUO肾损伤/应激小管细胞的状态。不同浓度TGF-β1伴或不伴GW4869孵育24小时后,NRK-52E细胞与无外泌体培养基孵育24小时,从条件培养基中收集外泌体来刺激正常大鼠肾间质成纤维细胞(NRK-49F细胞)(图2A)。如图2B-D所示,NTA、DLS和TEM显示大部分分离的细胞外囊泡为外泌体。CD63的Western blot分析证实,外泌体的分泌依赖于TGF-β1的浓度,而GW4869处理明显抑制了细胞外基质的沉积(图2E-F)。随后我们用PKH-67标记NRK-52E细胞,荧光强度显著增强,进一步证实TGF-β1处理后外泌体分泌增加(图2G)。此外,PKH-67标记的外泌体与NRK-49F细胞孵育后被成纤维细胞吸收(图2H)。从TGF-β1处理的NRK-52E细胞中分离的外泌体能够诱导NRK-49F细胞增殖和基质生成,表现为α-SMA、PCNA、Col-I和纤连蛋白表达增加。而GW4869处理明显逆转了上述变化(图2I-N)。
3)肾小管细胞来源的外泌体促进体内肾纤维化
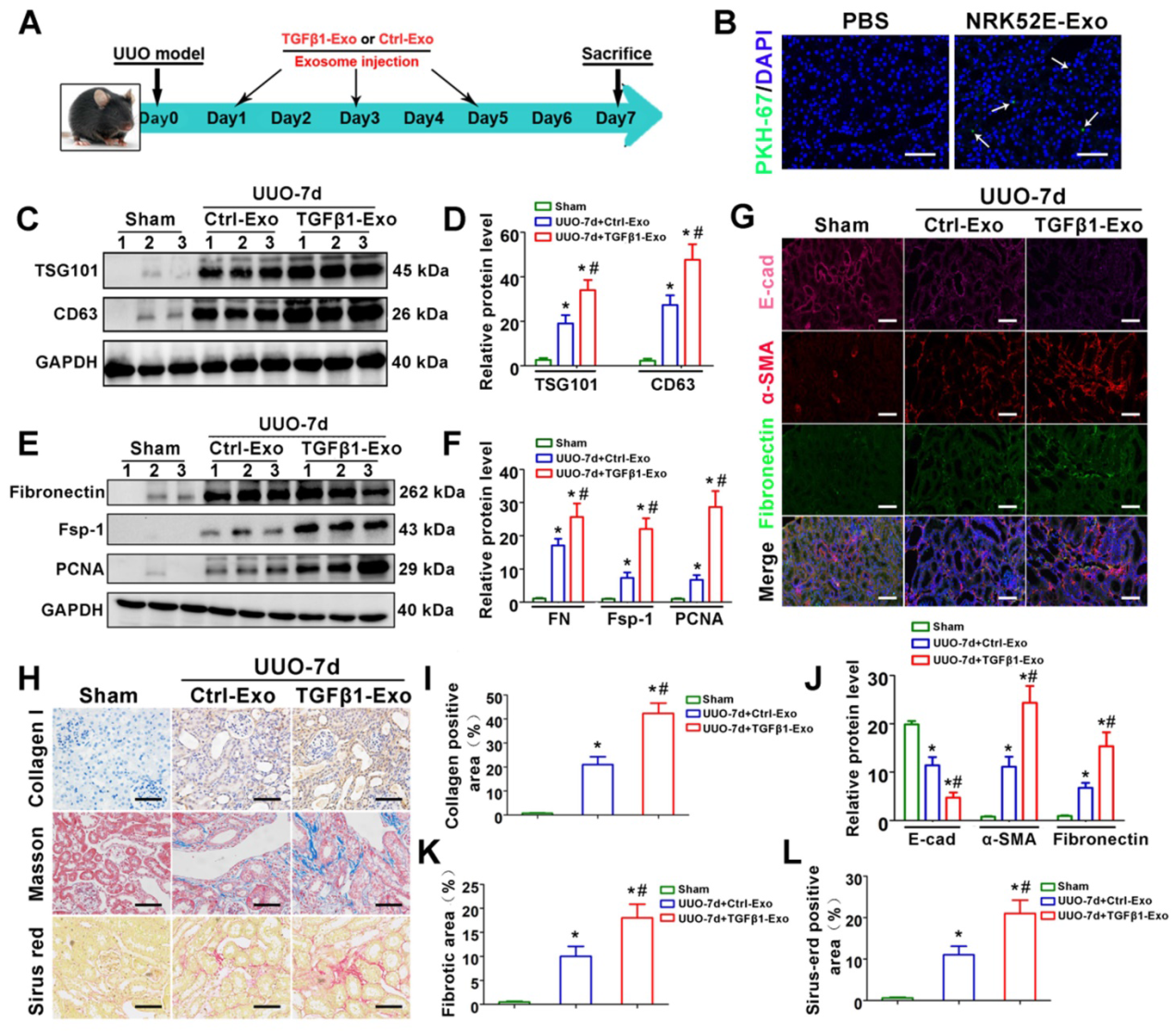
为了研究肾小管来源的外泌体与UUO诱导的纤维化在体内的相关性,我们使用UUO模型进行了动物研究,注射从TGF-β1处理的NRK-52E细胞中分离出来的TGFβ1-exos。实验设计如图3A所示。如图3B所示,在体内,我们观察到NRK-52E细胞PKH-67标记的TGFβ1-Exos存在于梗阻的肾脏中。此外,与Ctrl-Exo相比,注射TGFβ1-Exo可以明显诱导CD63和TSG101的表达(图3C-D)。然后我们检测了外泌体注射对UUO肾脏的影响。如图3E-L所示,与Ctrl-Exos相比,TGFβ1-Exos促进了UUO后7天阻塞肾脏中成纤维细胞的增殖,并加剧了纤维连接蛋白和胶原沉积。
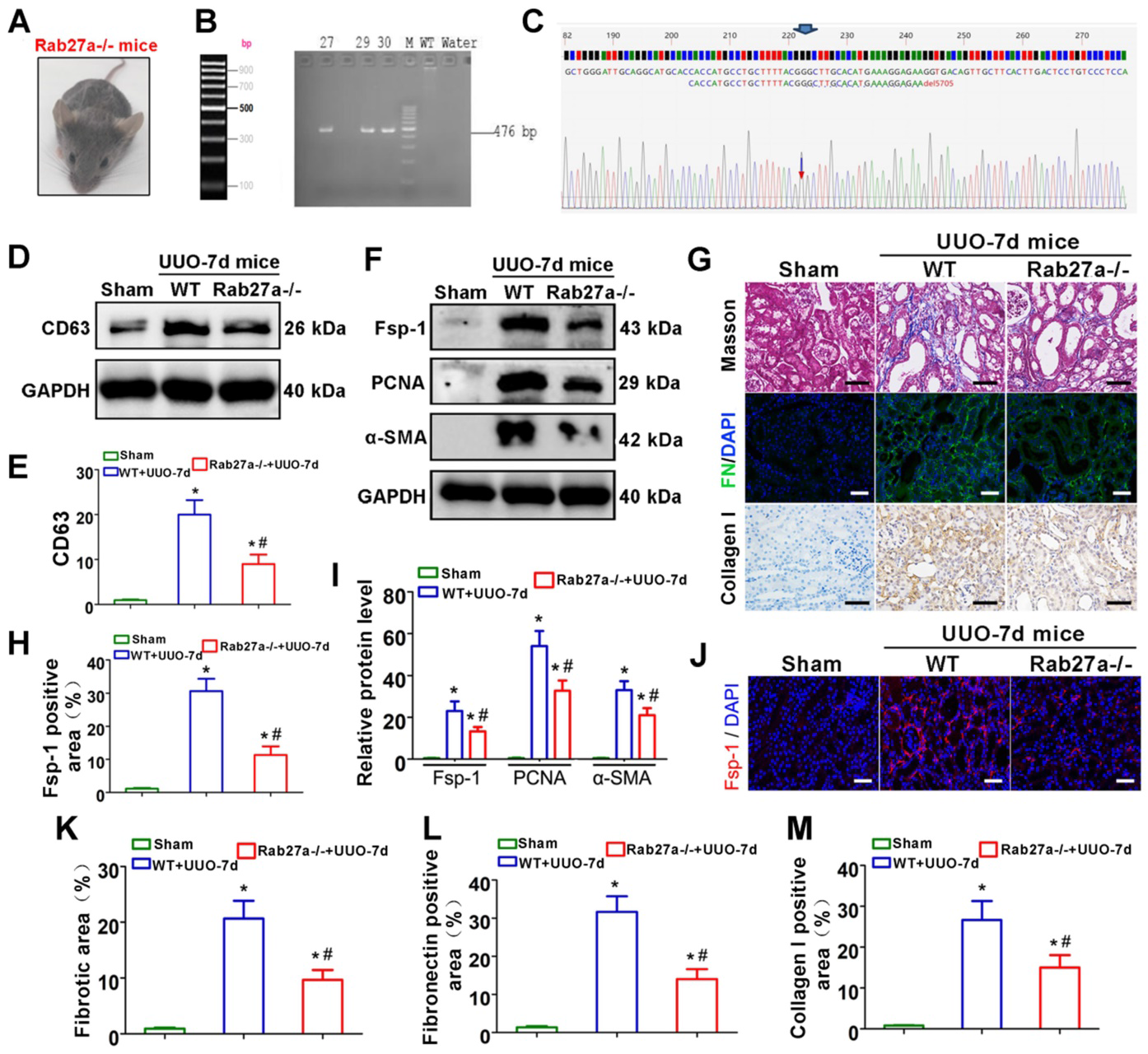
4)Rab27a敲除可抑制外泌体分泌,减轻UUO诱导的体内肾纤维化
如图4A-C所示,成功构建并证实了Rab27a敲除小鼠(Rab27a-/-)。western blot检测CD63的表达,表明敲除Rab27a可减少UUO肾脏的外泌体分泌(图4D-E)。接下来我们检查了成纤维细胞的激活和纤维连接蛋白和胶原的沉积。western blotting(图4F, I)和免疫荧光(图4F, H, J)检测证实了敲除Rab27a明显抑制了成纤维细胞的激活。同时,Masson染色,Col-I免疫组化染色和纤维连接蛋白免疫荧光染色证实,敲除Rab27a可通过抑制胶原蛋白和纤维连接蛋白沉积而改善UUO后肾纤维化(图4G, K-M)。
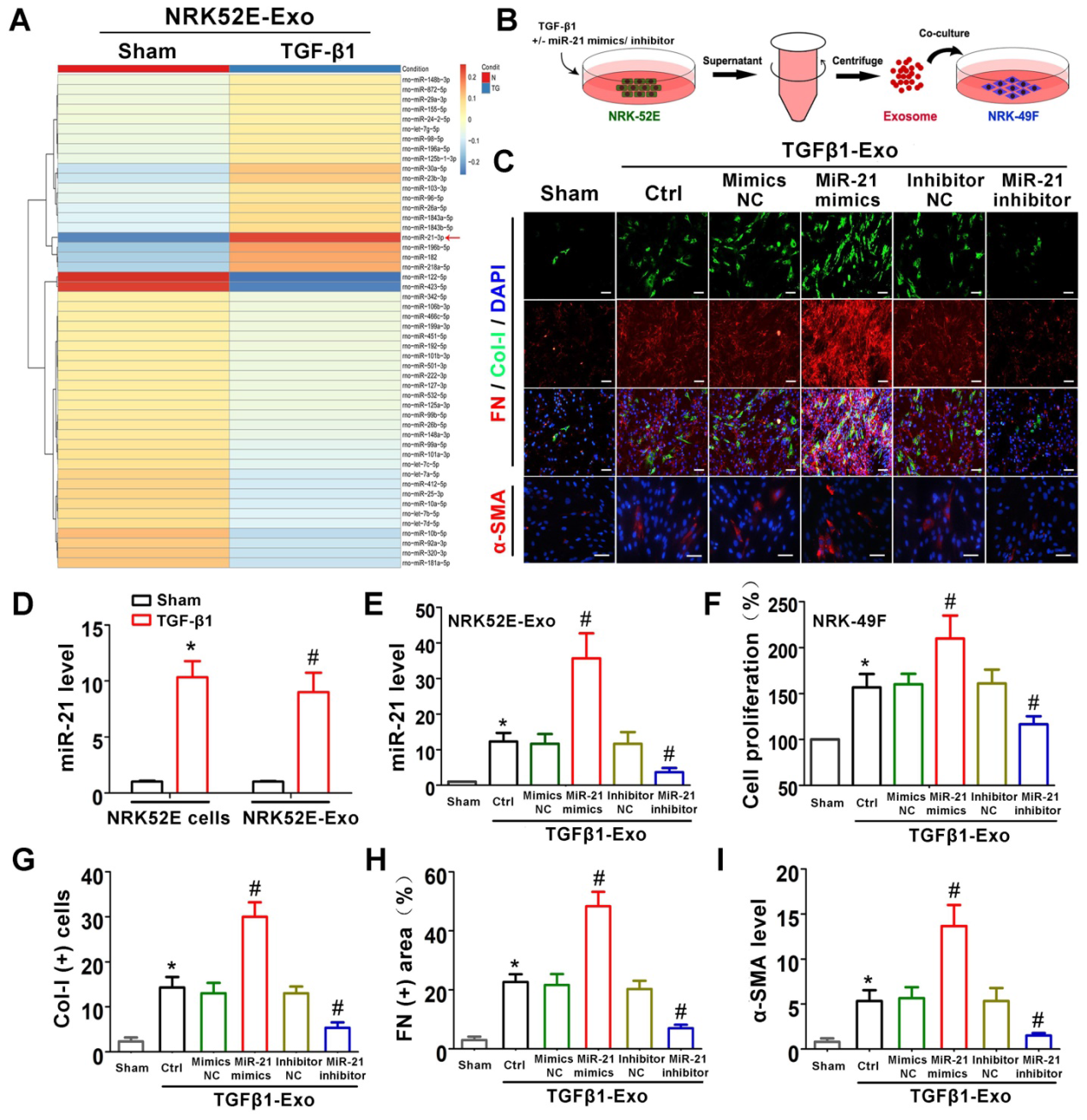
5)肾小管细胞来源的外泌体miR-21促进体外成纤维细胞活化
为了探究管状细胞来源的外泌体miRNA是否发挥作用,我们进行了miRNA测序(图5A)。在所有改变的miRNA中,miR-21的升高最为显著,我们进一步证实,TGF-β1处理后,miR-21在NRK-52E细胞和NRK-52E传递的外泌体中被诱导(图5D)。为了证实外泌体miR-21的作用,我们将miR-21模拟物或抑制剂转染到NRK-52E细胞中,使其过表达或抑制外泌体miR-21(图5B),并通过PCR验证转染效果(图5E)。细胞转染和TGF-β1处理后,立即在NRK-49F细胞中加入相应的外泌体。如图5C和5F-I所示,miR-21模拟转染的NRK-52E细胞的外泌体刺激NRK-49F细胞中Col-I、纤连蛋白和α-SMA的表达及细胞增殖明显增加。同样,当miR-21 inhibitor转染的NRK-52E细胞的外泌体刺激NRK-49F细胞时,Col-I、纤连蛋白和α-SMA的表达以及细胞增殖均明显下降。
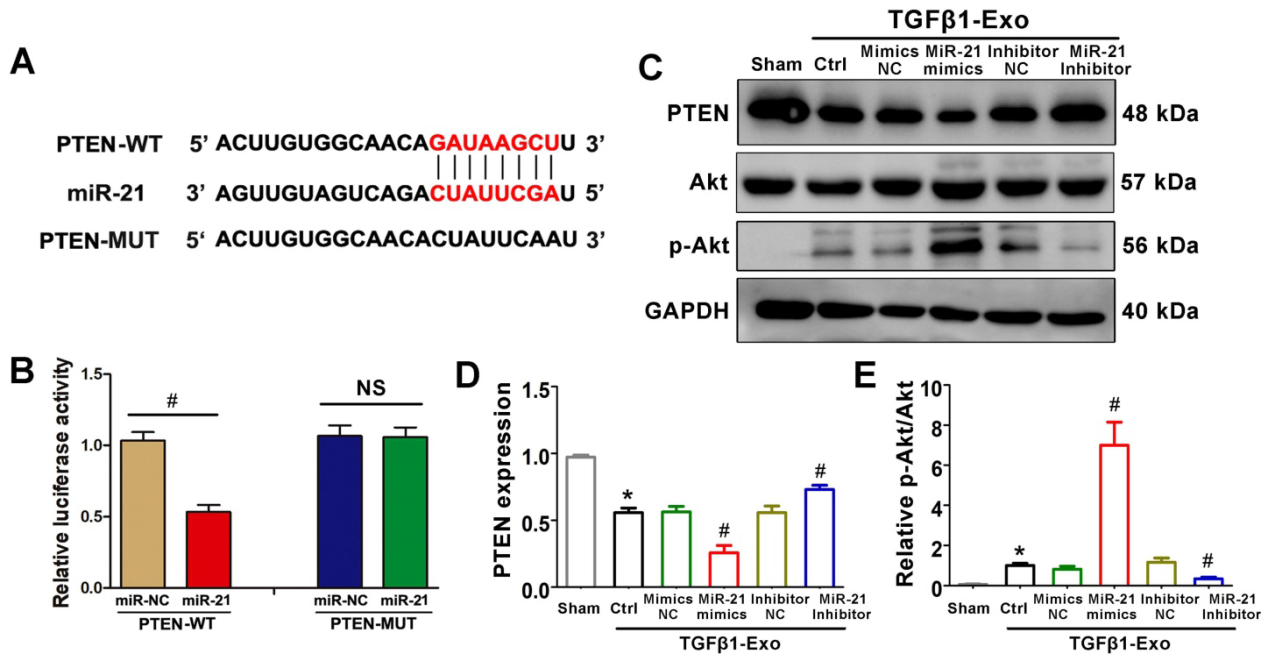
6)PTEN是miR-21的一个潜在靶点
我们进一步研究了肾小管细胞来源的外泌体miR-21介导成纤维细胞激活的可能机制。TargetScan软件预测PTEN基因的3 '-UTR是miR-21的保守结合位点(图6A)。为了验证miR-21与PTEN的关系,我们构建了携带PTEN 3’UTR的野生型PTEN (PTEN-WT)荧光素酶报告基因。将带有PTEN-WT的miR-21模拟物转染到NRK-49F细胞后,与Ctrl组相比,miR-21模拟物抑制了PTEN-miR-21转染细胞中的荧光素酶活性(图6B)。最后,我们通过western blot检测NRK-49F细胞中PTEN和下游p-Akt的表达水平。当使用miR-21模拟转染的NRK-52E细胞的外泌体刺激时,PTEN明显降低,p-Akt升高,但当使用miR-21抑制物转染的NRK-52E细胞的外泌体刺激时,这些变化被缓解(图6C-E)。
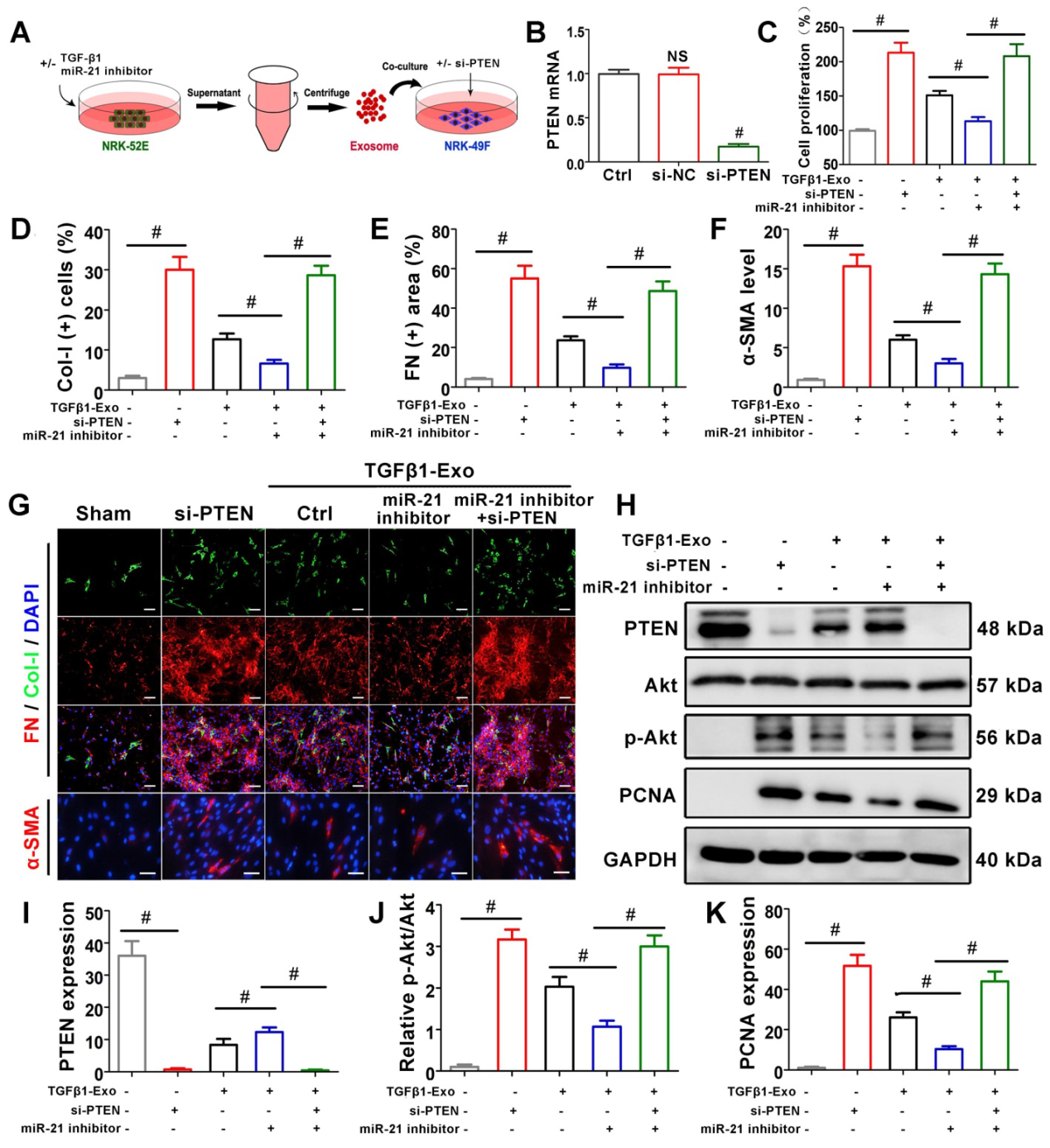
7)肾小管细胞来源的外泌体miR-21通过PTEN/Akt通路介导体外成纤维细胞激活
为了进一步证实miR-21在PTEN中的作用,NRK-49F细胞在接受NRK-52E递送的外泌体之前,先用PTEN siRNA处理(图7A),与si-NC组相比,PTEN mRNA明显受到抑制(图7B)。CCK-8(图7C)和PTEN的western blot表达(图7H, K)表明,不经外泌体干预的siPTEN转染显著促进了NRK-49F的增殖。在外泌体干预组中,单独转染miR-21 inhibitor可抑制NRK-49F增殖,同时转染siPTEN后明显逆转。免疫荧光染色显示,转染siPTEN后,NRK-49F细胞中Col-I、纤连蛋白和α-SMA表达明显增加。在外泌体干预组中,单独转染miR-21 inhibitor可抑制上述指标,同时转染siPTEN后则明显逆转。western blot检测通路相关蛋白PTEN和p-Akt,如图7H-J所示。未经外泌体干预的siPTEN转染可显著抑制PTEN,但加速p-Akt。在外泌体干预组中,单独转染miR-21 inhibitor可加速PTEN并抑制p-Akt,但与siPTEN共转染后这种作用被逆转。上述结果表明,肾小管细胞来源的外泌体miR-21可以通过PTEN/Akt途径介导成纤维细胞的激活。
8)肾小管细胞来源的外泌体miR-21通过PTEN/Akt通路促进体内肾纤维化
为验证外泌体miR-21在体内的作用机制,采用TGFβ1-Exo注射UUO模型进行动物实验。NRK-52E细胞的TGFβ1-Exos在UUO后7天增加了细胞外基质和成纤维细胞增殖。同时抑制肾小管细胞来源的外泌体中miR-21的表达可抑制成纤维细胞的激活和细胞外基质的产生(图8A-D, 8E-G)。我们进一步发现肾小管细胞来源的外泌体在UUO后下调PTEN并激活p-Akt。此外,外泌体中抑制miR-21可上调PTEN并抑制p-Akt(图7F, H-I)。

结论:我们证明了肾小管细胞来源的外泌体在输尿管梗阻诱导的肾积水和长期肾纤维化中发挥重要作用。我们发现UUO后含有miR-21的外泌体的产生增加。管状细胞来源的外泌体miR-21通过靶向PTEN促进成纤维细胞激活,并影响PTEN/Akt通路。这些结果引入了一种新的机制,解释了UUO模型中细胞-细胞通信是如何由外泌体介导的,并表明外泌体可能是一个新的开发领域,以延缓或减缓肾纤维化的进展。
参考文献:Zhao S, Li W, Yu W, Rao T, Li H, Ruan Y, Yuan R, Li C, Ning J, Li S, Chen W, Cheng F, Zhou X. Exosomal miR-21 from tubular cells contributes to renal fibrosis by activating fibroblasts via targeting PTEN in obstructed kidneys. Theranostics. 2021 Aug 2;11(18):8660-8673. doi: 10.7150/thno.62820.






