LncRNA PD-L1剪切亚型通过提高c-Myc活性促进肺癌发展
肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖的现象。目前常通过对程序性死亡细胞(PD-1)的抑制,来阻止免疫反应的终止,PD-1抑制剂常被认为是治疗癌症的有效手段。但PD-L1抑制剂的功效在许多实体瘤癌症患者中的效果是有限的,研究发现,在肺腺癌(LUAD)患者体内,除了mRNA PD-L1,LncRNA PD-L1可以通过可变剪切实现免疫检查点抑制,IFNγ能促进mRna PD-L1和ncRNA PD-L1的表达。PD-L1-Lnc一旦生成,通过直接结合c-Myc并激活c-Myc转录活性,减少肿瘤细胞凋亡,促进LUAD患者肿瘤细胞增殖和侵袭,基于此,本文研究新的LncRNA PD-L1在肺腺癌发展过程中的分子机制。这篇文章于2021年发表在《Genome Biology》杂志上,IF= 10.806。
本文技术路线如下:
主要结果如下:
1肺腺癌(LUAD)细胞及其细胞系中均可通过选择性剪接产生mRNA PD-L1亚型LncRNA PD-L1
为探索LUAD不同阶段PD-L1蛋白的表达量异,对PD-L1蛋白阳性和阴性样品均进行了mRNA PD-L1表达的检测,结果在198 bp 和 92 bp 处都扩增出了条带(Fig 1A,左图)。Sanger测序结果显示,198 bp条带与PD-L1 mRNA序列相匹配(Fig 1A,右图),而92bp处条带为非编码亚型PD-L1(PD-L1-Lnc)(Fig 1A, 右下图)。为进一步证实,设计了探针对缺失片段进行检测(Fig 1B, 上图),在878 bp 和705 bp处检测出两条条带,878bp条带与PD-L1 mRNA序列相匹配,而705 bp的条带显示与PD-L1 mRNA相比,第4个外显子中存在106 nt的序列缺失,第5个和第6个外显子之间存在67 nt的缺失(Fig 1B,右下)。通过BASESCOPE显色实验发现,在肺癌组织中mRNA PD-L1(蓝点)和LncRNA PD-L1(红点)存在明显的共表达(Fig 1C);接下来,作者设计了PD-L1 mRNA和PD-L1-Lnc的特异性探针,对这些RNA片段进行定量(Fig 1D,上图),通过PCR探针扩增并进行qRT-PCR检测,检测到PD-L1蛋白阳性和阴性样品中在PD-L1 mRNA和PD-L1-ln数量一致(Fig 1D,中图,右图)。
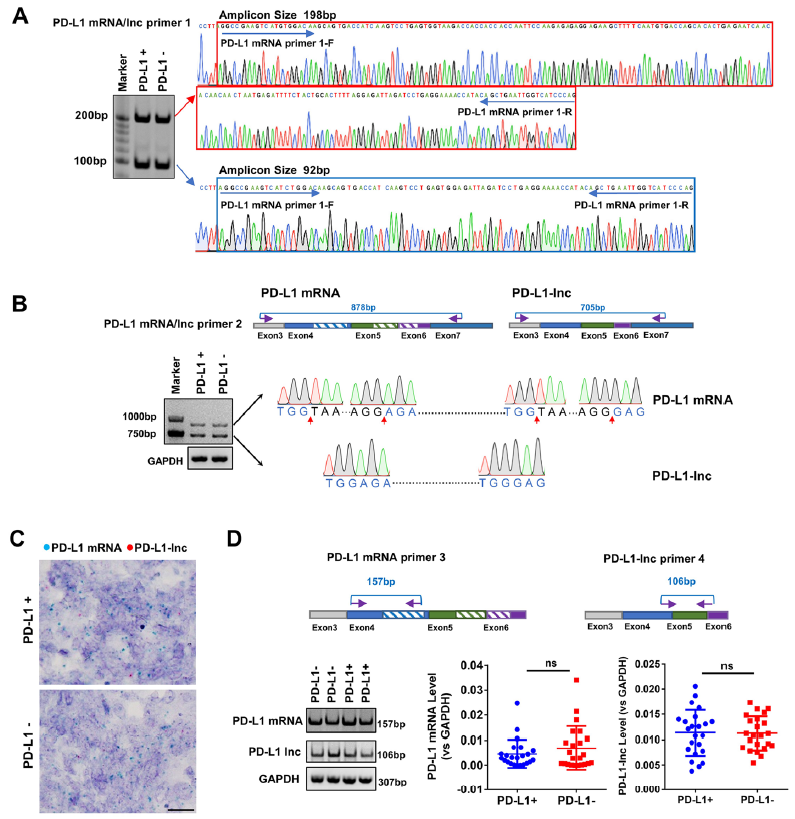
Figure 1 PD-L1通过可变剪接产生PD-L1-Lnc
接下来,通过WB和流式细胞仪检测肺癌不同的细胞系中(A549, PC9, H1975, H1650, H1299)中PD-L1-Lnc和 PD-L1 mRNA的表达。结果发现,PD-L1在不同的细胞系中表达存在差异(Fig 2A、B),且通过琼脂糖凝胶电泳、BASESCOPE、RT-PCR均能检出PD-L1 mRNA和PD-L1-Lnc(Fig. 2C-E)。
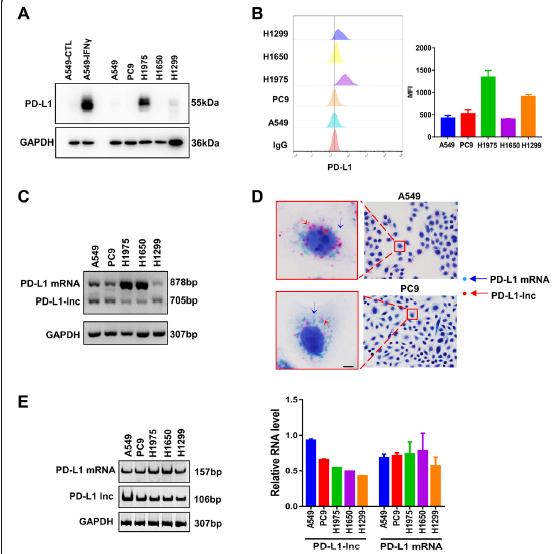
Figure 2 PD-L1-Lnc在不同LUAD细胞系中的表达
2 IFNγ也会促进PD-L1- Lnc的表达
已有研究发现,T细胞分泌的IFN-γ(干扰素-γ)能上调PD-L1 mRNA和蛋白的表达,那么癌症细胞是否能连接T细胞表面的PD-1进而抑制细胞免疫有待进一步验证。与PD-L1-mRNA相比,PD-L1-Lnc在638 -744 和832 -899处存在缺失(Fig 3A),进一步假设IFNγ会增强PD-L1- Lnc的转录。为进一步验证,在没有IFN-γ的前提下对五个细胞系中的PD-L1蛋白含量、PD-L1 mRNA, 以及 PD-L1-Lnc水平进行检测,结果发现IFNγ确实能极大地促进PD-L1蛋白的表达。5个肝癌细胞系中进行IFNγ治疗也明显提高了PD-L1 mRNA的表达水平(Fig 3B),为了进一步研究PD-L1-Lnc在肺癌细胞中的分布,从A549细胞系中分离纯化了PD-L1-Lnc, 分离的细胞核和细胞质部分都表现出高水平的标记蛋白,组蛋白H3和GAPDH证实了分离产物中细胞核和细胞质富集的富集情况(Fig 3C,左图),RT-PCR结果显示IFNγ处理上调细胞核和细胞质中PD-L1-Lnc和PD-L1 mRNA的表达(Fig 3c,右图)。
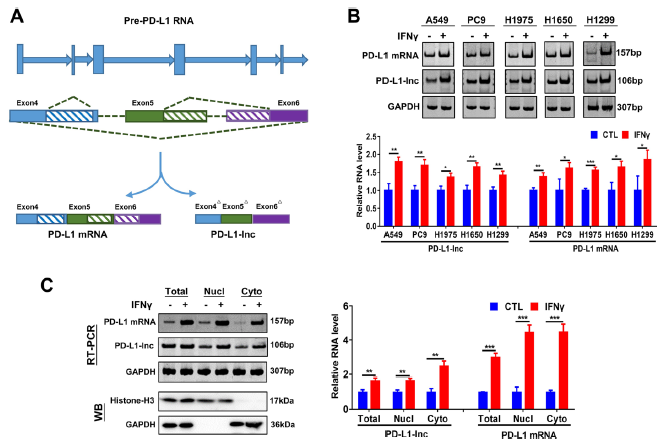
Fig3 IFNγ能调节PD-L1-Lnc的表达
本研究发现,在肺癌组织中,虽然PD-L1-Lnc并不影响PD-L1-mRNA和蛋白的表达,但依然影响细胞的增殖,迁移和侵袭。在A549 和PC9细胞系中,过表达PD-L1-Lnc与对照相比,细胞的增殖、侵袭能力、抑制细胞凋亡能力明显增强(Fig 4A-C)。接下来,在肺癌异种移植小鼠模型中进一步验证,分别在A549细胞系中对PD-L1-Lnc进行过表达和干扰,并与阴性对照组进行比较,虽然在整个实验过程中,三组小鼠的体重没有显著差异(Fig 5A),但对肿瘤大小进行观察发现,这些肺癌细胞的生长速度明显不同(Fig 5B-C)。在A549细胞系中,过表达PD-L1-Lnc组的肿瘤大小明显高于对照组,PD-L1-Lnc shRNA组的肿瘤大小明显低于肿瘤对照组;肿瘤组织切片Ki67染色显示,PD-L1-Lnc的表达情况与细胞增殖率呈正相关(Fig 5D)。RT-PCR发现与对照组相比,PD-L1-Lnc过表达和干扰组PD-L1-Lnc表达水平分别显著升高和降低,而PD-L1 mRNA的表达没有明显差异(Fig 5E)。
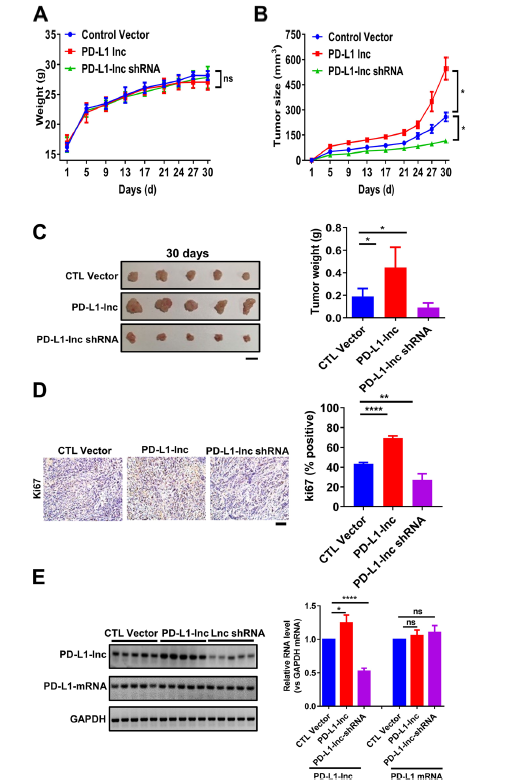
Fig 5 PD-L1-lnc对小鼠肺癌移植瘤生长的影响
3. PD-L1-Lnc激活c-Myc信号通路促进癌症进展
过表达PD-L1-Lnc上调的基因大部分在PD-L1-Lnc shRNA出现下调(Fig. 6A);进一步分析发现这些基因约20%参与了c-Myc信号通路(Fig.6B)。
将变化显著并参与了c-myc信号通路的基因进行q-PCR检测,结果发现,在A549细胞系和肺癌异种移植中,过表达或干扰PD-L1-Lnc后,这些基因的表达产生明显变化(Fig 6C)。此外,将过表达的PD-L1-Lnc和干扰的c-Myc siRNA共转染到这些基因中,结果发现,c-Myc siRNA显著减弱了原本PD-L1-Lnc过表达对这些的促进作用(Fig 6C)。作者进一步研究PD-L1-Lnc 和 c-Myc之间存在怎样的联系,MYC家族在肿瘤细胞增殖、转移和凋亡中如何发挥作用,将生物素偶连的反义寡核苷酸固化在链霉亲和素磁珠上进行C-Myc沉淀,将生物素标记的探针作为阴性对照,WB结果显示PD-L1-Lnc和c-Myc出现了免疫共沉淀(Fig 6D),接下来在细胞中通过A/G蛋白质琼脂糖珠使其与c-Myc抗体结合,过表达PD-L1-Lnc、敲低PD-L1-Lnc (Fig 6E.左图)进行比较, 结果发现c-Myc抗体组中检测到了PD-L1-Lnc,然而在IgG对照组中没有检测到PD-L1-Lnc(Fig.6 E, 右图)。
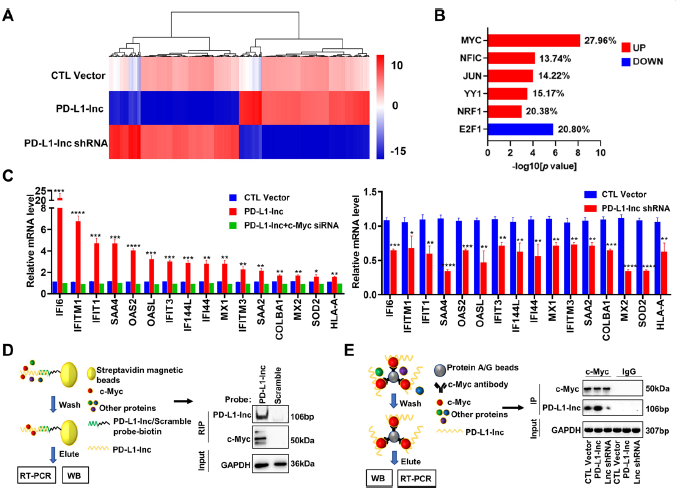
Fig 6 PD-L1-lnc与c-Myc结合,激活c-Myc下游信号通路
c-Myc可以与PD-L1-Lnc的双螺旋结构结合(Fig 7A),作者接下来预测了7个C-Myc与PD-L1-Lnc可能的结合位点,为进一步验证,作者构建了两个预测结合位点突变(PDL1- Lnc mut)或缺失(PD-L1-Lnc del) 载体(Fig 7B),将其转染到A549细胞系中,发现 PD-L1 mRNA和蛋白表达不受影响。免疫沉淀试验表明,c-Myc与野生型PD-L1-Lnc产生免疫共沉淀,进一步通过pulldown观察PD-L1-Lnc与c-Myc的结合情况,发现只有野生型PD-L1-Lnc GFP mRNA与c-Myc进行结合,而突变型PD-L1-Lnc GFP mRNA未和Myc结合(Fig 7C),免疫共沉淀实验再次验证了这一点(Fig 7D)。
已有研究表明,c-Myc的螺旋-环-螺旋Zip基序可以与伴侣蛋白Max形成异源二聚体,从而启动基因转录(Fig 7A)。作者提出假设,PD-L1-Lnc可以通过改变c-Myc构象来增强c-Myc的转录活性,从而与Max形成异源聚合物,为检验这个假设,研究中转染PD-L1-Lnc过表达载体的细胞中Max蛋白水平显著高于转染对照载体的细胞,转染PD-L1-Lnc shRNA的细胞中Max蛋白水平显著减低(Fig 7E)。在A549细胞系中, 免疫荧光标记显示PD-L1-lnc过表达显著增强细胞中c-Myc的核易位(Fig 7F)。western blot分析也显示PD-L1-lnc过表达增加了c-Myc的核分布,而c-Myc的总细胞水平保持不变(Fig 7G)。
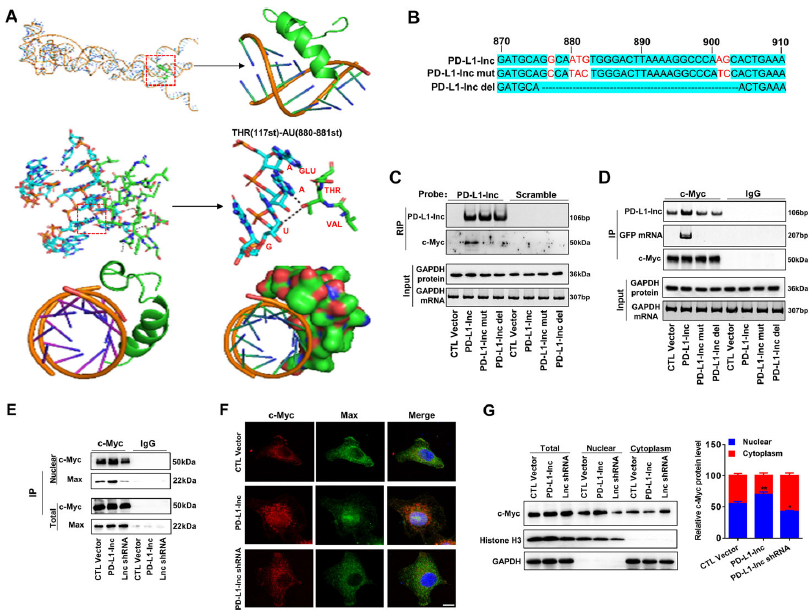
Fig 7G PD-L1-lnc与c-Myc的结合能增强了c-Myc与Max的结合,促进了c-Myc核易位
为进一步验证PD-L1-Lnc是否通过c-Myc信号通路行使自身功能,作者通过c-Myc siRNA下调了c-Myc的表达,观察PD-L1-lnc过表达是否影响细胞增殖、侵袭和凋亡,发现将过表达PD-L1-Lnc将会增强细胞增殖、侵袭能力并抑制细胞的凋亡(Fig 8A-C)。通过c-Myc siRNA敲除c-Myc,细胞增殖、侵袭能力并抑制细胞的凋亡能力明显下降(Fig 8A-C)。
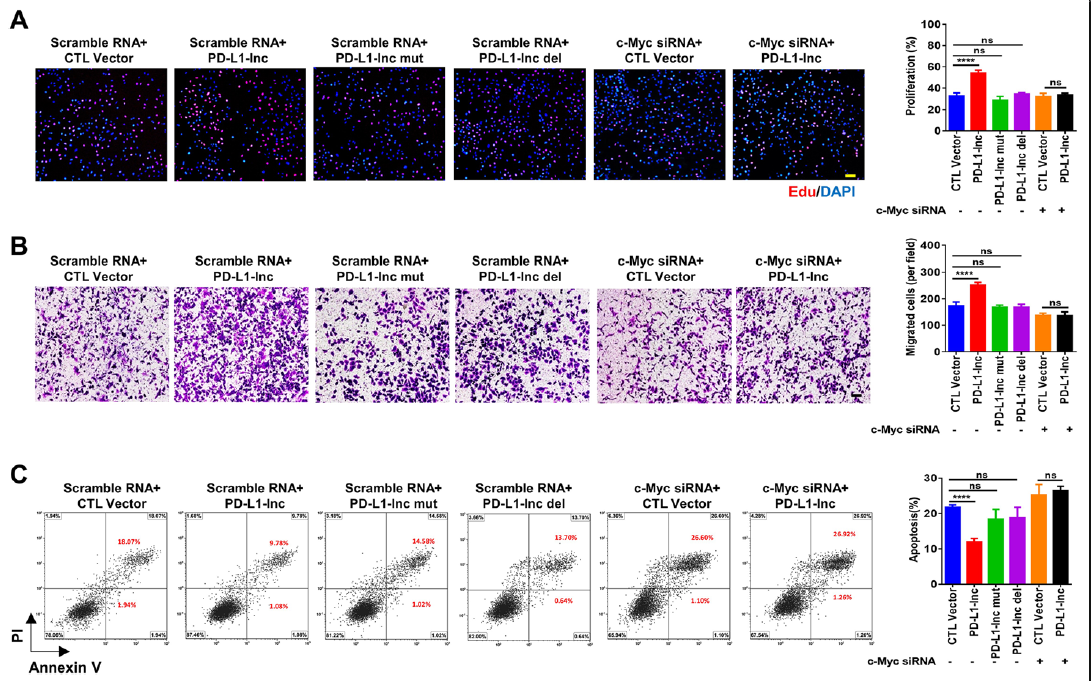
Fig。 8 PD-L1-lnc通过c-Myc信号通路促进肺癌进展
在本研究中,作者发现PD-L1基因通过选择性剪接将会产生另一个PD-L1转录本PD-L1-Lnc,PD-L1-lnc通过增强c-Myc转录活性促进LUAD增殖、转移和生存,为肺癌治疗提供新思路。
参考文献:
PD-L1 lncRNA splice isoform promotes lung adenocarcinoma progression via enhancing c-Myc activity[J]。 Genome Biology, 2021, 22(1)。






