CircMYH9通过调节丝氨酸代谢和氧化还原稳态来驱动结直肠癌生长
环状RNA(circRNA)在癌症进展和代谢调节中发挥重要作用。丝氨酸/甘氨酸代谢通过促进癌细胞的合成代谢需求和表观基因组以及调节其氧化还原状态来支持癌细胞的生长。然而,circRNA在调节丝氨酸/甘氨酸(SG)代谢中的作用尚未得到很好的阐明。今天讲一篇关于circRNA调节丝氨酸/甘氨酸代谢的文章,改文章发表于Molecular Cancer期刊,影响因子27.4。文章题名为:CircMYH9 drives colorectal cancer growth by regulating serine metabolism and redox homeostasis in a p53-dependent manner。
在结直肠癌组织和细胞中鉴定出circMYH9
为了识别潜在的差异表达的 circRNA,从 GEO 数据库中筛选了可能在 CRC和癌旁组织中差异表达的circRNA。共检测到8个下调的 circRNA和237 个上调的circRNA。然后,通过微阵列分析进一步分析3对CRC和癌旁组织中的circRNA表达谱,92个circRNA上调,85个circRNA下调。数据库中的 237 个上调circRNA与微阵列中92个上调circRNA相交,鉴定出9个重叠的 circRNA。在9个circRNA中,hsa_circ_0092283,也称为 circMYH9,起源于 MYH9 基因,由内含子37的头尾剪接组成。由于circMYH9与其他8个circRNA相比显着上调,选择它进行进一步研究。qRT-PCR 分析表明 circMYH9可以通过cDNA中的不同引物进行扩增,并且在基因组 DNA(gDNA)组中没有观察到其他产物。此外,circMYH9 对 RNase R具有抗性,而 MYH9 mRNA 可以被RNase R降解。然后,通过 Sanger 测序证实了circMYH9 的RT-PCR 产物。
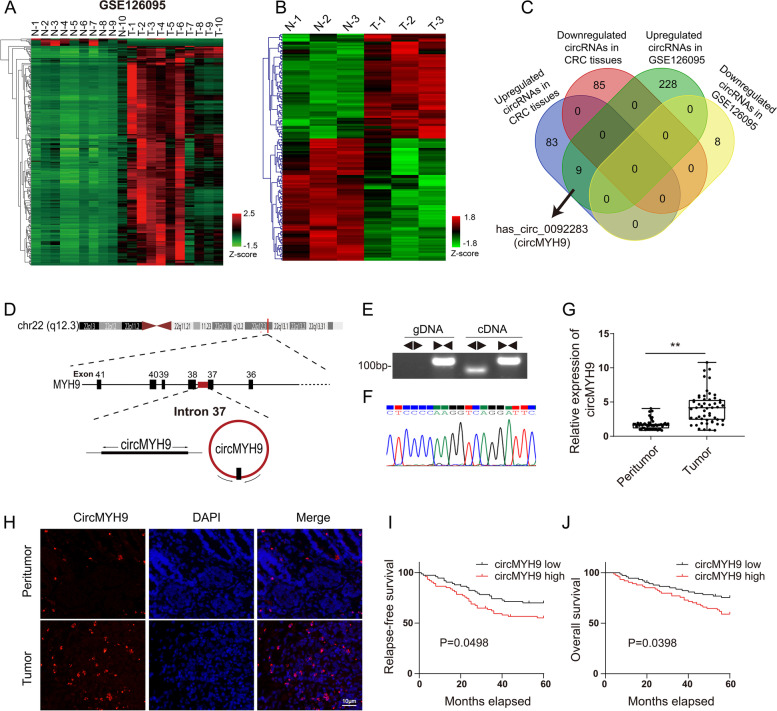
CircMYH9 表达在 CRC 组织中上调并预测预后不良
qRT-PCR和FISH检测CRC组织中的circMYH9表达水平,显示CRC组织中的circMYH9表达高于肿瘤周围组织。然后,检查了148例CRC病例中 circMYH9表达与临床病理结果的相关性。circMYH9 水平与肿瘤大小、远处转移、淋巴结转移、TNM 分期和 p53 状态显着相关。circMYH9低表达患者的无复发生存率(RFS)高于高表达患者,风险比为 0.593。此外,circMYH9高表达患者的总生存率(OS)显着低于circMYH9低表达患者,风险比为 0.547。
CircMYH9促进CRC细胞中的细胞生长
首先检查了其在正常肠上皮细胞系FHC和CRC细胞系中的表达,发现与 FHC细胞相比,circMYH9在CRC 细胞系中的表达显着上调。CCK-8和集落形成测定表明,circMYH9敲低导致HCT116和HCT8细胞中肿瘤生长的显着抑制。circMYH9过表达增加了LoVo细胞的生长。有趣的是,与上述 p53 野生型 (wt) CRC细胞系相比,circMYH9 敲低仅略微改变了p53突变的DLD1和HT-29细胞系中的细胞增殖。细胞周期分布分析表明,circMYH9敲低导致细胞周期在G0/G1期停滞,S期和G2/M期细胞百分比相应降低。circMYH9敲低后,细胞周期蛋白(CDK1、Cyclin D1、CDK6、Cyclin E2)显着减少,而在CRC细胞中circMYH9过表达后,细胞周期得到促进,细胞周期蛋白增加。由于 HCT116 和 LoVo 细胞系在 p53 wt CRC 细胞系中分别相对较高和较低,我们选择它们进行进一步研究。
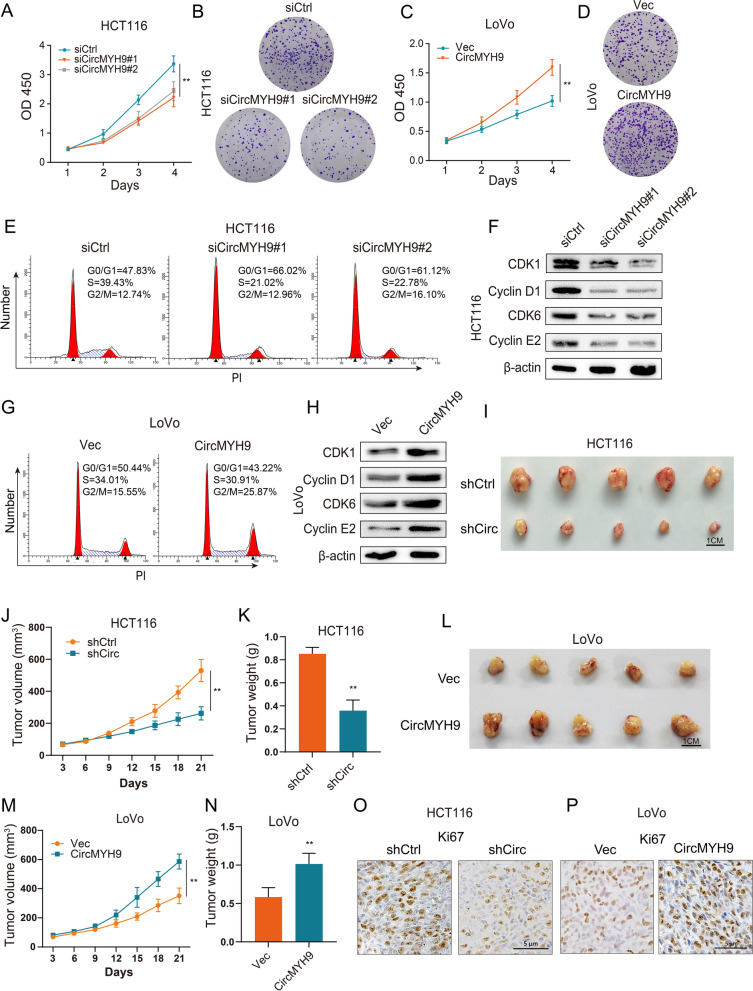
接下来检查了circMYH9对体内CRC肿瘤生长的影响。将circMYH9 shRNA或shCtrl对照稳定转染的HCT116细胞和circMYH9质粒或载体对照稳定转染的LoVo细胞皮下注射到裸鼠体内,注射21天后测量肿瘤体积,处死后测量肿瘤重量。与 shCtrl 对照细胞相比,CircMYH9敲除显着抑制了肿瘤体积和重量,相比之下,与载体对照细胞相比,CircMYH9 过表达表现出增加的肿瘤体积和重量。IHC 分析显示,由 circMYH9 shRNA 转染的 HCT116 细胞形成的肿瘤表现出较弱的 Ki67 染色和由过度表达 circMYH9 的 LoVo 细胞形成的细胞表现出比源自载体转染细胞的肿瘤更强的 Ki67 染色。
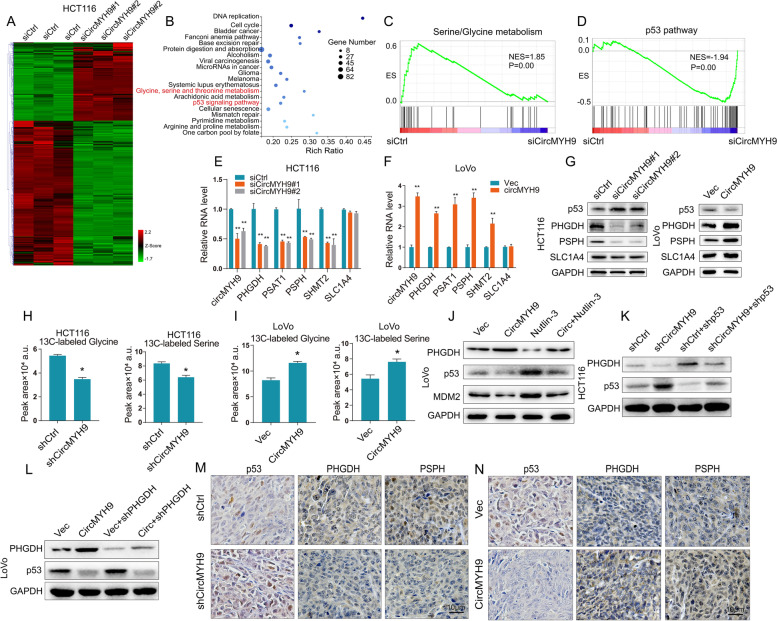
CircMYH9通过p53介导的PHGDH上调促进SG代谢
为了深入了解 circMYH9 促进结直肠肿瘤发生的分子机制,在对照和敲除 circMYH9的HCT116细胞中进行了RNA-seq,并鉴定了差异表达的基因。CircMYH9 缺失导致 893 个基因的上调和 1650 个基因的下调。然后,使用基因本体(GO)分析和GSEA分析进行功能富集分析。前20个GO术语显示包括甘氨酸、丝氨酸和苏氨酸代谢和p53信号通路。GSEA结果显示差异表达的基因集与SG代谢和p53通路显着相关。沉默或过表达circMYH9,发现它正调节SG生物合成途径基因(PHGDH、PSAT1、PSPH和SHMT2)的表达。circMYH9 的沉默或过表达几乎不会改变中性氨基酸转运蛋白 SLC1A4 的水平,表明 circMYH9 不能影响SG的摄取。在培养的最后一个小时,将表达对照或 circMYH9-shRNA 的 HCT116 细胞和表达载体或 circMYH9 质粒的 LoVo 细胞与均匀标记的 [U-13C] 葡萄糖一起温育,并通过液相色谱-质谱法检测。结果显示,与对照细胞相比,shRNA 转染的 HCT116 细胞中的SG显着降低,而过表达circMYH9的 LoVo 细胞中的 SG 相对于载体细胞显着增加。
为了验证circMYH9 是否通过 p53 途径调节SG的合成。qRT-PCR和WB 证明了circMYH9 对p53的负调节。Nutlin-3可激活 p53。Nutlin-3处理过表达 circMYH9的 LoVo 细胞逆转了p53和MDM2的下调,并抑制了SG生物合成途径基因表达和细胞增殖。而circMYH9耗尽的HCT116细胞中的p53沉默则显示出相反的效果。还在过度表达 circMYH9 的 LoVo 细胞中用 shRNA 敲低了 PHGDH。PHGDH 抑制显示出与 Nutlin-3 处理类似的效果,但不影响 p53 表达。此外,与对照细胞相比,具有 circMYH9 敲除的体内异种移植物的 IHC 显示出更高的 p53 表达和更低的 PHGDH 和 PSPH 表达。相比之下,circMYH9 过表达异种移植物的 IHC 显示 p53 的表达较低,而 PHGDH 和 PSPH 的表达高于载体细胞的表达。这些结果证实了 circMYH9 在 p53 通路和从头 SG 代谢的调节中的主要作用。
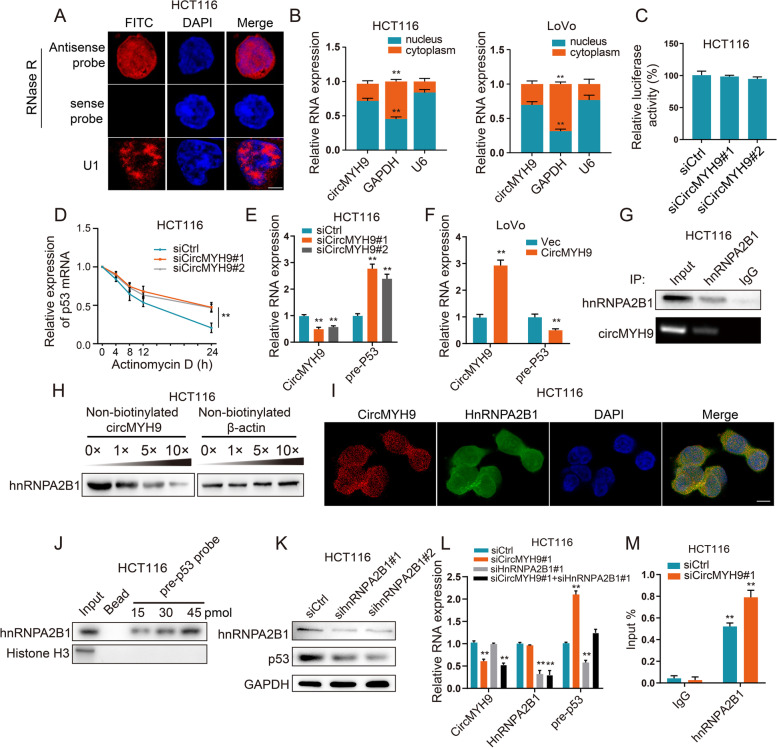
CircMYH9 通过 hnRNPA2B1 调节 p53 前体 mRNA 的稳定性
为了解释 circMYH9 调节p53表达的机制,进行了qRT-PCR和FISH以确定circMYH9在HCT116和LoVo 细胞中的亚细胞位置。结果表明,circMYH9主要定位于细胞核中。由于circMYH9敲低不影响p53启动子活性。有趣的是,在用放线菌素D阻断新的RNA合成后,发现沉默 circMYH9 并没有在 12 小时内改变p53 mRNA 的稳定性,但在24小时内显着增强了p53 mRNA的稳定性,表明 circMYH9可能间接抑制p53的mRNA降解。事实上,circMYH9 siRNA处理后p53前体mRNA表达增加,circMYH9质粒处理后p53前体mRNA表达降低。结果表明,circMYH9 的缺失可能导致 p53 前体 mRNA 的增加,进而影响 p53 的 mRNA 表达。
通过circMYH9验证了某些蛋白质是否参与调节p53前mRNA的稳定性。ChIP结合MS用于鉴定circMYH9的结合蛋白,在此过程中鉴定了42种蛋白质,包括 hnRNPA2B1。为了验证MS结果,进行了RIP测定并观察到circMYH9在由hnRNPA2B1抗体沉淀的复合物中的富集。hnRNPA2B1和circMYH9之间的相互作用被非生物素化的 circMYH9 以剂量依赖性方式竞争性抑制。免疫荧光共定位分析显示 circMYH9 和 hnRNPB2A1 共定位在 CRC 细胞的细胞核中、皮尔逊相关分析(Rx)和相关系数分析(R)显示显示高度相关。
为了检查hnRNPA2B1和p53前体mRNA的关联,进行使用抗 hnRNPA2B1的 RIP测定,证明 hnRNPA2B1与p53前体mRNA相互作用。使用生物素化的反义 DNA 探针提取了p53前体mRNA。hnRNPA2B1被共沉淀。hnRNPA2B1 敲低导致 p53 的前体 mRNA 和蛋白质水平降低。这些结果表明 hnRNPA2B1 可能对p53前体 mRNA 发挥稳定作用。qPCR结果显示hnRNPA2B1敲低可以消circMYH9缺失对p53 pre-mRNA表达的促进作用,而 hnRNPA2B1 过表达可以挽救由circMYH9过表达诱导的p53前体 mRNA的下调表达。circMYH9 敲低增加了hnRNPA2B1和p53前体mRNA之间的结合,而增加的 circMYH9 表达减弱了 hnRNPA2B1 与p53前体mRNA的结合。这些发现表明circMYH9通过阻止hnRNPA2B1与p53前体 mRNA 结合来抑制p53前体mRNA 的稳定性。
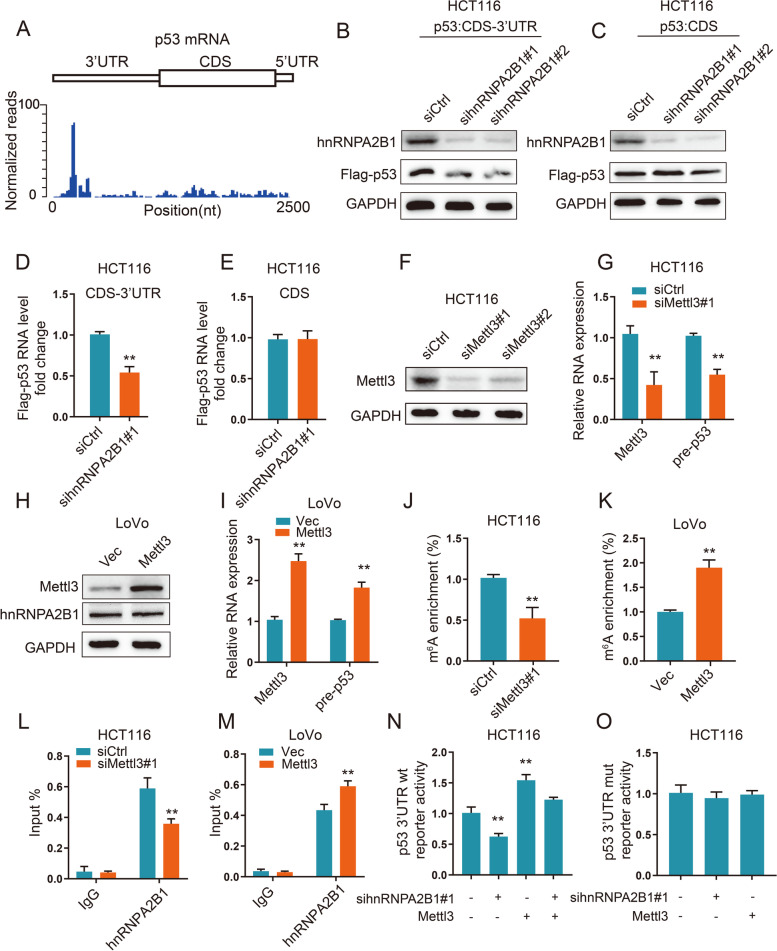
p53 3' 非翻译区 (UTR) 介导的 hnRNPA2B1 对前 mRNA 稳定性的调节
为了进一步确定 p53 的哪个区域参与稳定性调节,在 HCT116 细胞中进行了 MeRIP-seq,发现一个显着的m6A峰分布在 p53 mRNA 的 3'UTR。构建了一个带有 Flag 标签的表达载体,包括带有 3'UTR (p53 CDS-3'UTR) 或单独 CDS (p53 CDS)的p53编码序列,以及用 hnRNPA2B1 siRNA 共转染的 HCT116 细胞。结果表明,hnRNPA2B1 敲低显着降低了p53 CDS-3'UTR转染的CRC细胞中 p53 的表达,而不是单独的 p53 CDS。这表明 3'UTR 对于 hnRNPA2B1 介导的p53调节是必不可少的。
结果显示,敲低Mettl3降低了HCT116细胞中p53前体mRNA水平,而 Mettl3 过表达增加了p53前体mRNA水平而不影响hnRNPA2B1的蛋白质水平。使用针对 p53 3'UTR 和CDS区域的特异性引物进行MeRIP-qPCR以检测 m6A水平,结果显示沉默 Mettl3 导致3' UTR峰m6A甲基化水平降低,而过表达 Mettl3 具有相反的效果。接下来,RIP分析证实了hnRNPA2B1和p53前体 mRNA 之间的相互作用通过消耗Mettl3被抑制或通过过度表达Mettl3 增强。
p53 3'UTR 荧光素酶报告基因检测发现hnRNPA2B1敲低降低了含有 p53 3'UTR的荧光素酶构建体的活性,而Mettl3过表达增加了由 hnRNPA2B1 敲低诱导的荧光素酶活性降低。建立了 p53 3'UTR mut 荧光素酶测定。发现p53 3'UTR mut的萤光素酶活性对hnRNPA2B1敲低或Mettl3过表达没有反应。数据表明,p53前体mRNA的表达受hnRNPA2B1与p53 3'UTR上m6A位点的结合控制。
CircMYH9在氨基酸剥夺下被ROS-HIF1α通路激活
癌细胞可能会暂时或永久地进入非必需的营养缺陷状态,检测了氨基酸缺乏是否与CR细胞中的circMYH9过表达有关。我们在缺乏SG或缺乏谷氨酰胺的培养基中培养CRC细胞,并且 circMYH9 响应于SG或Glu剥夺而上调。缺乏 Glu 或 SG 会导致 ROS 水平升高,从而导致 HIF1α增加。使用ROS清除剂 NAC来处理缺乏SG或Glu的细胞。正如预期的那样,NAC在不含SG或不含 Glu的培养基中逆转了HIF1α和circMYH9的升高。HIF1α敲除消除了HCT116 和LoVo细胞中Glu或SG剥夺诱导的circMYH9表达。表明SG或Glu剥夺诱导的细胞ROS积累增加了HIF1α水平,从而促进了circMYH9的表达。
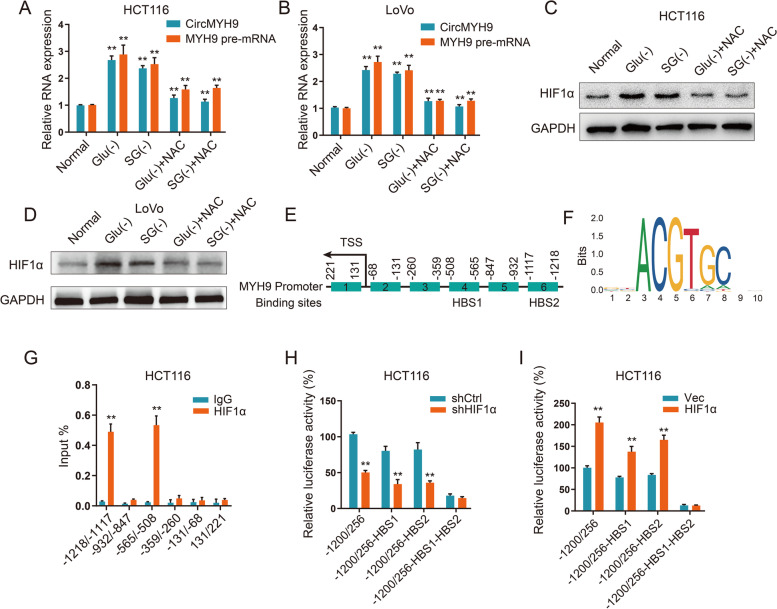
为了探索 HIF1α促进circMYH9表达的分子机制,测量了 MYH9 前体 mRNA 的表达。SG或Glu饥饿增加了MYH9的前体mRNA 水平,HIF1α敲低降低了缺乏SG或Glu的CRC细胞中的MYH9前体 mRNA 水平。这些结果表明HIF1α在转录水平上促进 MYH9 前体 mRNA,这进一步增加了circMYH9。使用 JASPAR 搜索了MYH9启动子中的HIF1α结合位点和基序。确定了两个最可能的HIF1α结合位点。ChIP-qPCR 证明 HIF1α与HCT116细胞中MYH9 启动子的两个HBS位点结合。为了证实HIF1α通过HBS促进MYH9表达,构建了包含全长MYH9启动子区域和HBS缺失的circMYH9启动子区域的荧光素酶报告基因。HBS1或HBS2的缺失部分消除了HIF1α敲低或过表达对MYH9 荧光素酶报告基因活性的抑制或促进,而HBS1和HBS2的缺失则完全消除了 HIF1α shRNA 或质粒对MYH9荧光素酶报告基因活性的影响。这些数据表明,HBS区域对于SG或Glu剥夺下的HIF1α依赖性circMYH9转录调控至关重要。
CircMYH9 促进 p53 野生型小鼠的结直肠肿瘤发生
为了确定 circMYH9 在体内 CRC 发病机制中的因果作用,通过将 p53 fl/fl小鼠与Villin-Cre小鼠杂交,产生了结肠特异性、条件性 p53 KO小鼠。p53 WT小鼠和 p53 KO小鼠用氧化偶氮甲烷 (AOM) 和葡聚糖硫酸钠 (DSS) 处理59 天以诱导结直肠肿瘤发生。在AOM注射前一周,使用AAV9作为载体在小鼠结肠中特异性过表达circMYH9。AAV-circMYH9 的转染效率通过qPCR验证。与p53WT小鼠相比,p53KO小鼠的肿瘤数量、发病率和大小更多,与AAV-ctrl治疗的p53WT小鼠相比,p53WT小鼠中circMYH9的过度表达导致肿瘤数量、发病率和大小增加。带有针对 circMYH9 的探针 FISH证实circMYH9仍然在p53 wt + AAV 小鼠的肿瘤组织中表达。IHC 检查显示,与 ctrl-AAV小鼠相比,具有 circMYH9过表达的肿瘤显示出p53的表达受到抑制,而PHGDH和PSPH的表达增加。总之,这些结果表明 circMYH9 可以通过抑制 p53 和促进小鼠 SG 代谢来驱动化学诱导的致癌作用。
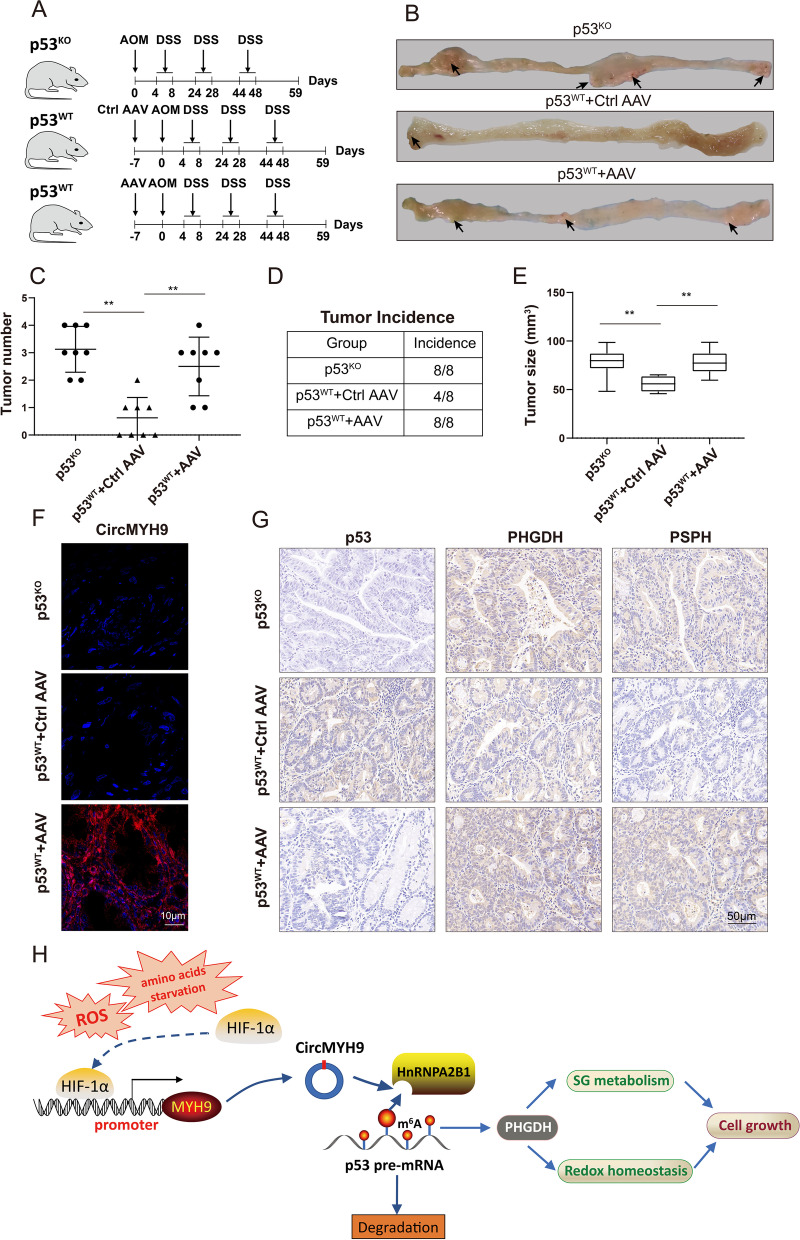
该研究首次证明内含子衍生的circMYH9通过调节SG代谢和氧化还原稳态促进CRC的生长。还确定p53作为circMYH9的靶标,并表明circMYH9可以通过募集m6A阅读器hnRNPA2B1降解 p53前体 mRNA来抑制 p53,进一步转录抑制 PHGDH 表达。此外,在 SG或Glu饥饿下鉴定了扩增circMYH9的 ROS/HIF1α途径。工作突出了CRC中circMYH9的新机制,为监测和治疗CRC 提供了宝贵的资源。






