间充质干细胞来源的外泌体microRNA-139-5p通过靶向PRC1抑制膀胱癌的发生

膀胱癌是世界上第九大流行癌症,占癌症相关死亡的相当大比例。目前多数研究热点在microRNAs (miRNAs)可以通过间充质干细胞(MSCs)来源的外泌体传递到肿瘤细胞中发挥其功能。现在有最新研究探讨了miR-139-5p向膀胱癌细胞的外泌体转移及其在肿瘤发生调控中的作用,支持了MSCs-衍生的外泌体分泌的miR-139-5p在膀胱癌中的肿瘤抑制作用,突出了一个有前景的治疗策略。该研究发表于《Oncogene》,IF:9.867。
技术路线:

主要研究结果:
1. PRC1在膀胱癌中的表达模式及意义
作者对5个膀胱癌数据集(GSE7476、GSE52519、GSE65635、GSE40355和GSE3167)进行差异表达分析,通过生信分析发现PRC1是一个高表达基因,与其他基因广泛相关(图1a-c)。此外,GSE7476、GSE65635、GSE40355和GSE3167数据集中显示了PRC1在膀胱癌中高表达(图1d-g)。接下来,通过逆转录-定量聚合酶链反应(RT-qPCR)、免疫组织化学和western blot分析,确定膀胱癌及癌旁正常组织中PRC1 mRNA和蛋白的表达模式。结果显示,与对照组相比,膀胱癌组织中PRC1 mRNA和蛋白表达显著增加,PRC1阳性表达率显著升高 (图1h-j)。采用卡方检验分析PRC1表达与临床资料的相关性,发现PRC1表达与肿瘤淋巴结转移分期、组织学分级呈正相关,而与年龄、性别、淋巴结转移或肿瘤数量(表1)。此外,与正常膀胱上皮细胞HCV29相比,膀胱癌细胞株(T24、J82、UMUC3、5637)中PRC1 mRNA和蛋白表达量较高,其中T24细胞表达量最高(图1k, l)。因此,选择T24细胞进行进一步实验。
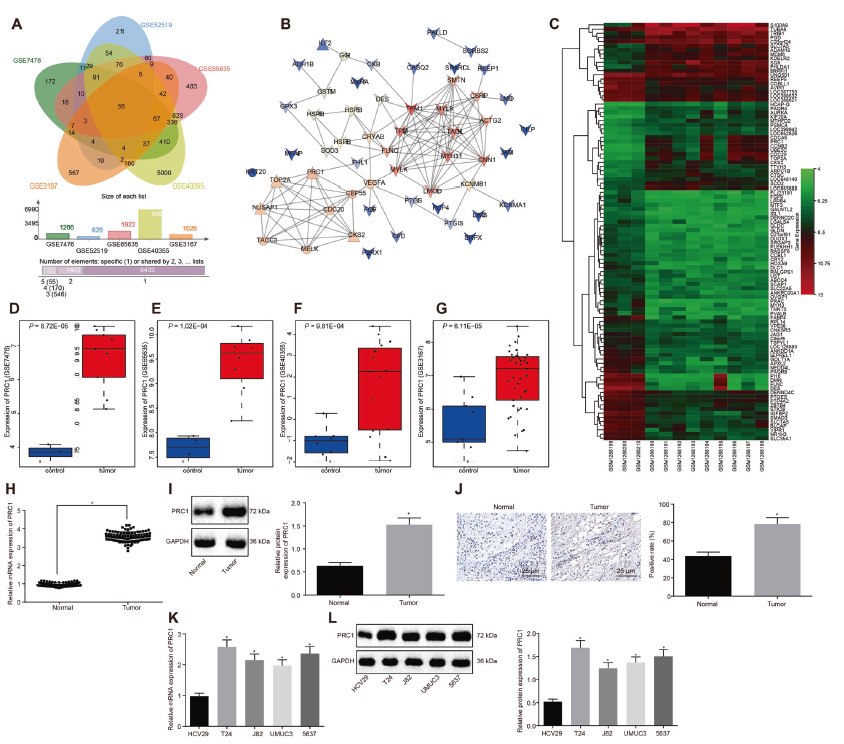
图1 PRC1在膀胱癌中表达异常
2. PRC1功能缺失可改善体外膀胱癌细胞的致瘤特性
通过sh-PRC1评估PRC1在膀胱癌进展中的生物学意义(图2a)。Edu(图2b),末端脱氧核苷酸转移酶(TdT)介导的dUTP-生物素nick末端标记(TUNEL)(图2c)和Transwell(图2d-f)检测表明,细胞增殖、迁移和侵袭能力均减弱,而转染sh1-PRC1后细胞凋亡率增加。Western blot检测凋亡相关因子、b细胞白血病/淋巴瘤2 (Bcl-2)、Bcl-2相关X蛋白(Bax)、上皮-间质转化(EMT)相关因子(N-cadherin、E-cadherin、Vimentin、SNAIL)、增殖相关因子、增殖细胞核抗原(PCNA)的表达模式。如预期,沉默PRC1后,N-cadherin、Vimentin、SNAIL、Bcl-2和PCNA的表达减少,echerin和Bax的表达增加(图2g)。综上所述,这些结果表明PRC1的沉默抑制了膀胱癌细胞的增殖、迁移和侵袭潜能,同时促进了膀胱癌细胞的凋亡。

图2 沉默PRC1抑制膀胱癌细胞增殖潜能,促进膀胱癌细胞凋亡
在发现PRC1在膀胱癌中的作用后,继续检索了mirDIP、miRmap、starBase、TargetScan和microRNA.org等5个数据库,预测调控PRC1的miRNAs,进一步研究膀胱癌进展的分子机制。如图3a所示,hsa-miR-224-5p和hsa-miR-139-5p这两个相互重叠的miRNA被确定为潜在靶点。同时,通过分析GSE40355数据集筛选膀胱癌中差异表达的miRNA。miR-139-5p在膀胱癌中低表达(图3b);PRC1-3’UTR中发现了潜在的miR-139-5p特异性结合位点(图3c);随后,进双荧光素酶报告基因实验、RT-qPCR和Pearson相关性分析,均证明了miR-139-5p能结合PRC1-3’UTR上的位点,它们表达呈负相关 (图3d-f)。另外,与癌旁组织相比,miR-139-5p在膀胱癌组织中表达较低,在膀胱癌细胞株T24,J82, UMUC3和5637持续降最低在T24细胞(图3 g)。同时后续实验证明,miR-139-5p是PRC1的负调控因子(图3h, i)。
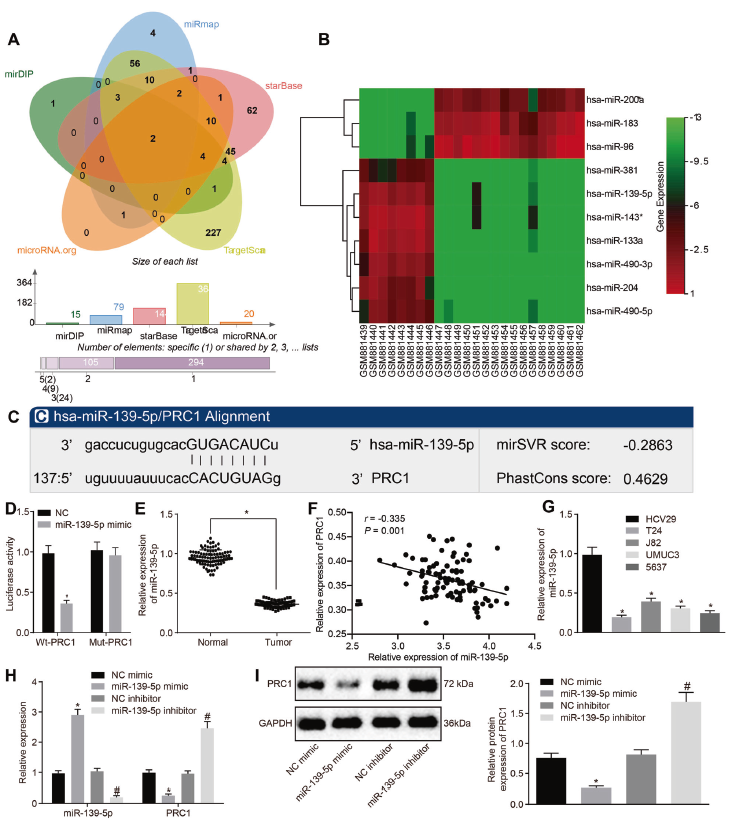
图3 miR-139-5p靶向并负调控PRC1
4. miR-139-5p的上调可通过靶向PRC1改善膀胱癌细胞的致瘤特性
为了研究miR-139-5p在膀胱癌发展中的功能意义及其靶向PRC1的潜在功能,在T24细胞中过表达或抑制miR-139-5p的表达。通过EdU(图4a)、TUNEL(图4b)、Transwell(图4c, d)和western blot(图4e)检测得到的数据表明,过表达miR-139-5p可显著降低T24细胞的增殖、迁移和侵袭能力,提高细胞凋亡率。同时N-cadherin、Vimentin、SNAIL、Bcl-2、PCNA蛋白表达减少,E-cadherin、Bax蛋白表达增加。

图4 miR-139-5p对膀胱癌进展的抑制作用是通过负向调控PRC1实现的
在光学显微镜下观察到hUCMSCs呈细长或纺锤形,菌落生长,呈旋涡状排列。同时,hUCMSCs表现出强大的成骨、成脂和成软骨分化能力(图5a),表明hUCMSCs已成功从人脐带中分离。外泌体随后从成功分离的hUCMSCs中提取。透射电镜下观察到一组圆形或椭圆形、形态均匀的膜性囊泡,囊泡直径为52.5-185.5 nm,囊泡周围可见膜性结构,囊泡中央呈低电子密度(图5b,c)。Western blot检测表明,hUCMSCs的外泌体中表面标记物热休克蛋白70 (HSP70)、CD63和CD9的表达高于hUCMSCs,而葡萄糖调节蛋白94 (GRP94)的表达低于hUCMSCs (p <0.05;图5d),进一步说明外泌体已成功提取。
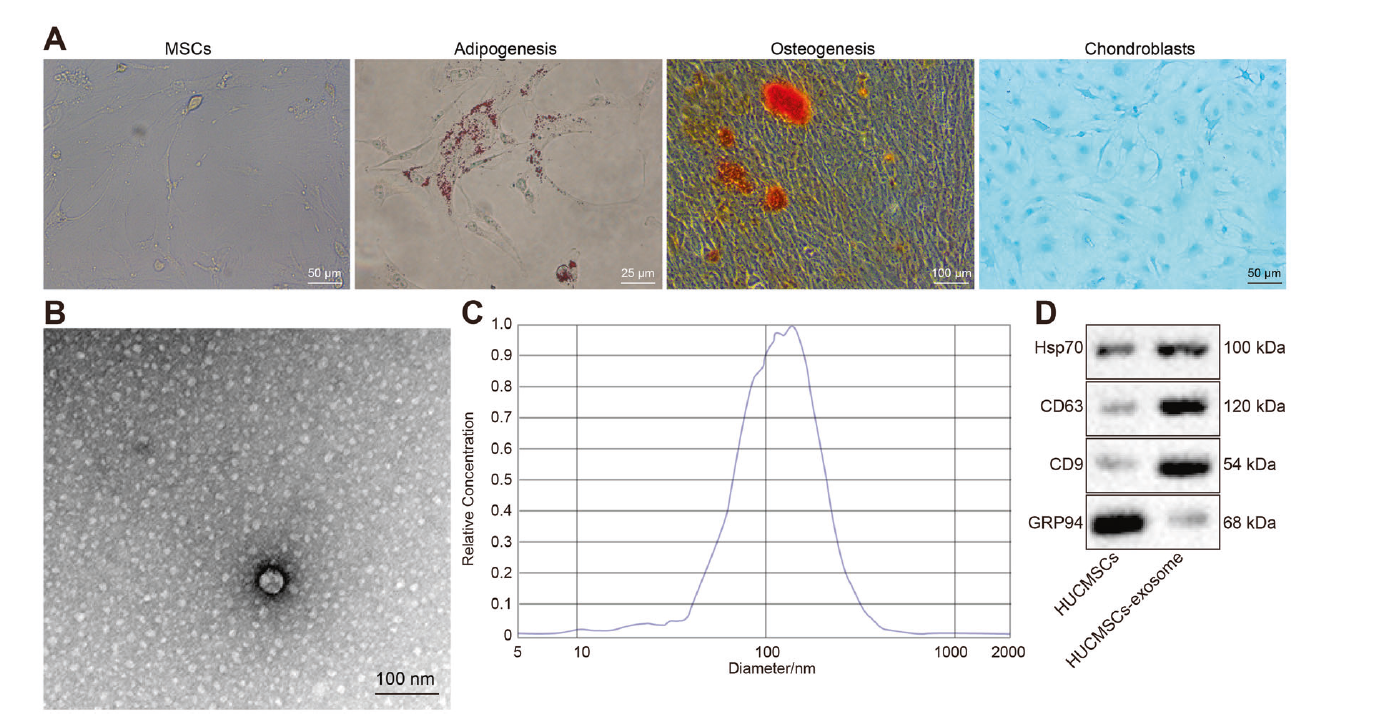
6. hUCMSCs来源的外泌体miR-139-5p在体外改善膀胱癌细胞的致瘤特性
为了验证T24细胞是否能够摄取hUCMSCs分泌的外泌体,将CFSE标记的hUCMSCs来源的外泌体与T24细胞共培养48 h,随后在共聚焦显微镜下观察T24细胞摄取外泌体(图6a),结果显示,hUCMSCs来源的外泌体能够将miR-139-5p传递到T24细胞(图6b-d)。为了确定外泌体传递miR-139-5p的影响,将T24细胞与过表达miR-139-5p的hUCMSCs衍生的外泌体共培养。EdU(图6e), TUNEL(图6f)Transwell(图6g,h)结果表明,细胞增殖,迁移和入侵的能力都被抑制, 而与外泌体的缺失相比, Exo-NCmimic、Exo-miR-139-5p-mimic和Exo-NC-inhibitor转染后可促进细胞凋亡。与miR-139-5p mimic转染的hUCMSCs衍生的外泌体共培养的T24细胞中,N-cadherin、Vimentin、SNAIL、Bcl-2和PCNA蛋白表达减少,E-cadherin和Bax蛋白表达增加(图6i)。综上所述,miR-139-5p的传递抑制了T24细胞的增殖、侵袭和迁移能力,同时通过hUCMSCs衍生的外泌体加速T24细胞的凋亡。

图6 hUCMSCs来源的外泌体miR-139-5p抑制膀胱癌细胞增殖潜能并诱导细胞凋亡
7. hUCMSCs来源的外泌体miR-139-5p抑制体内膀胱肿瘤的发生
最后,为了证明miR- 139-5p在hUCMSCs来源的外泌体体内的抑瘤作用,将裸鼠皮下注射T24细胞,建立皮下移植瘤模型,且验证了miR-139-5p成功递送至肿瘤组织(图7a)。如图7b-d所示,hUCMSCs来源的外泌体降低了移植瘤的体积和重量,在注射过表达miR-139-5p的hUCMSCs来源的外泌体的裸鼠中,肿瘤体积和重量的降低更为明显。采集裸鼠肿瘤组织,评估肿瘤组织中PRC1的表达模式,从hUCMSCs中提取的外泌体可以降低PRC1在肿瘤组织中的表达,而从hUCMSCs中提取的外泌体可以显著降低miR-139-5p在肿瘤组织中的表达(图7e)。同时,通过western blot检测肿瘤组织中凋亡、EMT和增殖相关因子的表达模式。结果显示,Exo-NC-agomir或ExomiR- 139-5p agomir的存在导致N-cadherin、Vimentin、SNAIL、Bcl-2和PCNA的表达降低,而E-cadherin和Bax的表达升高,然而,在对Exo-miR-139-5p agomir的反应中观察到更为显著的结果(图7f)。总之,这些数据表明,从hUCMSCs来源的外泌体中miR- 139-5p成功转移到T24细胞中,抑制其在裸鼠中的异种移植生长。

图7 从hUCMSCs来源的外泌体递送miR-139-5p抑制裸鼠膀胱癌细胞的致瘤性
总结:
该研究为miR-139-5p的抗肿瘤作用提供了新的思路,并进一步为基于外泌体的miR-139-5p传递系统在肿瘤细胞中的治疗策略提供了案例。结果表明,外泌体递送miR-139-5p有助于抑制肿瘤发生(图8),为潜在的抑制肿瘤发生的创新方案奠定了基础。

图8 miR-139-5p在膀胱癌中的作用及其分子机制示意图
参考文献:
Jia Y, Ding X, Zhou L, Zhang L, Yang X. Mesenchymal stem cells-derived exosomal microRNA-139-5p restrains tumorigenesis in bladder cancer by targeting PRC1. Oncogene. 2021, 40(2):246-261. doi: 10.1038/s41388-020-01486-7. Epub 2020 Oct 29. PMID: 33122828.






