鼻咽癌来源的细胞外囊泡miR-144刺激血管生成

越来越多的证据表明细胞外囊泡(EVs)通过促进实体肿瘤中肿瘤-内皮细胞之间的通讯来刺激血管生成。先前的研究表明miR-144是鼻咽癌(NPC)细胞来源的EVs中的内含物之一,但EVs miR-144对肿瘤内皮细胞和血管生成的影响尚不清楚。2021年3月发表于“Molecular Therapy”(IF=11.454)的文章“miR-144 delivered by nasopharyngeal carcinoma-derived EVs stimulates angiogenesis through the FBXW7/HIF-1a/VEGF-A axis”对此展开了研究。本研究旨在探讨肿瘤源性细胞外囊泡(EVs)在鼻咽癌血管生成中的作用。我们初步采集鼻咽癌活检标本。将人脐静脉内皮细胞(HUVECs)与鼻咽癌细胞分离的EVs共培养后,通过Transwell室系统和matrigel基血管生成实验评估其迁移、侵袭和血管样管形成。使用体内Matrigel血管生成模型检测EVs的促血管生成活性以及候选microRNA 。结果表明,与鼻咽癌正常组织相比,鼻咽癌组织中miR-144水平上调,且与CD31的表达呈正相关。此外,miR-144在鼻咽癌细胞EVs中高度富集,最终增强HUVECs和血管样管在体内和体外的迁移和侵袭。值得注意的是,miR-144通过抑制靶基因FBXW7和促进转录因子HIF1α依赖的血管内皮生长因子(VEGF-A)。综上所述,本研究强调了miR-144作为鼻咽癌肿瘤发生中细胞外促血管生成介质的作用。
技术路线
结果:
1)miR-144在鼻咽癌组织和细胞中上调
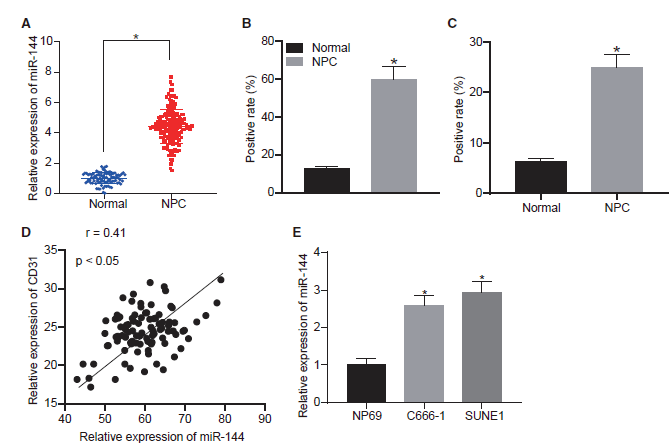
先前的文献强调了miR-144在NPC发展过程中的促癌作用。我们首先确定miR-144在NPC中的表达模式。采用qRT-PCR方法分析95例鼻咽癌活检标本和95例慢性鼻咽炎鼻咽活检标本中miR-144的表达。结果表明,miR-144在鼻咽癌组织中的表达水平高于在非癌性鼻咽组织中的表达水平(图1A),并通过原位杂交(ISH)进一步验证(图1B)。如图1C所示,相对于非癌性鼻咽组织,鼻咽癌组织中CD31的免疫组化染色增强。在鼻咽癌组织中,CD31的表达与miR-144的表达呈正相关(图1D)。随后,我们通过qRT-PCR比较了人鼻咽癌细胞系(C666-1和SUNE1)和鼻咽上皮细胞系NP69之间miR-144的表达水平。与预期的一样,C666-1和SUNE1细胞表现出相对于NP69更高水平的miR-144表达(图1E)。以上结果提示,miR144在鼻咽癌组织和细胞中呈高表达,与CD31表达呈正相关,表明miR144与肿瘤血管生成具有潜在的相关性。
2)miR-144在鼻咽癌细胞释放的EVs中高度富集
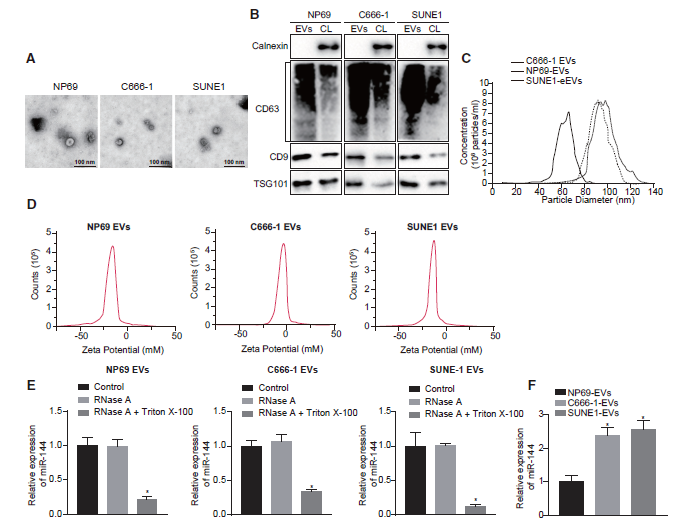
接下来,为了确定肿瘤分泌的miR-144是否具有通过EVs细胞外通信影响肿瘤-微环境串扰的能力,我们首先从C666-1、SUNE1和NP69细胞中分离EVs。透射电子显微镜(TEM)观察发现,纳米颗粒的直径为30 ~ 100 nm,每个囊泡呈杯状(图2A)。免疫印迹显示,与相应的细胞裂解液相比,这些来自C666-1、SUNE1和NP69细胞的纳米颗粒中存在常见的EVs特异性标记物,包括CD9、CD63和TSG101,而内质网膜蛋白calnexin明显缺失(图2B)。纳米颗粒示踪分析(NTA)进一步显示EV的平均直径为94.1 nm (C666-1细胞)、90.5 nm (SUNE1细胞)和68.5 nm (NP69细胞)(图2C)。此外,我们检测了C666-1、SUNE1和NP69细胞衍生EVs的表面电荷(图2D)。添加RNase对这三种细胞系的EVs中miR-144的表达没有影响,而Triton X-100处理的细胞中miR-144的表达明显降低,说明细胞膜对miR-144的表达具有保护作用(图2E)。结果表明,这三种细胞系的EVs具有稳定的膜态,对RNA具有保护作用。通过qRT-PCR检测EVs中miR-144的表达,结果显示miR-144在鼻咽癌细胞EVs中表达高水平(图2F)。这些发现为miR-144在npc细胞来源的ev中上调提供了证据。
3)miR-144通过EVs从鼻咽癌细胞进入HUVECs,增强了HUVECs的迁移和侵袭
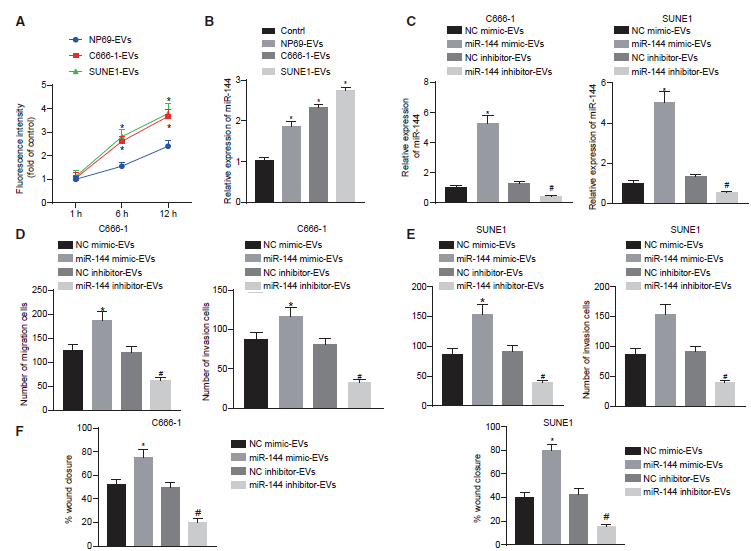
既往文献证实血管生成需要内皮细胞的迁移和成管能力。因此,我们试图研究NPC-EVs分泌的miR144对HUVECs迁移和侵袭的影响,以阐明肿瘤分泌的miR-144在血管生成中的作用。首先,在荧光显微镜下观察HUVECs在不同时间点对PKH67标记EVs的摄取。结果证实了HUVECs细胞质中存在PKH67信号,提示HUVECs已被HUVECs内吞。随着时间的推移,与NP69-EV组相比,C666-1-EV组和SUNE1-EV组的HUVECs逐步表现出更大程度的EV内化(图3A)。qRT-PCR结果显示miR-144在经C666-1和SUNE1释放的EVs处理的HUVECs中的表达较高(图3B)。为了进一步证明鼻咽癌细胞分泌的EVs miR-144对内皮细胞的影响,我们转染了C666-1和SUNE1细胞系,然后提取EV。qRT-PCR结果表明,暴露于miR-144模拟物处理的鼻咽癌细胞的HUVECs中miR-144上调,而暴露于miR-144 inhibitor处理的鼻咽癌细胞的HUVECs中miR-144下调(图3C)。Transwell实验结果表明,miR-144过表达EVs足以增强HUVECs的迁移和侵袭,而miR-144抑制EVs则表现出相反的趋势(图3D和3E)。此外,我们还通过伤口愈合实验检测HUVECs的增殖和迁移能力(图3F)。结果显示,与NC模拟EV组相比,miR-144模拟EV组细胞的创面愈合率升高,说明C666-1-和SUNE1细胞来源的EV miR-144均促进HUVECs的增殖和迁移。与NC抑制EV组相比,miR-144抑制EV组的细胞创面愈合率降低,提示C666-1-和SUNE1 EV细胞EV miR-144抑制后,HUVECs的增殖和迁移受到抑制。
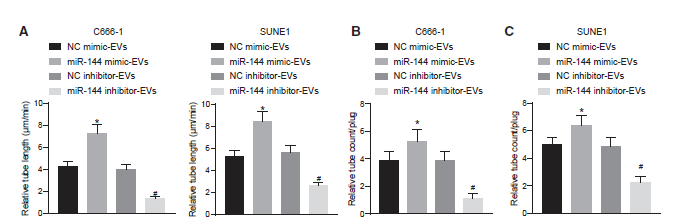
4)NPC-EVs通过转染miR-144增强体外和体内HUVECs的血管样管形成
我们评估NPC-EVs来源的miR-144对HUVECs血管样管结构的影响,以阐明肿瘤分泌的miR-144在血管生成中的作用。基于基质胶的体外血管生成实验(图4A)表明,miR-144模拟物处理的鼻咽癌细胞EVs显著促进了体外HUVECs的血管样管形成,这与miR-144抑制剂处理的鼻咽癌细胞EVs的结果形成了鲜明对比。接下来,为了进一步证明NPC-EVs来源的miR-144的促血管生成活性,我们在裸鼠中进行了体内Matrigel实验,以鉴定移植凝胶栓中新形成的血管(图4B和4C)。我们发现,来自miR-144模拟处理的鼻咽癌细胞的EVs增强了凝胶塞中新形成的增强血管,而来自miR-144抑制剂处理的鼻咽癌细胞的EVs则降低了血管,这与体外基质凝胶血管生成实验的结果一致。基于上述结果,NPC-EVs来源的miR-144增强了体外和体内HUVECs的血管样管形成。
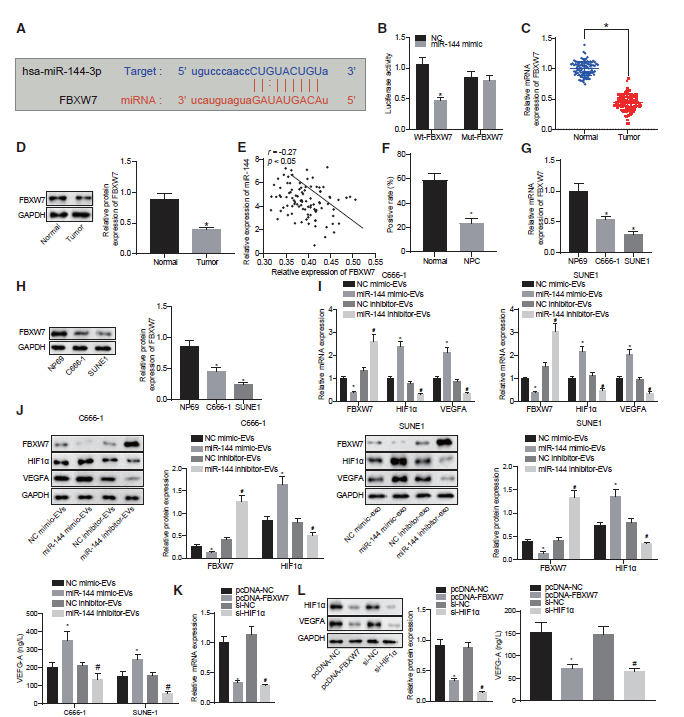
5)miR-144升高导致FBXW7下调,HIF-1α上调
近期研究表明,FBXW7在血管内皮细胞迁移和炎症、内皮屏障完整性和血管生成中发挥重要作用。随后,我们开始阐明miR-144在鼻咽癌中促血管生成功能的分子机制。我们预测了miR-144在3‘UTR FBXW7 mRNA的结合位点(图5A)。与miR-144 模拟物共转染后,FBXW7的野生型(WT)报告基因启动子的荧光素酶活性低于突变型(MUT) 3’UTR (图5B)。在mRNA水平和蛋白水平比较鼻咽癌组织和非癌性鼻咽组织中FBXW7的表达。如图5C和5D所示,FBXW7在鼻咽癌组织中的mRNA和蛋白表达低于非癌性鼻咽组织。Pearson相关分析显示,鼻咽癌组织中miR-144的表达与FBXW7的表达呈显著负相关(图5E)。我们还发现,相对于非癌性鼻咽组织,鼻咽癌组织中FBXW7的免疫组化染色程度下降(图5F)。与NP69细胞相比,C666-1和SUNE1细胞FBXW7的mRNA和蛋白表达水平均低于NP69细胞(图5G和5H)。既往研究表明,FBXW7/HIF-1α/ VEGF-A通路参与肿瘤血管生成。因此,我们假设miR-144的促血管生成功能是通过在癌变过程中调节FBXW7/HIF-1α/VEGF-A通路实现的。在本研究中,我们首先在mRNA水平和蛋白水平检测暴露于鼻咽癌EVs的HUVECs中FBXW7和HIF-1α。而HUVECs上清中用酶联免疫吸附试验(ELISA)测定VEGF-A浓度(图5I和5J)。结果显示,暴露于miR-144模拟物的EVs中FBXW7的表达减少,而HUVECs上清液中HIF-1α和VEGFA的表达增加。miR-144抑制剂的引入导致EVs中FBXW7表达增加,HIF -1α表达减少,HUVECs上清VEGF-A浓度降低。此外, FBXW7过表达或HIF-1α沉默导致HUVECs上清中HIF-1α表达和VEGF-A浓度降低(图5K和5L)。因此,miR-144可以靶向FBXW7,促进HIF-1α和VEGF-A的表达。
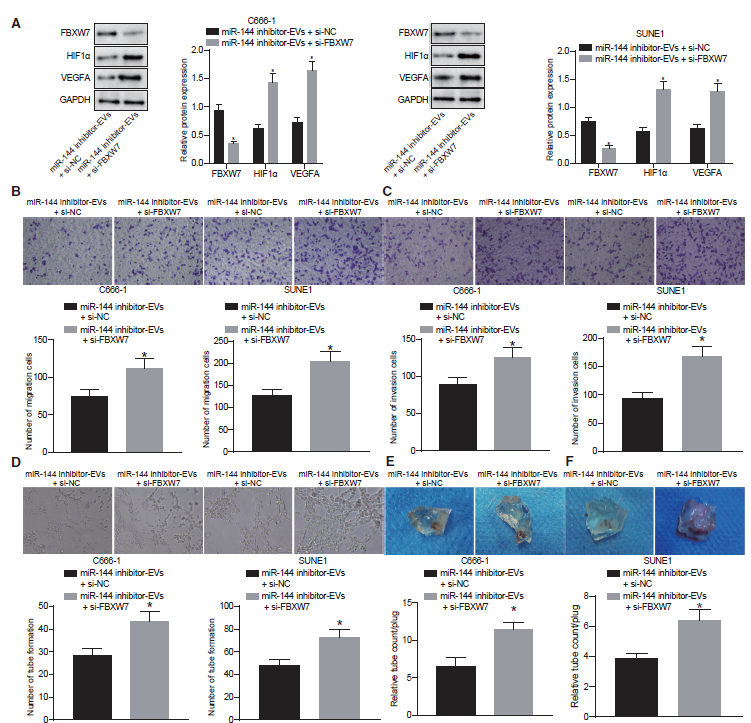
6)miR-144通过FBXW7/HIF-1α/ VEGF-A通路发挥促血管生成功能
我们确定NPC-EV来源的miR-144是否通过介导FBXW7/HIF-1α/VEGF-A通路促进HUVECs的血管样管形成。免疫印迹分析结果表明,在miR-144抑制剂处理的鼻咽癌细胞来源的EVs中,si-FBXW7处理导致FBXW7表达下调,HIF-1α和VEGF-A表达升高。这表明miR-144对HIF-1α/VEGF-A通路的影响是以FBXW7依赖的方式发生的(图6A)。同样地,我们还发现与单独抑制miR-144相比,联合抑制miR-144和FBXW7后,HUVEC的迁移(图6B)和侵袭(图6C)增强,以及血管样管形成(图6D)增加,这表明miR-144在体外依赖于FBXW7的促血管生成功能。体内Matrigel栓试验(图6E和6F)显示,与单独抑制miR-144相比,包含miR144模拟物处理过的鼻咽癌细胞EVs的凝胶栓在miR-144和 FBXW7抑制联合作用下,新形成的血管增强了,说明NPC-EV miR-144在体内依赖于FBXW7的促血管生成功能。
结论:总之,本研究的关键发现为EV来源的miR-144在体外鼻咽癌的进展中发挥促进作用提供了证据。具体来说,miR-144可以通过鼻咽癌细胞来源的EVs转运到HUVECs,最终强化其恶性表型,为鼻咽癌基于EVs的生物标志物和治疗方式的发展提供了一个新靶点。






