FGFR1信号参与k -ras驱动的肿瘤中PD-L1表达
研究背景
K-ras突变是驱动癌症发展与侵袭性恶性表型相关的主要遗传事件,而免疫检查点分子PD-L1的表达在逃避免疫监视的癌症中起关键作用。K-ras致癌信号与PD-L1表达的关系是一个需要进一步研究的重要领域。文章利用K-ras驱动的肿瘤体外和体内实验模型研究致癌的K-ras, PD-L1表达与氧化还原调节之间的关系。(Redox Biol, IF=9.986)
技术路线图

研究结果
1.致癌k-ras的激活诱导PD-L1的表达
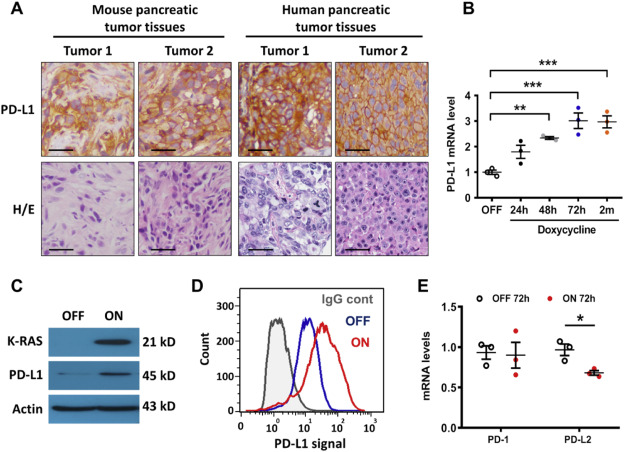
在小鼠和人胰腺癌组织中,k-ras驱动的胰腺癌组织中PD-L1的表达升高(Fig. 1A)。在T-Rex/K-ras细胞(强力霉素诱导的K-rasG12V表达细胞系统)中检测发现K-rasG12V的激活导致PD-L1mRNA的表达时间依赖性升高,并持续保持高水平(Fig. 1B)。WB和流式进一步验证(Fig. 1C和D),通过检测其受体PD-1和另一亚基PD-L2,K-rasG12V的激活导致PD-L1 mRNA的升高具有特异性(Fig. 1E)。
Figure 1
如图2A,HEK293T与T-Rex/K-ras/On细胞的条件培养基(CM)共培养导致PD-L1的表达显著升高,而T-Rex/K-ras/Off细胞(CM/Off)或强力霉素(Doxy)的CM均未诱导PD-L1表达增加,研究显示条件培养基中的分泌因子,被致癌K-ras调节从而刺激PD-L1表达。K-rasG12V导致EGF, FGF1, IL-1α,EGFR, FGFR1, IL1R1A 表达升高(Fig. 2B)。K-rasG12V/On 细胞中EGF, FGF1和IL-1α的分泌增加,EGFR 和FGFR1的表达升高(Fig. 2D)。EGF和FGF1刺激T-Rex/K-ras能够诱导PD-L1的表达,但是IL-1α没有改变(Fig. 2E–G)。
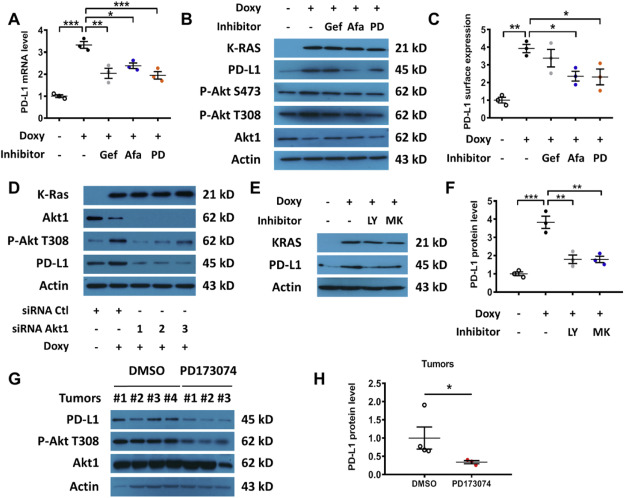
EGFR 抑制剂 (Gefitinib and Afatinib) and FGFR1抑制剂(PD173074)能够抑制K-rasG12V诱导的PD-L1表达(Fig. 3A)。Afatinib和PD173074的作用在48小时不显著(Fig. 3B–C)。K-rasG12V激活AKT(Fig. 3B). EGFR or FGFR抑制剂不能抑制PD-L1的表达。敲除AKT1抑制T-Rex/K-ras/On细胞中PD-L1的表达(Fig. 3D)。强力霉素诱导的K-ras引起Akt磷酸化水平的持续升高(图3B, D),表明K-ras激活Akt。PI3K抑制剂LY294002和Akt抑制剂MK-2206进一步验证AKT在K-rasG12V诱导的PD-L1的表达中的作用(Fig. 3E–F)。体内实验中,PD173074(FGFR1抑制剂)能够显示减少Akt的活化和PD-L1的表达(Fig. 3G–H)。
Figure 2
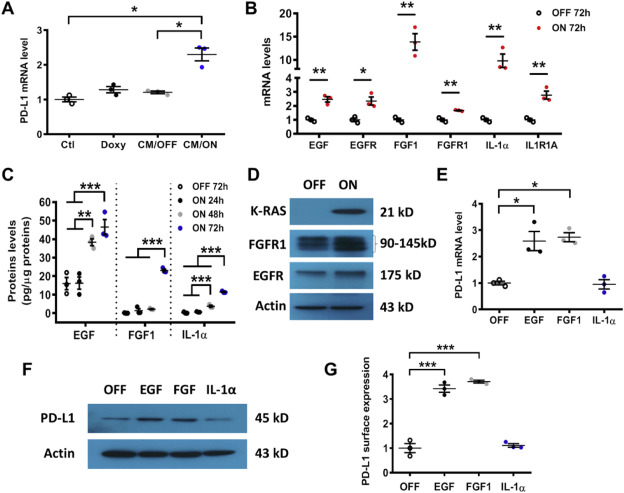
Figure 3
3. 在胰腺癌细胞中,FGFR1在K-ras诱导的PS-L1表达中发挥重要作用
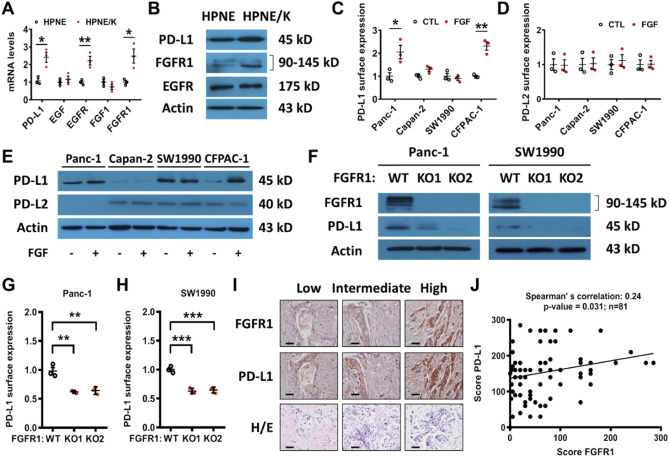
在HPNE/K-ras细胞中,PD-L1, EGFR and FGFR1 mRNA表达升高(Fig. 4A),而EGF和FGF1在HPNE细胞系中的表达没有变化(Fig. 4A)。WB显示HPNE/K-ras细胞中,只有FGFR1蛋白显著增加(图4B),提示FGFR1信号通路可能是介导PD-L1表达的主要途径。在Panc-1和CFPAC-1细胞中,FGF和EGF也能调节PD-L1的表达,而在SW1990和Capan-2细胞中则无此作用。敲除FGFR1,PD-L1的表达降低(Fig. 4F–H)。证明了FGFR1在胰腺癌中调节PD-L1表达的重要作用,并且PD-L1表达与FGFR1表达呈正相关
Figure 4
4.ROS介导K-ras诱导的PD-L1的表达通过FGFR1通路的激活
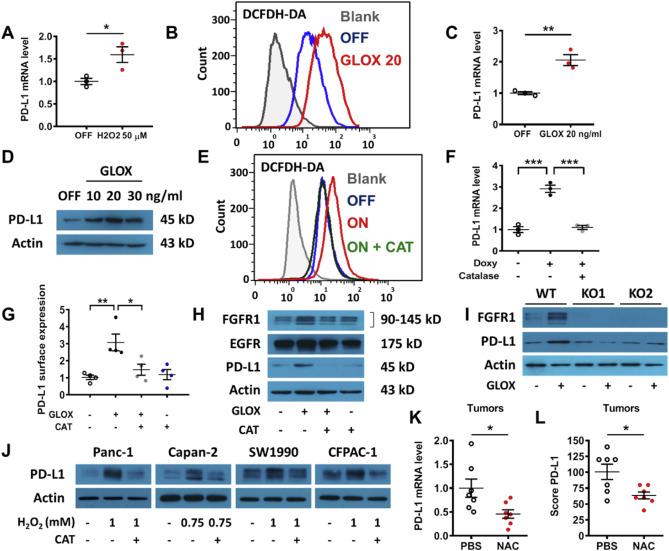
K-rasG12V/Off细胞经H2O2处理,PD-L1表达显著增加(Fig. 5A);加GLOX (葡糖氧化酶)导致细胞内ROS上调(Fig. 5B)。ROS压力导致PD-L1上调(Fig. 5C-D)。抗氧化酶过氧化氢酶(CAT)能将K-rasG12V/On细胞内ROS降低到与K-rasG12V/Off细胞相当的水平(Fig. 5E),并阻止K-rasG12V诱导的PD-L1上调(Fig. 5F)。GLOX增加与PD-L1表达相关的FGFR1的蛋白表达(Fig. 5H)。如图5I所示,GLOX产生的ROS仅能在FGFR1正常的K-rasG12V/Off细胞中增加PD-L1的表达,但敲除FGFR1后,这种作用几乎完全消失(图5I)。四种人胰腺癌细胞暴露于不同浓度的H2O2 (氧化应激)后,PDL1表达均有所增加,过氧化氢酶可以再次消除这种PD-L1的产生(图5J)。在体外和体内表达突变K-ras的小鼠胰腺癌模型中,抗氧化剂NAC降低了PD-L1的表达(图S6I)
Figure 5
5.在免疫活性小鼠和免疫缺陷小鼠中,FGFR1敲除影响肿瘤的生长
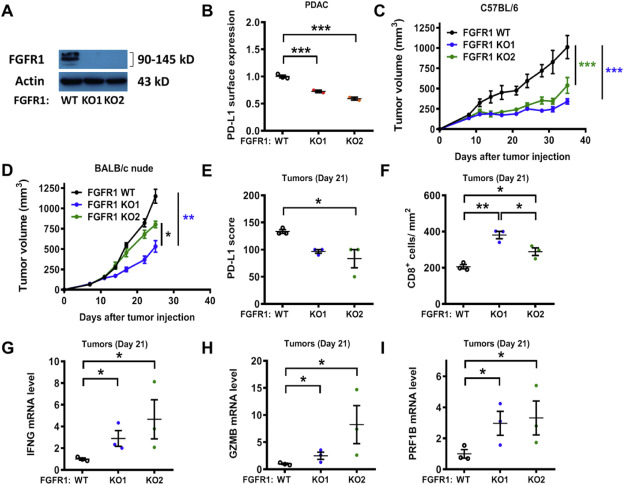
在小鼠胰腺癌KPC细胞系(K-rasG12V/p53R172H)中敲除FGFR1 (Fig. 6A)。与人FGFR1 KO细胞系的结果一致(Fig. 4F H),敲除小鼠PDAC细胞中的FGFR1也会导致体外PD-L1表达下降(Fig. 6B)。FGFR1的敲除严重损害了KPC细胞对肿瘤生长的作用,在免疫活性C57BL/6小鼠中(Fig. 6C)。KPC细胞接种于免疫缺陷裸鼠后肿瘤生长速度更快,而敲除FGFR1仅能中度延缓裸鼠肿瘤的生长(Fig. 6D)。通过敲除FGFR1抑制PDL1表达进一步增强了抗肿瘤生长的免疫功能。在裸鼠中观察到的FGFR1缺失细胞对肿瘤生长的中度抑制(Fig. 6D)可能反映了FGFR1信号通路的缺失。对免疫小鼠分离的肿瘤组织进行分析发现,FGFR1 KO肿瘤中PD-L1的表达降低了约30%( Fig. 6E)。由于肿瘤PD-L1的表达可能会影响T细胞的功能,因此对肿瘤组织中CD8+ T细胞浸润进行量化。与野生型FGFR1肿瘤相比,FGFR1 KO1和FGFR1 KO2肿瘤中浸润性T细胞数量显著增加,分别增加了1.85倍和1.41倍(Fig. 6F)。持续效应T细胞标记基因的表达在FGFR1 KO肿瘤显著增加,如IFN,颗粒酶B和穿孔素 (Fig. 6 G- I)。这些数据表明, 体内实验中,在K-ras驱动的的癌细胞中,敲除FGFR1减少PDL1的表达,促进免疫反应,从而抑制肿瘤的生长。
Figure 6
总结:
1.在体内和体外实验中, 致癌k-ras上调PD-L1的表达
2.ROS在调节k-ras诱导的FGFR1的激活中发挥重要作用。
3.在K-ras成熟癌细胞中,抗氧化酶能够调节PD-L1的表达
4.抑制FGFR1的表达增强CD8+T细胞的浸润和抑制肿瘤生长






