国自然之m6A甲基化
m6A甲基化是近些年最火热的研究方向之一,从2014到2019,立项数目一直呈上升趋势。
今天小编给大家介绍一篇关于m6A甲基化的文章。这篇文章发表于影响因子为8.986的molecular therapy上。本文主要探究METTL3在口腔鳞状细胞癌(OSCC)中的作用机制。在这项研究中,我们发现,METTL3通过BMI1 m6A甲基化促进OSCC增殖和转移,提示METTL3-m6A-BMI1轴可作为OSCC患者的预后生物标志物或治疗靶点。
结果:
1)OSCC中m6A甲基化酶的解除
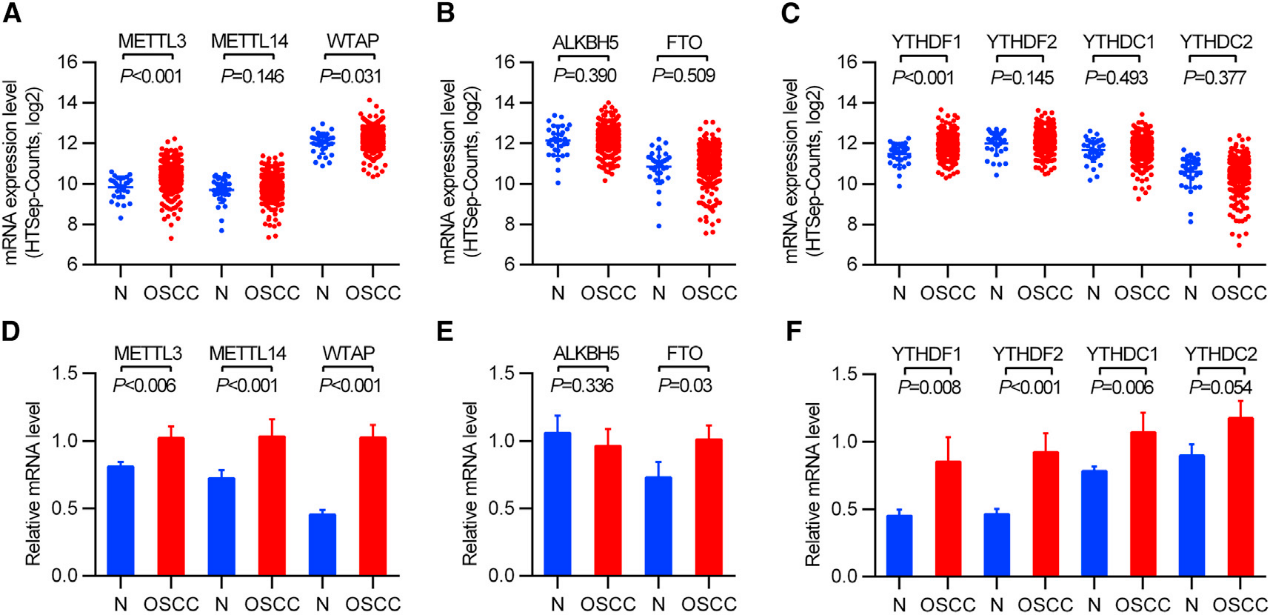
我们比较和分析了来自TCGA RNA测序数据库的正常组织和OSCC组织中主要m6A甲基化相关修饰酶的表达水平,发现在OSCC中,METTL3和WTAP显著上调,而METTL14的表达没有变化(图1A)。去甲基化酶(FTO或ALKBH5)和m6A相关阅读蛋白(除YTHDF1外)未显示出显著变化(图1B和1C)。为了进一步证实m6A甲基化修饰酶在OSCC的表达,在OSCC及其邻近的正常口腔粘膜组织中进行了qRT-PCR,结果显示在OSCC中,METTL3、METTL14、WTAP、FTO、YTHDF1、YTHDF2和YTHDC1的表达水平明显较高,而ALKBH5和YTHDC2的表达水平无明显变化(图1D-1F)。因此,我们推测OSCC病的发生可能与m6A去甲基化酶有关,尤其是METTL3的上调。
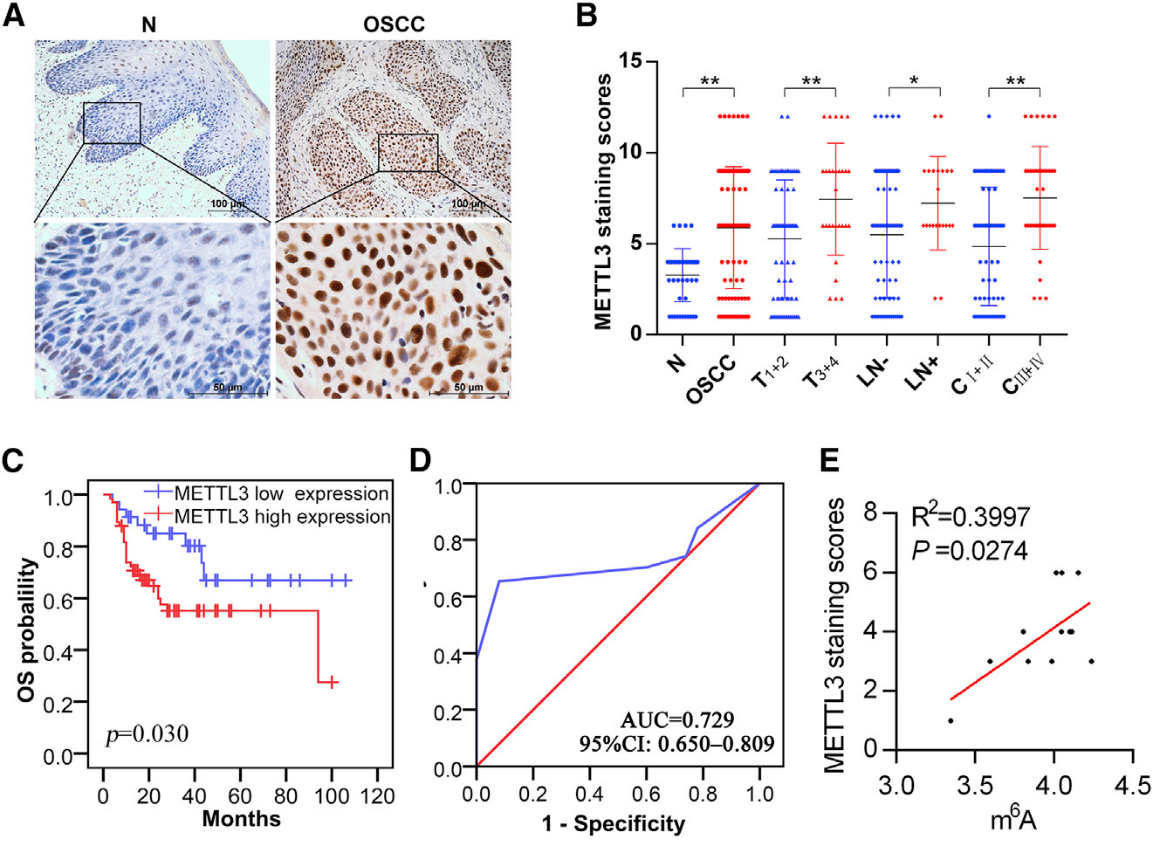
为了确定METTL3在OSCC发展中的作用,在两个OSCC队列中进行了免疫组织化学染色。对于训练样本集,发现METTL3在细胞核中表达,其表达在正常粘膜组织中很少检测到,但在OSCC组织中显著(图2A)。更高的METTL3表达水平与晚期肿瘤分期、晚期临床分期和淋巴结转移呈正相关(图2B)。Kaplan-Meier分析显示,METTL3高表达患者的总生存时间明显短于METTL3低表达患者(图2C)。此外,用ROC曲线评估了用于OSCC诊断的METTL3表达水平的潜在价值。如图2D所示,METTL3的曲线下面积为0.729,灵敏度为65.3%,特异性为92%。在6对人类OSCC和邻近的非癌样品组织中发现了METTL3蛋白水平和总m6A水平之间的显著相关性(图2E)。
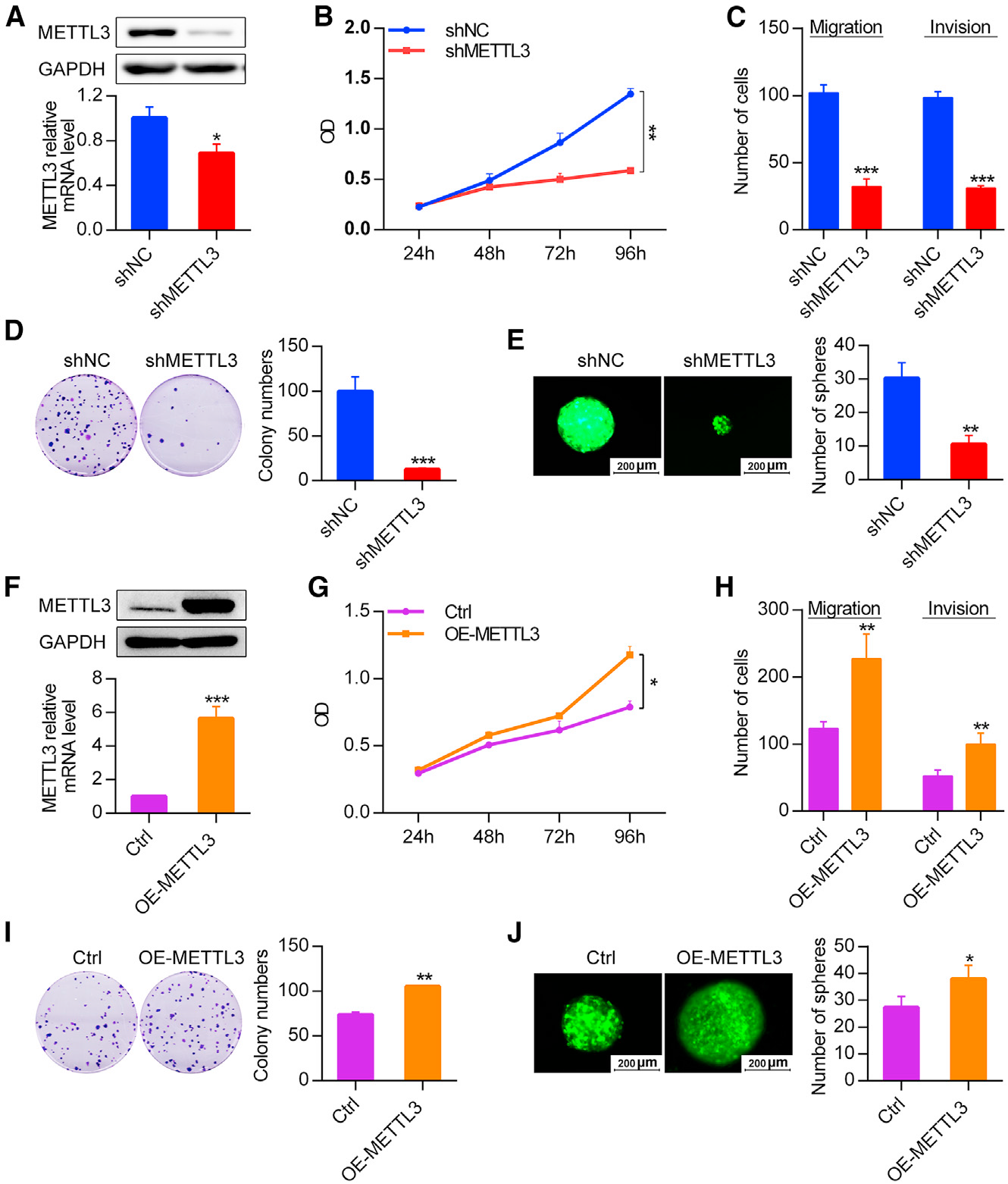
3)METTL3在体外促进OSCC细胞增殖、自我更新、迁移和侵袭
为研究METTL3在OSCC中的功能作用,利用METTL3 shRNA序列构建慢病毒,建立SCC9细胞中METTL3敲除模型。结果表明METTL3在蛋白和mRNA水平均被成功敲除(图3A)。稳定敲除METTL3后,SCC9细胞增殖能力呈时间依赖性下降(图3B),迁移和侵袭能力下降(图3C),减少了集落(图3D),形成了更少更小的球体(图3E)。此外,我们还利用慢病毒构建了METTL3过表达系统,以探讨METTL3在OSCC中的功能作用。在蛋白和mRNA水平上都证实了METTL3的上调(图3F)。上调SCC9细胞中METTL3表达,增强了细胞的增殖能力(图3G)和迁移侵袭能力(图3H)。过表达METTL3的SCC9细胞的集落形成能力(图3I)和成球能力(图3J)也显著增强。
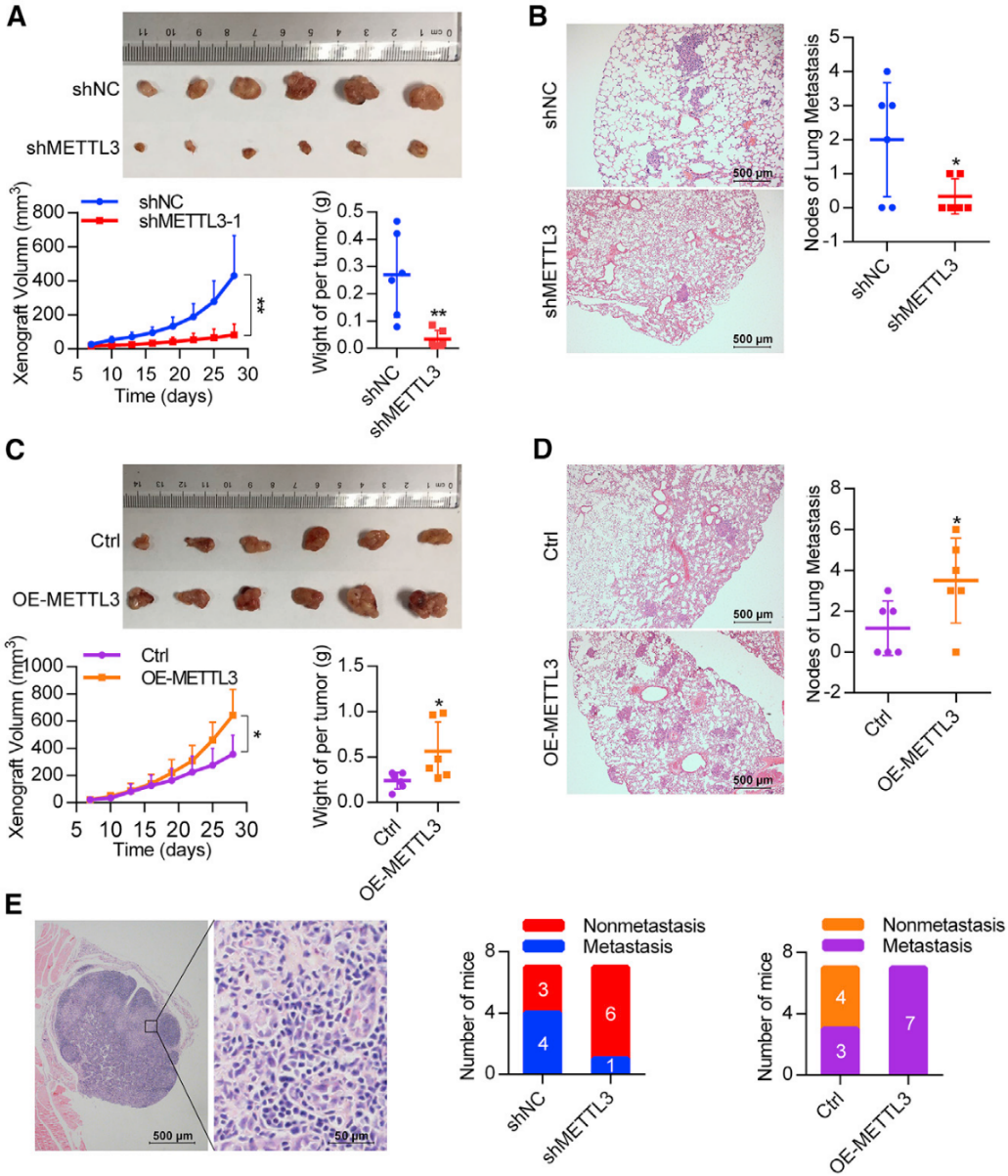
4)METTL3在体内促进OSCC肿瘤的生长和转移
为了研究METTL3在体内的促癌作用,我们将METTL3敲低细胞和非靶向shRNA对照细胞皮下注射到裸鼠体内。如图4A所示,METTL3稳定敲除组形成的肿瘤的体积和重量明显低于对照组shRNA和敲除组。移植28天后,METTL3表达抑制肿瘤生长80%。在肺转移模型中,与注射对照shRNA感染细胞的小鼠相比,注射METTL3 shRNA感染细胞的小鼠表现出转移结节数量显著减少(图4B)。另外,我们还将METTL3过表达细胞和模拟感染细胞注射到裸鼠皮下,发现METTL3过表达组的肿瘤体积和重量明显高于对照组(图4C)。肺转移模型显示,与对照组相比,METTL3的过表达导致肺转移结节显著增加(图4D)。此外,在淋巴结转移模型中(图4E),基因敲除导致淋巴结转移显著减少。METTL3过表达显著增加淋巴结转移。因此,我们得出结论,METTL3可能作为一个癌基因,促进OSCC生长和转移。
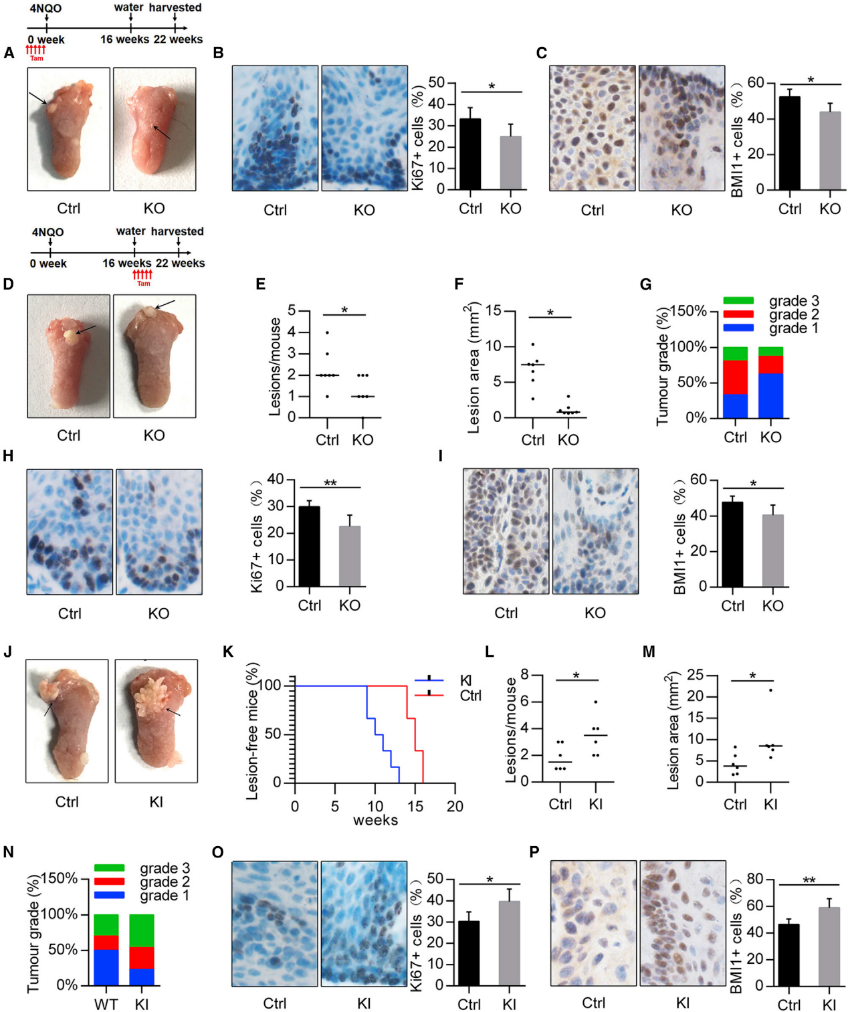
5)METTL3增强了口腔的化学致癌作用
为了进一步验证METTL3在体内的致癌作用,我们将METTL3fl/fl小鼠与K14 CreER小鼠杂交,产生了一个它莫西芬介导的条件性METTL3基因KO小鼠模型。首先,为了检查METTL3的缺失是否预防或减少4-硝基喹啉1-氧化物(4NQO)诱导的小鼠OSCC癌发生,在给予4NQO之前,给Mettl3cKO and Mettl3Ctrl小鼠注射tamoxifen。在最初的4NQO治疗22周后,对小鼠实施安乐死(图5A)。我们发现对照组小鼠以100%外显率(6/6)发展为OSCC,并且仅有33.3% (2/6)的Mettl3cKO小鼠发展为轻度发育不良,这表明METTL3缺失可以降低体内OSCC的发生率。此外,我们检查了两组中Ki67的表达,发现与对照组相比,Mettl3cKOOSCC组中Ki67受到抑制(图5B)。接下来,我们研究了丢失METTL3是否能抑制OSCC进程。结果表明,在Mettl3Ctrl和Mettl3cKO小鼠中口腔中的临床可见病变的数目是2.9±1.0和1.25±0.7(图5E)。值得注意的是,与对照组小鼠相比,Mettl3cKO小鼠显示OSCC损伤面积减少,组织病理学分级降低(图5F和5G)。一致的是,与对照组小鼠相比,Mettl3cKO小鼠的OSCC病变的增殖活性降低(图5H)。这些结果表明,在OSCC形成之前或之后,METTL3的损失导致抑制小鼠口腔区域恶性肿瘤的发展。
与之互补的是,我们的肿瘤发病率研究显示,Mettl3 KI导致小鼠早期OSCC的出现(图5K)。定量分析显示,Mettl3cKI小鼠的病灶数量和病灶面积均高于对照组(图5L和5M)。4NQO处理下Mettl3cKI小鼠舌部发生OSCC的比例为46.15%,对照组舌部仅出现30%的OSCC形成(图5N)。此外,与对照小鼠相比,Mettl3cKI小鼠的增殖增加(图5O)。这些数据表明,口腔上皮细胞中的Mettl3 KI可增强肿瘤易感性和恶性程度。
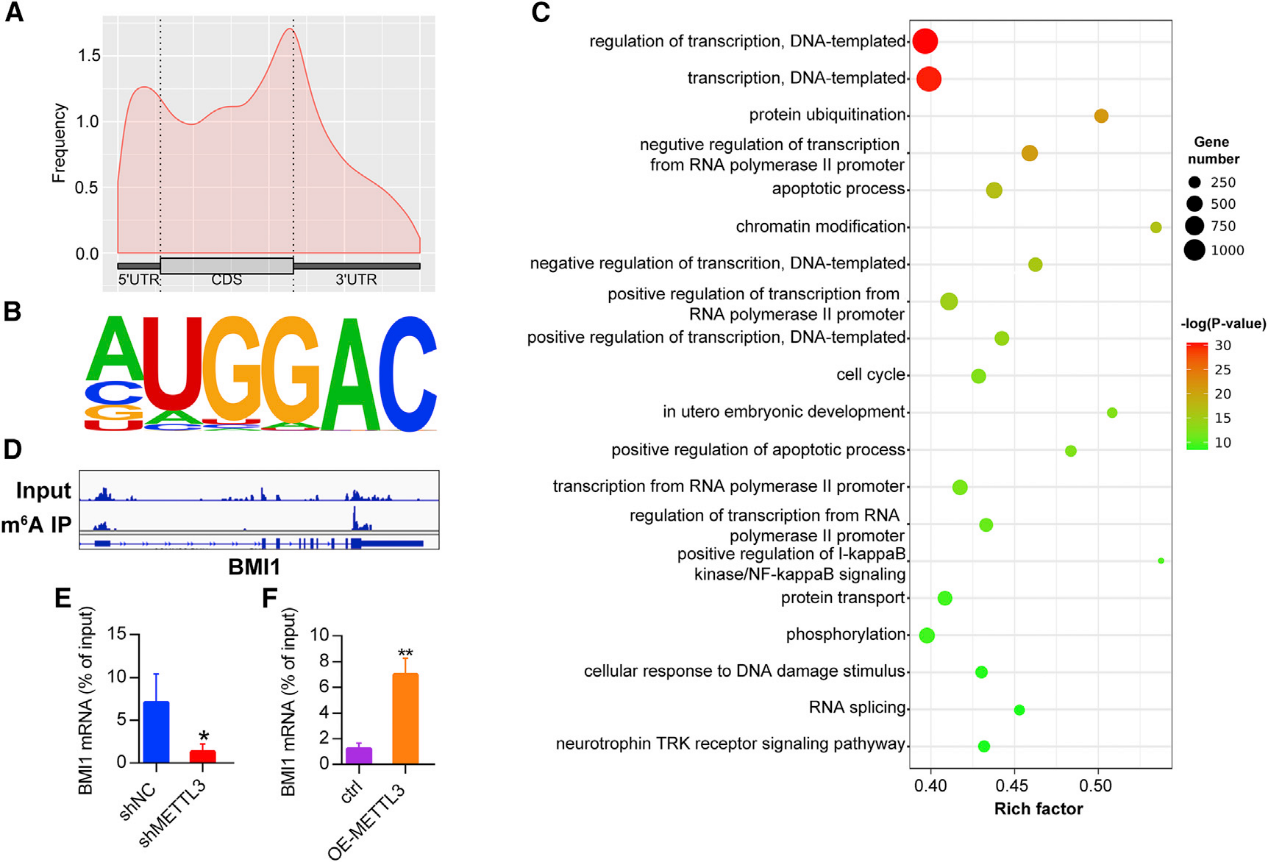
6)MeRIP-Seq/MeRIP-qRT PCR鉴定BMI1为METTL3下游靶点
为了确定OSCC的m6A分子生物学靶点,我们用OSCC细胞系HSC3进行了m6A MeRIP-seq。元基因分析显示m6A峰主要富集在翻译终止位点附近(图6A)。在OSCC细胞系中鉴定出AUGGAC基序(图6B)。GO分析显示m6A修饰的基因在RNA转录和蛋白质泛素化、染色质修饰和细胞周期的调节中是丰富的(图6C),这表明m6A可能对OSCC有深远的影响。可视化分析显示m6A峰富集在BMI1基因的终止密码子附近(图6D)。此外,MeRIP-qRT PCR分析显示,BMI1 m6A 修饰在敲除METTL 3后显著降低(图6E),而在METTL 3过表达时升高(图6F),这表明在OSCC m6A修饰可以调节BMI1。
7)METTL3介导的m6A修饰促进了BMI1 mRNA的翻译,增强了OSCC的增殖和转移
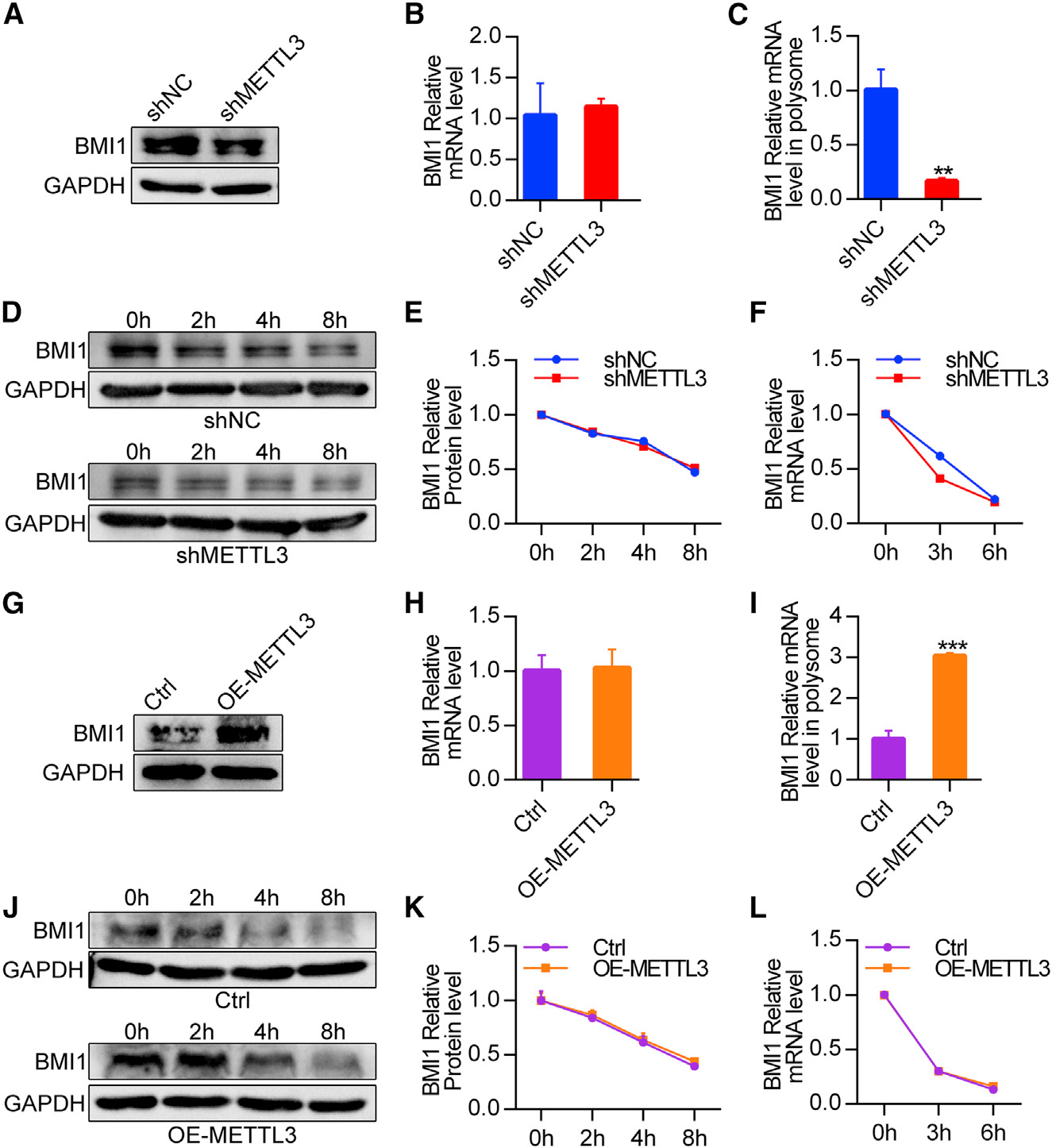
为了研究OSCC BMI 1 m6A修饰的分子机制,我们首先在SCC9细胞中敲除了METTL3,发现METTL3的敲除降低了BMI1蛋白的表达,而没有改变其基因水平(图7A和7B),这表明METTL3可以在转录后水平调节BMI1的表达。事实上,敲除METTL3显著降低了BMI1基因在主动翻译的多聚体部分中的比例(图7C),但对其基因稳定性和蛋白质降解率几乎没有影响(图7D-7F),这表明METTL3介导的m6A修饰是BMI1基因有效翻译所必需的。同时,我们发现在SCC9细胞中过表达METTL3增加了BMI1蛋白的表达(图7G),但没有增加其mRNA水平(图7H)。METTL3过表达增加了多聚体结合BMI1基因的水平(图7I),但没有改变BMI1基因的稳定性或蛋白质降解率(图7J–7L)。因此,这些数据揭示了在OSCC中,METTL3介导的m6A修饰促进了BMI1 mRNA的翻译。此外,与对照组相比,BMI1的表达在Mettl3cKO OSCC中受到抑制(图5C和5I),而BMI1的表达在Mettl3cKO OSCC小鼠中与对照组相比有所增加(图5P)。
8)METTL3识别BMI1 3’ UTR上的m6A残基,并在与m6A reader IGF2BP1的合作下促进BMI1翻译
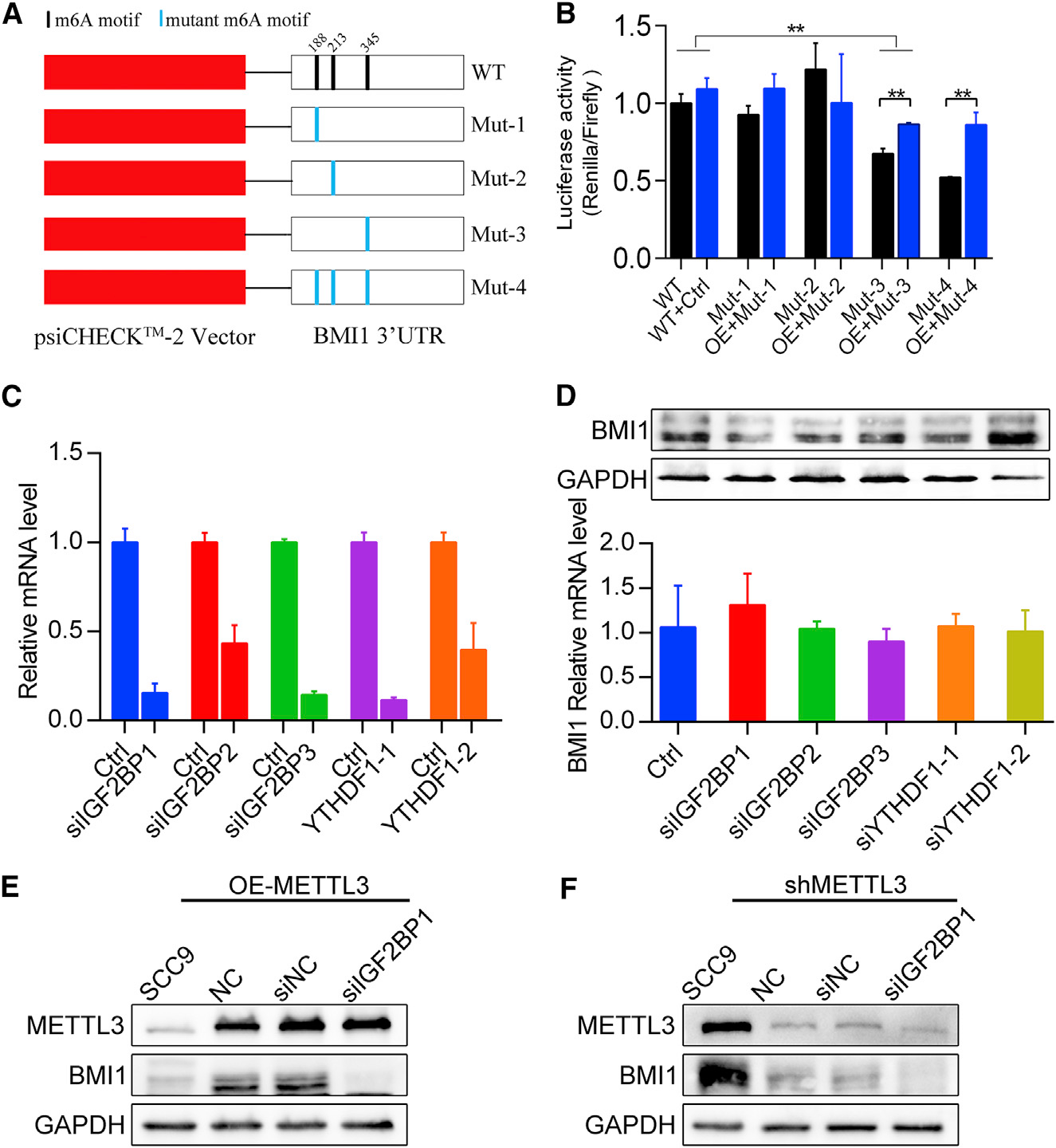
为了进一步探索OSCC BMI1 m6A介导的转录后调控的分子机制,我们进行了荧光素酶报告子和诱变分析。如图8A和8B所示,与用携带突变BMI1 3’UTR (Mut3,Mut4)的质粒转染的细胞相比,用野生型BMI1 3’UTR转染的细胞显著增加了荧光素酶活性,并且与METTL3过表达质粒共转染的细胞也显著增加了荧光素酶活性。接着,为了了解m6A读码器如何在OSCC中促进BMI1翻译,用不同siRNA的m6A读码器转染SCC9细胞。如图8C–8F所示, BMI1蛋白的表达水平在转染IGF2BP1 siRNA的SCC9细胞中显著降低(图8D)。此外,IGF2BP1敲除降低了METTL3过表达SCC9细胞中BMI1蛋白水平(图8E)。此外,敲除METTL3和/或IGF2BP1协同降低BMI1蛋白水平(图8F)。综上所述,在与IGF2BP1的合作下,METTL3促进了BMI1在OSCC中的翻译。