铁稳态与铁死亡的调控研究
栏目:最新研究动态
发布时间:2021-01-27
在大多数生物体中,铁稳态对生存至关重要。在生理条件下,肝脏感知机体的全身铁含量,并根据这种铁含量实时产生激素铁调素,以维持铁稳态。
导语:在大多数生物体中,铁稳态对生存至关重要。在生理条件下,肝脏感知机体的全身铁含量,并根据这种铁含量实时产生激素铁调素,以维持铁稳态。主要的铁调节激素-铁调素调节铁的摄取和再循环。近日,一篇关于铁稳态的研究吸引我们的注意。

(IF= 13.493)
研究思路:
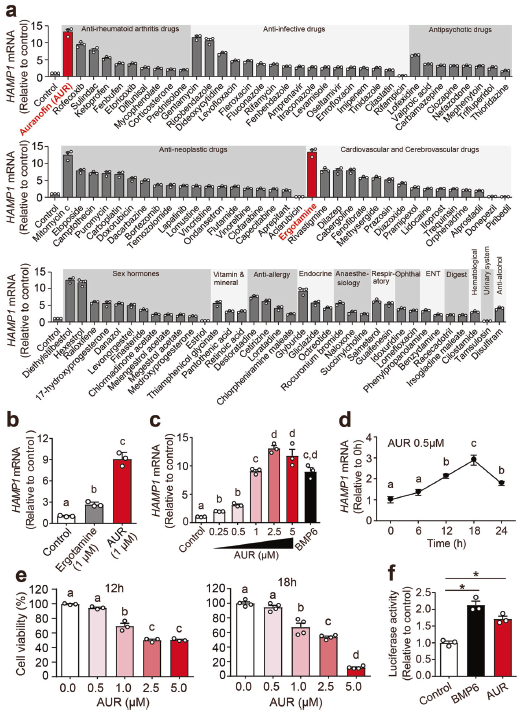
结果:1. AUR是体外铁调素表达的强效诱导剂
在肝癌细胞Huh7中以5 μM浓度筛选640种FDA批准药物,发现共有100种药物显著上调铁调素表达,6种药物显著下调铁调素表达。基于其临床应用,在上调铁调素表达的100种药物中,抗类风湿性关节炎药物AUR和心脑血管药物ergotamine均诱导Huh7细胞中铁调素表达最高。在1 μM低浓度下,AUR处理比ergotamine处理更有效地上调铁调素表达。高浓度AUR(≥1 μM)处理Huh7细胞12或18h可显著降低细胞活力,选择性激活HAMP1表达。
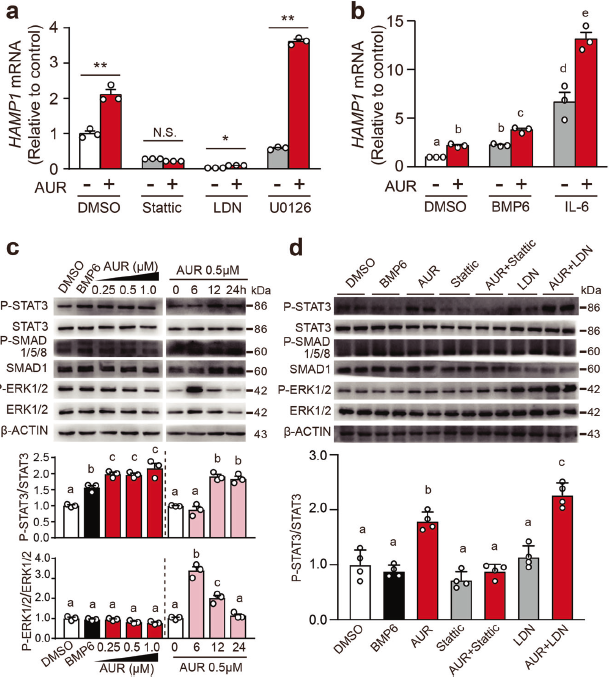
2. AUR通过JAK2-STAT3途径上调铁调素的表达
接下来探究AUR对HAMP1的影响是否由典型的铁调素调节途径介导。BMP信号抑制剂LDN193189或STAT3抑制剂Stattic预处理细胞可阻断AUR上调Huh7细胞铁调素表达的能力,但MEK1/2抑制剂U0126可显著增加AUR上调铁调素表达的能力。用AUR和BMP6或IL-6共同处理细胞有协同作用。此外,AUR处理显著增加了磷酸化STAT3水平,Stattic预处理降低了AUR处理Huh7细胞中的磷酸化STAT3和磷酸化SMAD1/5/8水平;相反,LDN193189预处理起抑制作用。Stattic和LDN193189均不影响磷酸化ERK1/2水平。这些数据表明AUR激活JAK2/STAT3通路,但不激活BMP/SMAD通路。
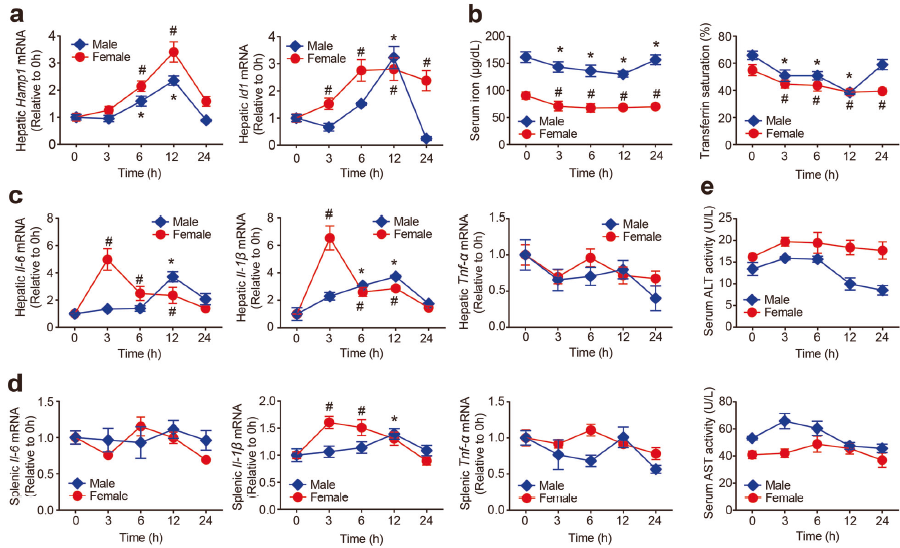
3. 急性AUR处理可上调小鼠铁调素表达并影响铁代谢
C57BL/6 J小鼠注射AUR并测定肝脏Hamp1,发现AUR处理上调小鼠肝脏铁调素表达,也上调Smad4的另一个下游靶点Id1,显著降低血清铁和转铁蛋白饱和度水平。AUR处理小鼠中肝脏IL-6 mRNA以及肝脏和脾脏IL-1βmRNA水平在3h达到峰值,肝脏和脾脏Tnf-α表达不受AUR影响,AUR在改变肝脏铁调素、血清铁以及肝脏和脾脏IL-6和IL-1β水平方面的作用存在性别特异性差异。AUR治疗未引起肝毒性,因为血清ALT和AST水平保持不变。
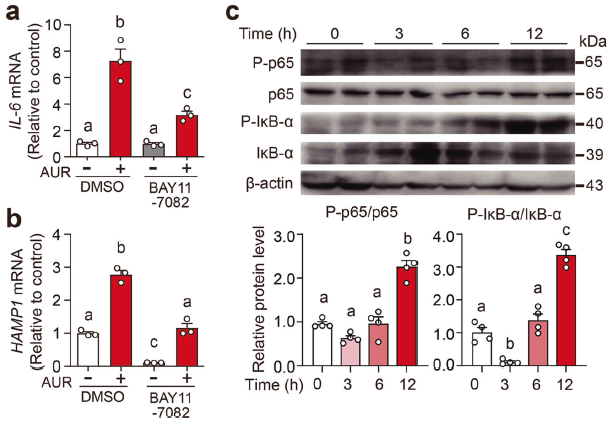
4. AUR通过NF-κB激活IL-6/铁调素轴
AUR可有效上调Huh7细胞中IL-6和HAMP1 mRNA水平,当用NF-κB抑制剂BAY11-7082预处理细胞时,这种上调显著减少,表明NF-κB在介导AUR效应中起关键作用。AUR治疗增加雄性小鼠肝脏磷酸化p65和磷酸化IκB-α的水平。这些表明,在人肝细胞和小鼠中,AUR通过NF-κB/IL-6途径诱导铁调素表达。
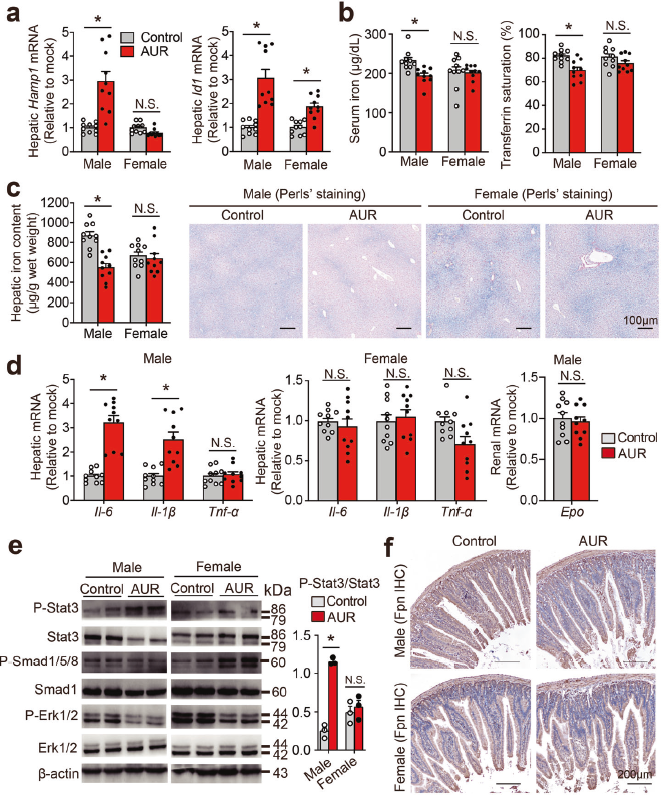
5. 长期AUR治疗可降低雄性Hfe基因敲除小鼠的铁负荷
接下来测量Hfe−/−小鼠(遗传性血色病的经典模型)中AUR的影响。低剂量AUR处理雄性Hfe−/−小鼠可增加肝脏铁调素表达,降低雄性Hfe−/−小鼠的几个铁参数,包括血清铁浓度、转铁蛋白饱和度和肝脏铁,但对雌性Hfe−/−小鼠几乎无影响。AUR增加雄性Hfe−/−小鼠的肝脏IL6和IL-1βmRNA水平,雄性和雌性Hfe−/−小鼠的肝脏Tnf-α表达保持不变。
与这些结果一致,长期AUR治疗也增加雄性Hfe−/−小鼠的磷酸化Stat3水平。AUR治疗还显著降低了雄性Hfe−/−小鼠的MCH(平均红细胞血红蛋白量)和MCHC(平均红细胞血红蛋白浓度)。这种AUR-诱导的雄性Hfe−/−小鼠MCH和MCHC减少可能是由于铁调素表达上调所致。还发现AUR处理的雄性Hfe−/−小鼠十二指肠中铁转运蛋白降低,表明铁摄取降低。
与这些结果一致,长期AUR治疗也增加雄性Hfe−/−小鼠的磷酸化Stat3水平。AUR治疗还显著降低了雄性Hfe−/−小鼠的MCH(平均红细胞血红蛋白量)和MCHC(平均红细胞血红蛋白浓度)。这种AUR-诱导的雄性Hfe−/−小鼠MCH和MCHC减少可能是由于铁调素表达上调所致。还发现AUR处理的雄性Hfe−/−小鼠十二指肠中铁转运蛋白降低,表明铁摄取降低。
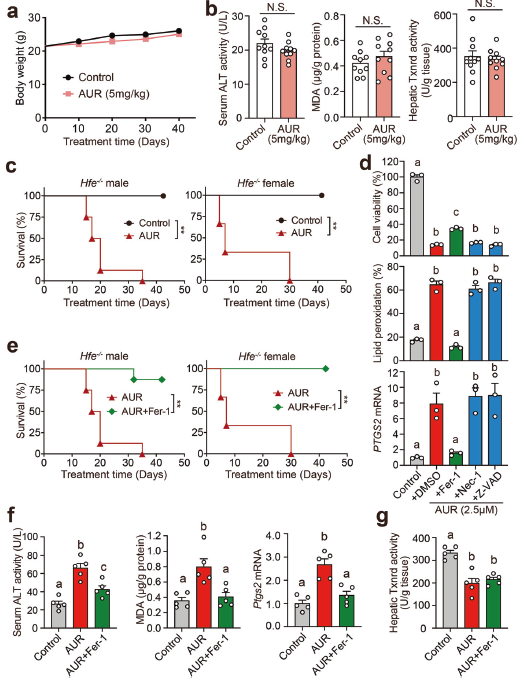
6. 高剂量AUR治疗诱导Hfe−/−小鼠肝铁死亡
AUR可能是几种肿瘤类型的潜在化疗药物,接下来测试AUR的安全性。雄性Hfe−/−小鼠长期5 mg/kg AUR给药未改变体重或血清ALT,当用高剂量AUR(25 mg/kg)治疗时,Hfe−/−小鼠在42天内显示雄性和雌性死亡率均为100%。为确定这种毒性作用下的细胞死亡类型,在高剂量AUR处理的Huh7细胞中筛选了几种不同形式细胞死亡的抑制剂,包括凋亡抑制剂Z-VAD-FMK(Z-VAD)、坏死抑制因子Necrostatin-1(Nec-1)和铁坏死抑制因子Ferrostatin-1(Fer-1)。发现Fer-1,而不是ZVAD或Nec-1,显著增加了AUR处理Huh7细胞的活力。高剂量AUR增加铁死亡的几种生物标志物,Fer-1显著降低了这种增加,但Z-VAD或Nec-1未降低,表明高剂量AUR选择性诱导肝细胞铁死亡。
为检测高剂量AUR是否在体内诱导铁死亡,用AUR和Fer-1处理雄性和雌性Hfe−/−小鼠。发现Fer-1可以显著挽救高剂量AUR处理的Hfe−/−小鼠的死亡率、血清ALT、肝脏丙二醛含量和Ptgs2 mRNA。这表明Fer-1靶向铁死亡可有效保护高剂量AUR诱导的肝毒性。与低剂量AUR相比,高剂量AUR对肝脏Hamp1 mRNA水平上调和血清铁、转铁蛋白饱和度和肝脏铁水平降低作用更强大。为探索AUR诱导铁死亡的潜在潜在机制,测量了众所周知的铁死亡抑制因子,发现高剂量AUR不改变肝脏GSH含量、总Gpx活性和(或)Gpx4表达。高剂量AUR显著降低氧化关键调节因子-总硫氧还蛋白还原酶TXNRD的活性(图6 g),Fer-1对高剂量AUR诱导的TXNRD活性降低无影响。TXNRD1特异性抑制剂TRi-144处理野生型C57BL/6J小鼠导致体重减轻,肝脏脂质过氧化积累,Ptgs2 mRNA水平和血清ALT活性增加,这可以被Fer-1完全挽救(,提示抑制TXNRD1也可诱导体内铁死亡。
总结:AUR具有双重功能,通过NF-κB/IL-6/STAT3信号通路增加铁调素表达;在高剂量下通过抑制硫氧还蛋白系统诱导铁死亡。AUR可作为治疗铁调素缺乏相关疾病(包括血色病)的一种新的治疗策略,尤其是在男性患者中。
上一篇:
外泌体、tRF研究解决方案与免费课题设计






