上皮-间质转化影响头颈癌中铁死亡
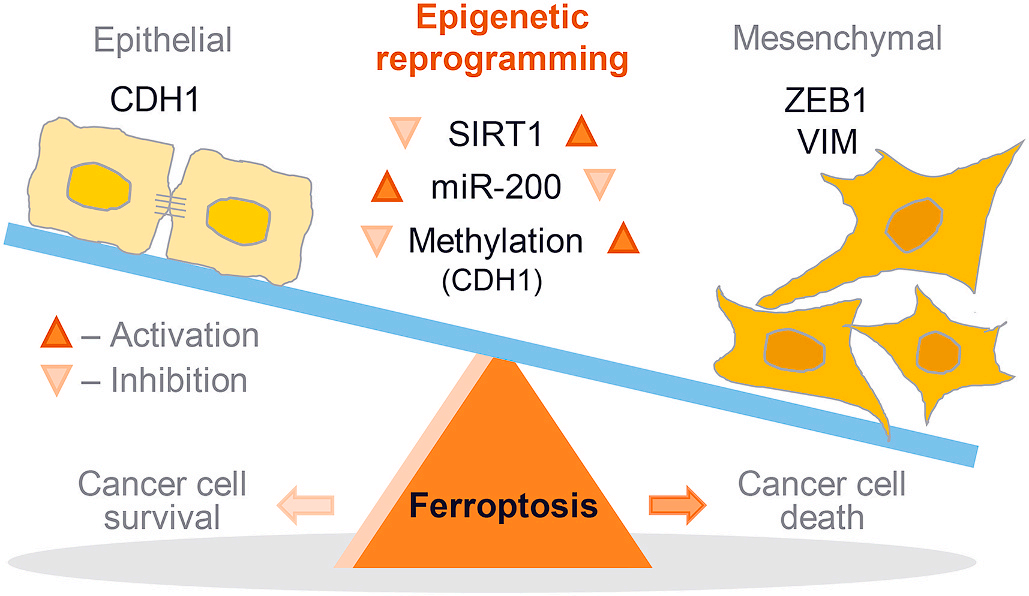
研究背景:铁死亡是一种铁依赖的脂质过氧化引发的新型细胞死亡方式。铁死亡是一种抑制抵抗癌症治疗的治疗方法,具有上皮-间充质转化(EMT)特性。EMT是上皮细胞打破细胞间和细胞间基质黏附状态的重要过程,赋予癌细胞化疗耐药性。因此,Jaewang Lee等人研究了EMT表观遗传重编程在促进头颈癌(HNC)细胞的铁死亡中的治疗潜力。(Redox Biology IF= 9.986)
技术路线图:

研究结果:
1.细胞密度和EMT标记物与铁死亡敏感性相关
首先在胱氨酸耗竭培养条件下进行细胞死亡试验,确定细胞密度是否会影响铁死亡的敏感。在HN4癌细胞中,PI阳性细胞占比与每孔细胞数负相关(图1A和B)。细胞脂质过氧化水平也随着HN4的增加而降低(图1 C)。结果表明,细胞密度与铁死亡敏感性有关。检测了6个HNC细胞系的细胞死亡证实,癌细胞密度越大,存活时间越长 (图1D)。E-cadherin上皮标志物在HN3、HN4、HN7和HN10中高表达,而间质标志物vimentin和ZEB1在HN6和HN9中高表达(图1E)。结果表明,EMT标记物的表达水平与铁死亡的敏感性相关(图1D和E)。在具有间质性特征的HN6和HN9细胞中,铁溶性诱导物RSL3暴露导致的细胞死亡显著高于其他具有上皮性特征的HNC细胞系 (图1F和G)。综上所述,这些数据表明向间充质性质的转变可能使癌细胞更容易受到铁胞作用的影响。
Figure1

2. E-cadherin调节铁死亡的诱导
转化生长因子(TGF-β)处理HN3和HN4细胞,诱导EMT。沉默CDH1诱导了ZEB1和vimentin的表达(图2A)。RSL3或磺胺嘧啶处理时,沉默CDH1使细胞更容易受到铁死亡诱导剂的诱导。CDH1沉默增强了细胞死亡的增加,这与暴露于RSL3或磺胺嘧啶的癌细胞中不稳定铁水平的增加是同时发生的(图2D)。CDH1过表达降低了ZEB1和vimentin在HN6细胞中的表达(图2G)。RSL3、磺胺嘧啶或胱氨酸耗竭处理HN6细胞时,4-HNE和PTGS2表达增加,但在过表达CDH1的细胞中,增加的表达减少(图2H)。过表达CDH1组细胞死亡降低 (图2I);细胞内不稳定铁,脂质过氧化,ROS生成的增加明显降低(图2 J K L); NAD/NADH比值下降 (图2N);而GSH水平升高(图2M)。这表明,在HN6和HN9中过表达CDH1可能增强具有间充质特性的癌细胞的抗氧化系统。采用小鼠模型移植显示,CDH1过表达时,肿瘤体积的减少程度低于经磺胺嘧啶治疗后的载体对照(图2O)。磺胺嘧啶处理后GSH含量降低,但NAD/NADH比值增加(图2P Q)。综上所述,结果表明控制E-cadherin在癌细胞中的表达可以调节铁死亡的易感性。
Figure 2

3. ZEB1的表达改变了癌细胞对铁死亡的敏感性
在HN6和HN9细胞中,沉默ZEB1诱导E-cadherin表达,抑制vimentin表达(图3A)。暴露于RSL3或磺胺嘧啶后,细胞活力减少 (图3B)。当使用RSL3、磺胺嘧啶或胱氨酸耗竭时,ZEB1沉默的癌细胞中LIP、脂质过氧化和ROS的增加也低于对照组 (图3C-E)。ZEB1在HN3和HN4细胞中过表达,诱导vimentin表达并抑制E-cadherin(图3F)。RSL3、磺胺嘧啶或胱氨酸耗竭处理HN4细胞时,4-HNE和PTGS2表达增加,但在过表达ZEB1的细胞中,表达增加显著(图3G)。过表达ZEB1,RSL3或磺胺嘧啶处理的pi阳性细胞明显增多,细胞存活率明显下降 (图3H、图I)。LIP、脂质ROS和胞浆内ROS的数量,NAD/NADH比值显著增加 (图3J L N)。GSH水平降低(图3M)。体内实验结果显示,过表达ZEB1组的肿瘤体积更小(图3O)。过表达ZEB1组,磺胺嘧啶处理后GSH含量下降,NAD/NADH比值升高(图3P和Q)。综上所述,结果表明,肿瘤细胞中ZEB1的调控能够调节铁死亡的易感性。
Figure 3

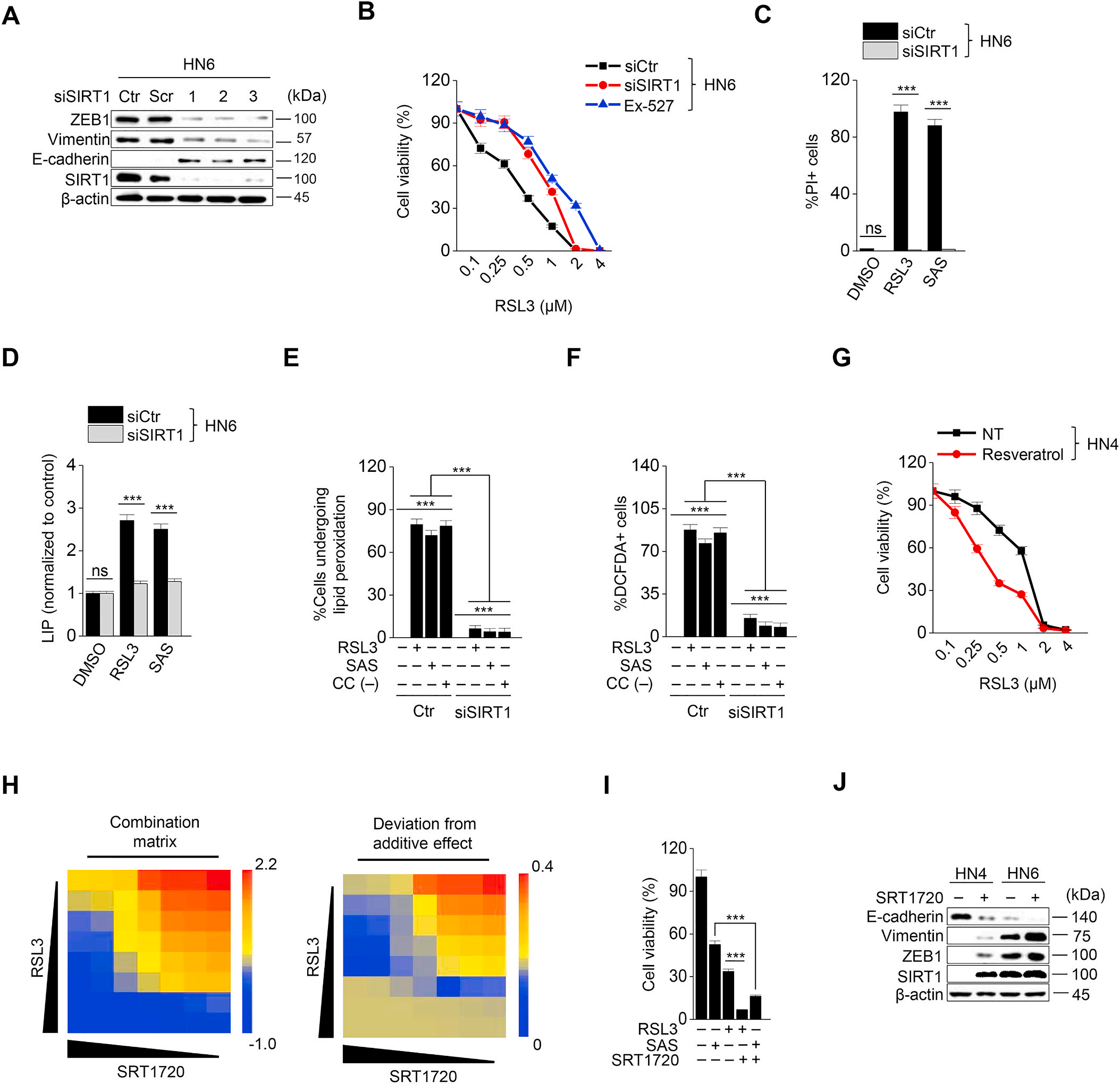
4. SIRT1的激活促进HNC细胞的铁死亡
探讨针对ZEB1的EMT的表观遗传重编程是否能够调节铁死亡。SIRT1通过激活ZEB1的功能调节EMT。在HN6和HN9癌细胞中, SIRT1沉默或Ex-527(SIRT1特异性抑制剂)处理降低了ZEB1和vimentin的表达,但增加了E-cadherin的表达(图4A)。与暴露于RSL3或磺胺嘧啶的对照组相比,SIRT1沉默或Ex-527治疗后的癌细胞细胞存活率显著提高,细胞死亡减少 (图4B、C)。此外,不稳定铁、脂质ROS和胞浆内ROS的增加比对照组细胞少(图4D F)。然而,SIRT1诱导剂白藜芦醇显著降低RSL3或磺胺嘧啶处理的HN3和HN4的存活率(图4 G)。在HN3和HN4中,RSL3或磺胺嘧啶与SIRT1特异性诱导剂SRT1720的组合比增加组合基质的对照更显著地降低了细胞存活率,特别是在高浓度组合下(图4H和I)。SIRT1720或白藜芦醇处理增加了ZEB1和vimentin的表达,但降低了E-cadherin的表达(图4J)。综上所述,这一结果表明,SIRT1在HNC癌细胞中的控制可能通过抗氧化能力减弱而影响铁死亡的诱导作用。
Figure 4
miR-200家族通过抑制ZEB1抑制EMT。首先转染miR-200家族抑制剂(图5A),然后在HNC细胞中检测RSL3、磺胺拉嗪或胱氨酸耗竭后细胞存活率、LIP和ROS的生成。MiR-200家族抑制剂增加了ZEB1和vimentin的表达,但降低了E-cadherin的表达(图5B)。mir -200a抑制细胞中,HN3和HN4的细胞活力显著下降,而pi阳性细胞比例的增加多于对照组(图5 C和D)。与对照组相比,使用miR-200a inhibitor的细胞内不稳定铁、脂质过氧化和细胞内ROS水平显著升高(图5 E G)。结果表明, miR-200家族抑制剂在癌细胞中诱导的EMT可能增强了对铁死亡的敏感性。
Figure 5

6. 5-Azacitidine转变为上皮性质,减弱铁死亡敏感性
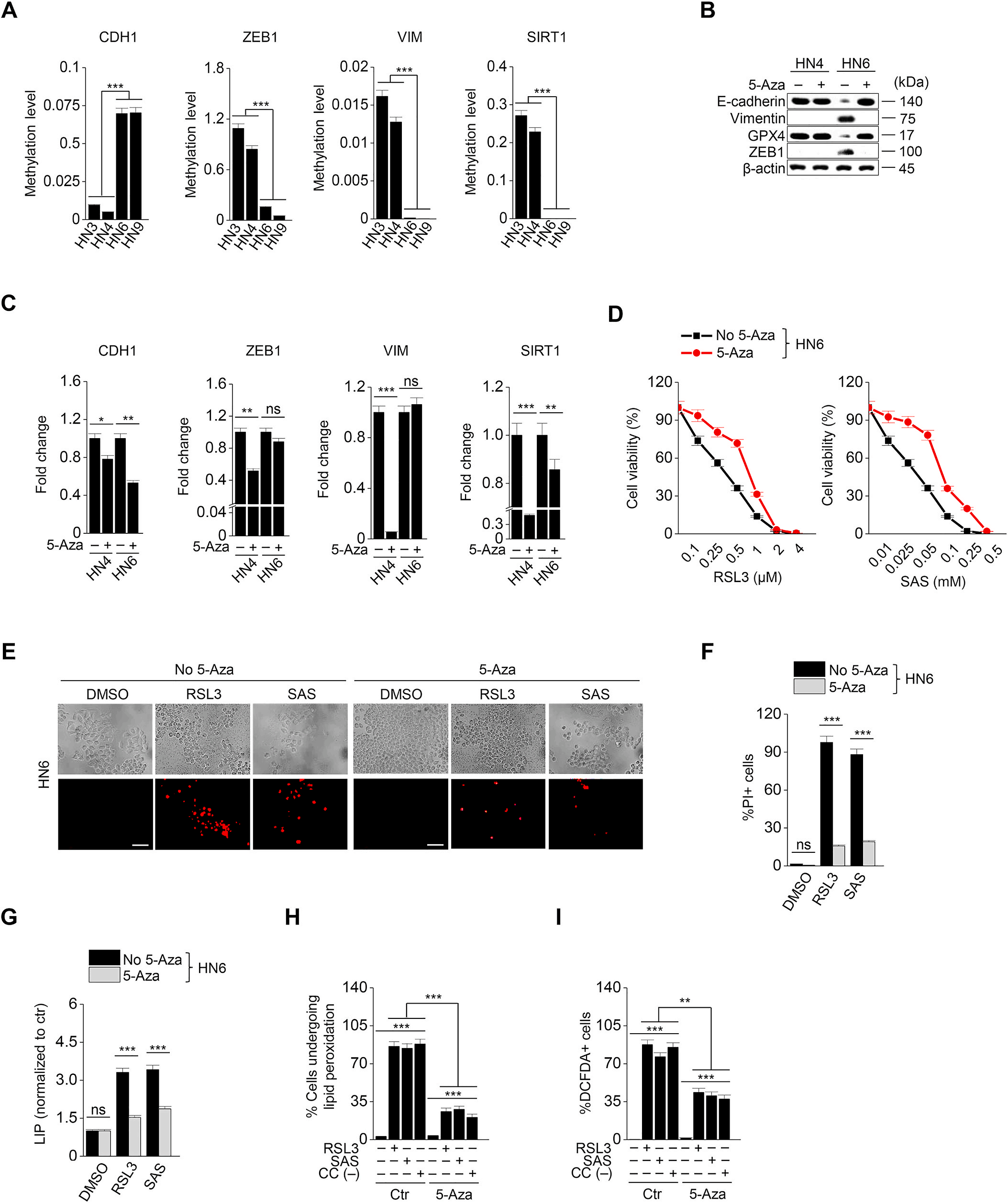
EMT受表观遗传学调控,文章中确认了EMT相关基因的甲基化水平。基因的甲基化水平与蛋白质的表达相反,如图1E所示。CDH1的甲基化水平在间质性的HN6和HN9中较高,而ZEB1、VIM和SIRT1的甲基化水平在上皮性的HN3和HN4中较高(图6A)。5-Azacitidine是一种去甲基化剂,已知可以预防EMT。5-Azacitidine用RSL3或柳氮磺吡啶处理HN4和HN6。5-azacitidine治疗诱导HN6细胞中CDH1甲基化水平降低和ZEB1,波形蛋白表达增加 (图6 B和C)。这也导致了RSL3或磺胺嘧啶治疗后的铁死亡减少(图6 D F)。在HN6细胞中,RSL3, 柳氮磺胺吡啶和胱氨酸耗竭引起的不稳定铁, 脂质过氧化, 胞质ROS的增加被5-Azacitidine减弱(图6G I)。然而,细胞死亡和存活率、不稳定铁和脂质过氧化水平在HN4之间无显著差异。表明5-Azacitidine可能通过去甲基化上皮标志物CDH1来降低铁亡诱导剂的敏感性。
Figure 6