饮食可通过翻译后修饰影响小鼠肠道微生物蛋白质组
美国哈佛大学Wendy S. Garrett课题组发现,饮食可通过翻译后修饰影响小鼠肠道微生物蛋白质组,从而调节肾功能。相关论文于2020年9月18日发表在《科学》杂志上。
慢性肾病的发病机制和治疗一直未得到充分的研究。许多饮食微生物组研究都集中在膳食纤维、脂肪和碳水化合物的影响上。虽然有5%到10%的氨基酸会到达结肠,而结肠是肠道细菌代谢的主要部位,但人们对饮食中蛋白质和氨基酸的具体作用知之甚少。在人类中,增加膳食蛋白会增加肠道细菌产生H2S、吲哚和吲哚硫酸盐。在慢性肾脏病(CKD)小鼠模型中,研究人员发现高硫氨基酸饮食会导微生物色氨酸酶活性的致翻译后修饰。这降低了小鼠产生尿毒症毒素的活性并改善了CKD的进展。因此,饮食可以通过翻译后修饰来调节微生物群的功能,从而促进健康的宿主生理,而无需改变微生物群落组成。

据了解,CKD与肠道菌群之间的关联已被发现,但有关机制仍未解析。在人类中,饮食蛋白会增加肠道细菌产生H2S、吲哚和吲哚酚硫酸盐的能力。后者是尿毒症毒素,H2S具有多种生理功能,其中某些功能是由翻译后修饰介导的。
技术路线:
一、饮食中的Saa和肠道菌群调节CKD小鼠肾脏损伤的严重程度
我们制定了等热量的饮食来代表小鼠对含硫氨基酸(Saa)的极端消费,与人类的消费相关,即低含量的蛋氨酸和半胱氨酸(参见表S1的饮食配方、材料和方法),但有足够的蛋氨酸,以避免蛋氨酸限制。
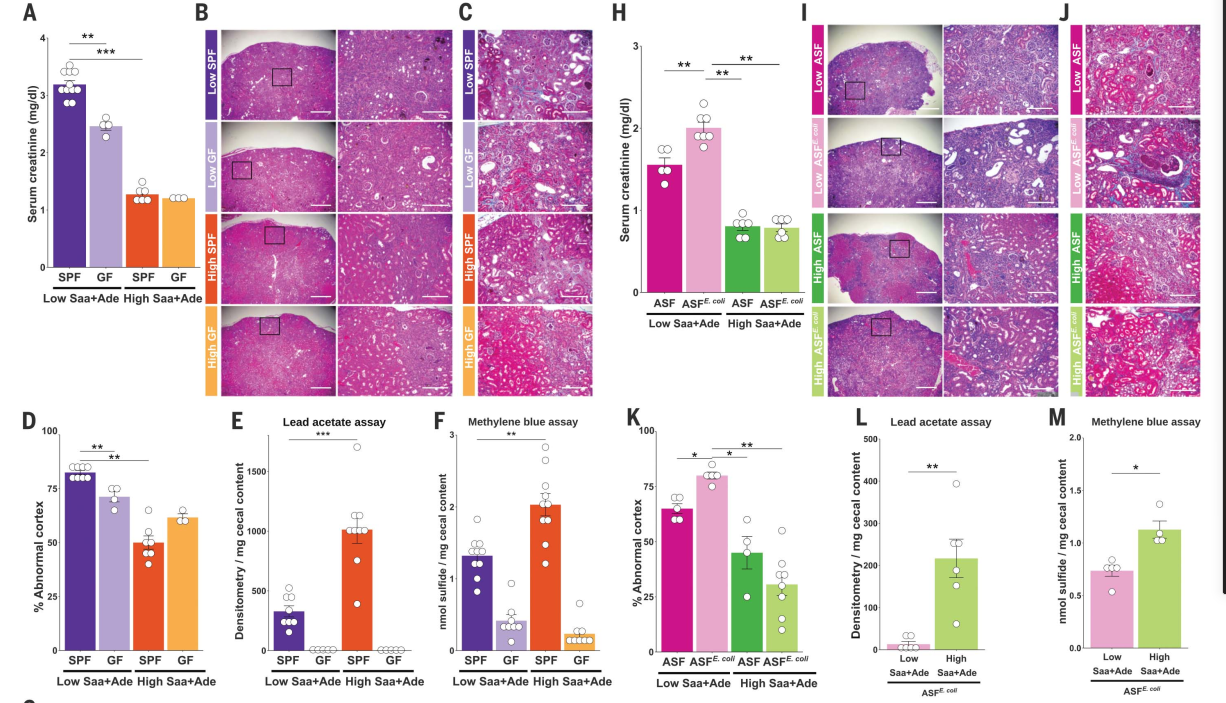
与小鼠相比high-Saa +adenine ,specific-pathogenfree (SPF)小鼠低Saa +腺嘌呤(Saa +adenine )饮食有明显增加血清肌酐水平(图1),以及更广泛和严重的肾皮质组织病理变化,包括管状扩张和辍学,和管周纤维化tubulitis,皮质晶体沉积(图1,B, D)。为了确定Saa的影响在多大程度上依赖于肠道菌群,我们将Saa+Ade饲料喂给生养的无菌种(GF)小鼠。与低saa +Ade日粮喂养的SPF小鼠相比,GF小鼠的血清肌酐和肾脏损伤明显降低,且GF小鼠和高saa +Ade日粮喂养的SPF小鼠具有相似的表型(图1,A至D)。高Saa饲料的SPF小鼠盲肠硫化物含量高于低Saa饲料的小鼠(图1,E和F)。不管Saa饲料如何,GF小鼠ceca的硫化物含量显著低于SPF小鼠(图1,E和F)。进一步分析PTRI全基因组测序数据集加强了这一发现,我们发现CKD患者样本中标准化大肠杆菌平均基因丰度高于非CKD对照(图1G)。
在低saa +Ade饮食中,ASF小鼠被大肠杆菌(ASFE)定植。与ASF小鼠相比,大肠杆菌(coli)血清肌酐水平更高,更广泛的小管炎、管状萎缩和水肿、管周纤维化和皮质结晶(图1,H - K)。与SPF小鼠一样,我们发现ASFE中盲肠硫化物含量更高。高、低saa +Ade饮食中的大肠杆菌小鼠(图1、L和M)。
总之,这些结果支持大肠杆菌与饮食中的Saa相互作用来调节肾功能
二、对大肠杆菌S-sulfhydrome 的表征表明TnaA是一种高度S-sulfhydrome 的蛋白质
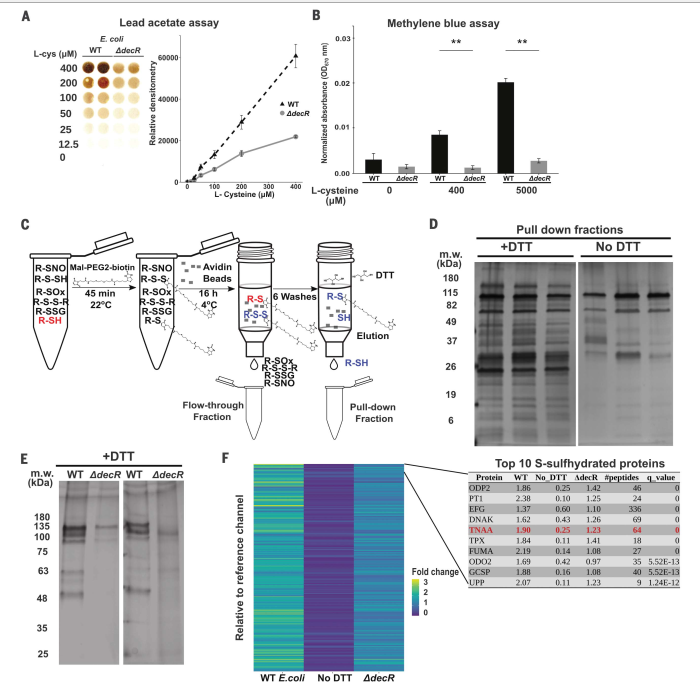
在lead acetate 检测试验中,无论喜氧或厌氧培养的大肠杆菌都能从半胱氨酸中以剂量依赖的方式产生硫化物,且不影响生长(图2A和图S4, a至C)。decR的缺失导致硫化物产量显著下降,但对生长动力学没有影响(图2,A和B;图S4, A至D)。pulldown利用马来酰亚胺与游离硫醇和过硫化物结合,产生硫醚键,并利用二硫苏糖醇(DTT)破坏二硫键而不破坏硫醚键的能力(图2,C)。我们观察到,在添加半胱氨酸的培养基中,dtt洗脱的野生型大肠杆菌裂解液样品中,s巯基化蛋白得到了稳健的富集(图2D)。相比之下,在添加半胱氨酸的LB肉汤中生长的产生较少H2S的DdecR细菌的裂解液比WT大肠杆菌表现出更少的s -巯基化(图2E)。我们试图使用定量串联质量标签(TMT)液相色谱多阶段质量分光光度(LC-MS3)分析来鉴定大肠杆菌的磺氢。该分析显示,与未处理DTT的相同样品相比,大多数被DTT洗脱的大肠杆菌裂解液中富集的蛋白质确实是s -巯基化的(图2F)。按q值对s -巯基化蛋白进行排序(DTT与非DTT),结果显示了10个最丰富的s -巯基化蛋白(图2F和图S4G)。TnaA(图2F),一种催化色氨酸降解为吲哚、丙酮酸和氨的分泌酶,提供了我们的s -巯基分析和我们在CKD小鼠模型中观察到的表型之间的潜在联系。
三、硫水合抑制吲哚产生的大肠杆菌酶活性
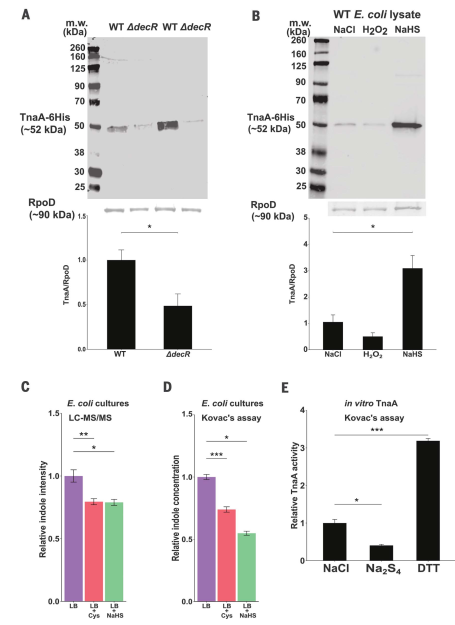
TnaA成为研究CKD小鼠模型中宿主微生物相互作用的一个有吸引力的目标。我们将大肠杆菌的TnaA染色体复制替换为在其本地启动子下克隆的TnaA -his。然后,我们通过Western blot分析WT和DdecR E. coli裂解液中的TnaA s -巯基化反应,验证了我们的s -巯基化结果,发现DdecR裂解液中的TnaA s -巯基化反应降低(图3A)。H2O2和NaHS处理的大肠杆菌裂解液TnaA s -硫酸化反应分别减少和增加(图3B)。细菌培养物LC-MS/MS分析。我们发现,向LB肉汤中添加半胱氨酸或NaHS可以降低上清液中的吲哚浓度(图3,C和D)。我们观察到,与多硫化物供体四硫化二钠(Na2S4)孵育可导致TnaA s -巯基化(图S6D)和体外酶活性降低60%(图3E)。作为实验对照,我们添加了DTT,可以将s -巯基化TnaA降低到其功能原生形态,我们观察到TnaA活性增加了三倍以上(图3E)。
总之,这些结果表明无论是在体外还是在细菌培养中,通过色氨酸产生吲哚来检测大肠杆菌TnaA的硫酸水合作用降低了它的活性。
四、在小鼠CKD模型中,膳食Saa调节盲肠吲哚水平、血清吲哚酰硫酸盐水平和肾功能

与低saa饮食的小鼠相比,高saa饮食的小鼠盲肠中TnaA s -巯基化含量更高(图4A)。我们测量了两种饮食下ASF大肠杆菌小鼠的盲肠内吲哚含量。我们发现,高Saa饮食的小鼠吲哚水平显著降低,这表明,高Saa饮食不仅增加了TnaA s -巯基化,而且这种修饰足以影响体内TnaA的活性(图4,B和C)。在大肠杆菌小鼠中,ASFtnaA mut小鼠的血清中未检测到吲哚酰硫酸盐,因为在肠道菌群中不存在色氨酸酶。由于大肠杆菌DdecR缺乏从半胱氨酸中生成硫化物,TnaA仍保持较少的硫化物化和较高的活性(图S6A)。与观察结果一致的是,ASFDdecR小鼠的盲肠硫化物减少(图S7C),盲肠吲哚增多(图S7D),血清吲哚基硫酸酯相对于ASFE增加。大肠杆菌小鼠(图4D)。WT大肠杆菌定植的小鼠比tnaA mut菌株定植的小鼠血清肌酐水平更高(图4E)。大肠杆菌DdecR与WT大肠杆菌相比,更严重的管间质损伤、纤维化、皮质晶体沉积和更广泛的实质受累的组织学结果反映了吲哚酰硫酸盐和肌酐观察到的趋势(图4,F, G)。
总之,这些数据支持了饮食成分可以产生影响肠外宿主功能的肠道微生物蛋白的翻译后修饰,也为宿主-饮食-微生物群的相互作用如何导致CKD等疾病状态提供了机制上的见解。






