BATF2 mRNA的m6A甲基化修饰在胃癌中的功能抑制作用
由于恶性增殖和转移的发生,胃癌患者预后不佳。BATF2在其它肿瘤中被发现能够降低肿瘤细胞的增殖和侵袭,诱导肿瘤细胞的凋亡。研究发现BATF2的mRNA水平可能与N6-甲基腺苷(m6A)甲基化修饰有关,然而BATF2在胃癌(GC)中的生物学功能及其调控机制尚不清楚。福建医科大学附属协和医院的谢建伟等人于2020年7月在Molecular Cancer(IF=15.302)这一杂志发表文章,研究METTL3/BATF2/p53/ ERK在GC发展中的作用,探究BATF2在GC中的临床意义及调控机制。
技术路线图:
研究结果:
1.BATF2表达降低与胃癌患者预后不良相关
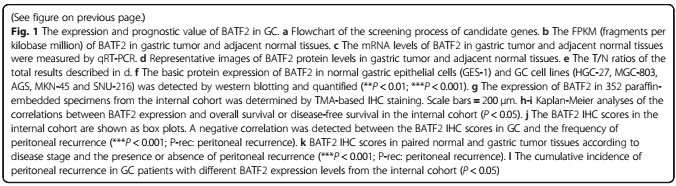
对8对GC和正常胃组织进行转录组测序发现GC中871个基因表达下调,这些基因在TCGA-STAD和ACRG数据库中的生存分析结果(P<0.01)显示5个基因可作为GC患者的预后标志物, 其中BATF2被确认是下调基因。在组织和细胞中,通过WB、PCR和免疫组化实验发现在肿瘤中BATF2的表达水平降低。BATF2低表达患者的总体和无病生存率明显低于BATF2高表达患者,并且多变量Cox回归分析显示,BATF2是独立预后因素。

2. 体内、外实验中,BATF2抑制肿瘤的生长
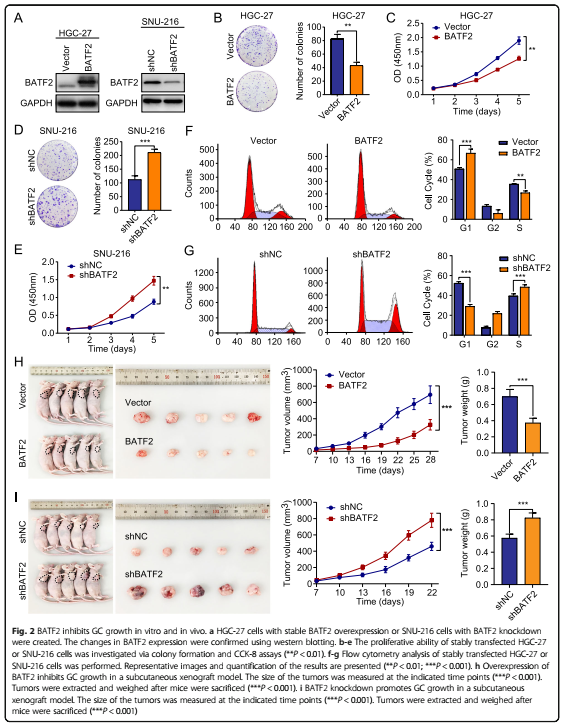
集落形成实验显示,BATF2表达上调(过表达)抑制肿瘤细胞增殖,BATF2表达下调(敲除)则相反。流式细胞术检测结果显示BATF2表达增加,G1期细胞增多,细胞的生长受到抑制,而敲除BATF2导致G1期细胞减少。移植瘤实验显示BATF2高表达的小鼠中肿瘤的生长速度比较慢,BATF2低表达的小鼠则较快。免疫组化结果显示,BATF2高表达组中Ki-67(增殖细胞的标记)评分低于BATF2低表达组中。这些结果提示BATF2可能通过调节细胞周期来抑制GC。
3. 在体内、外实验中,BATF2调节GC转移
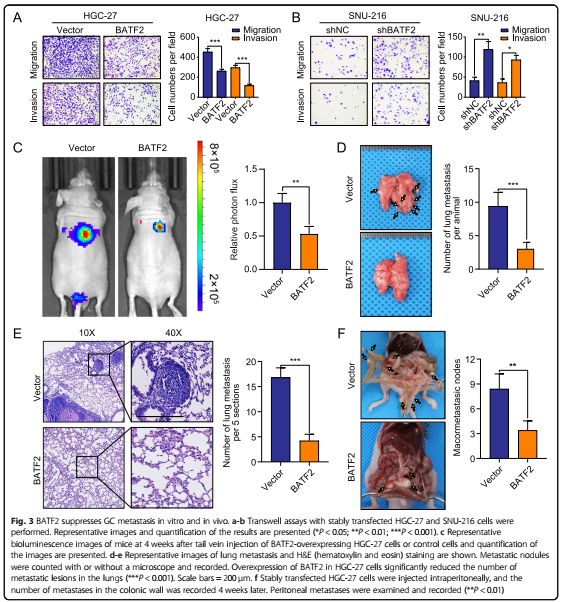
细胞实验中,BATF2过表达显著抑制GC细胞的迁移和侵袭,BATF2敲除则增加迁移和侵袭。移植瘤实验的生物发光成像结果显示,注射过表达BATF2细胞的小鼠胃癌肺转移明显减少。转移菌落数量、转移性结节和腹膜转移实验结果显示,BATF2在抑制胃癌转移中发挥重要作用。
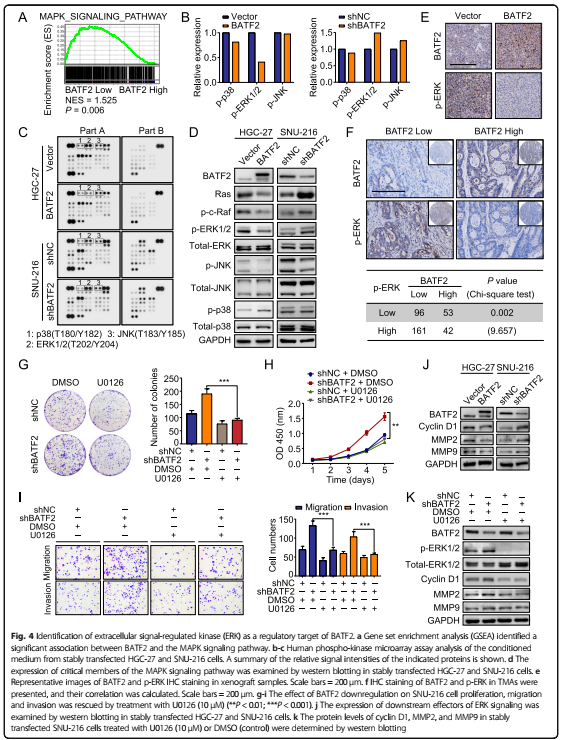
4. BATF2调节ERK信号抑制GC
基因探针富集分析(GSEA)显示,BATF2与MAPK信号通路相关。人磷酸激酶芯片检测BATF2的信号转导影响,结果显示BATF2过表达降低了ERK的磷酸化,BATF2敲除增强了ERK的磷酸化。WB和免疫组化结果验证上述实验。基于TMA的免疫组化验证了低BATF2表达组中62.6%的患者p-ERK水平增强。
在BATF2敲除的GC细胞中抑制p-ERK(U0126, ERK抑制剂)能逆转细胞的增殖、侵袭和迁移。而且,文章中分析了在BATF2过表达或敲除的细胞中ERK介导的转录靶基因MMP2, MMP9,和cyclin D1的表达变化。
队列研究表明BATF2调节ERK磷酸化可能是BATF2在GC中抑制肿瘤功能的机制。
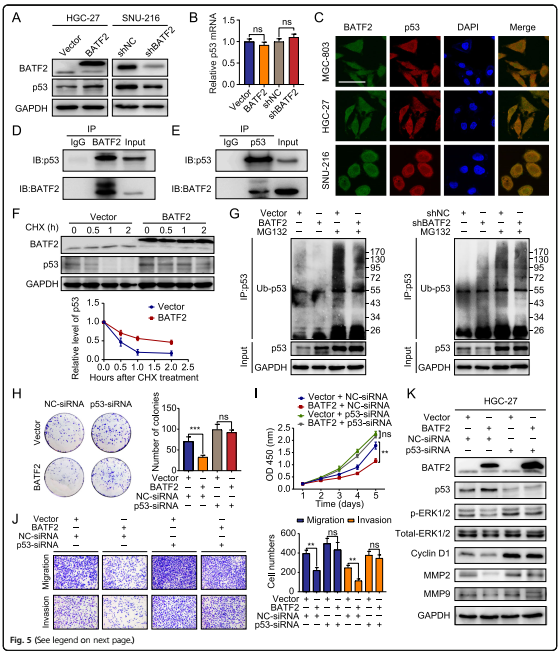
5. 在p53存在的情况下,BATF2控制ERK磷酸化
互作基因(STRING)数据库中发现p53蛋白可能与BATF2相互作用,并且过表达BATF2会导致p53蛋白表达增加,而沉默BATF2会降低p53的表达。移植瘤免疫组化显示p53蛋白与BATF2表达呈正相关,细胞免疫荧光显示p53蛋白与BATF2共定位,co-IP检测显示BATF2和p53蛋白相互作用,但是qRT-PCR检测显示BATF2和p53表达没有显著相关性,因此文章中推测BATF2可能通过翻译后修饰调控p53蛋白水平。
加入翻译抑制剂cycloheximide(CHX)后,BATF2过表达显著增加了p53蛋白的半衰期。MG132,一种蛋白酶体抑制剂,挽救了BATF2过表达诱导的p53蛋白水平变化。沉默p53可以恢复GC细胞的增殖和转移能力。沉默p53表达可显著消除BATF2对p-ERK、MMP2、MMP9和cyclin D1水平的抑制作用(图5k)。综上所述,这些结果表明BATF2的缺失促进了泛素介导的p53降解,从而激活了ERK信号。

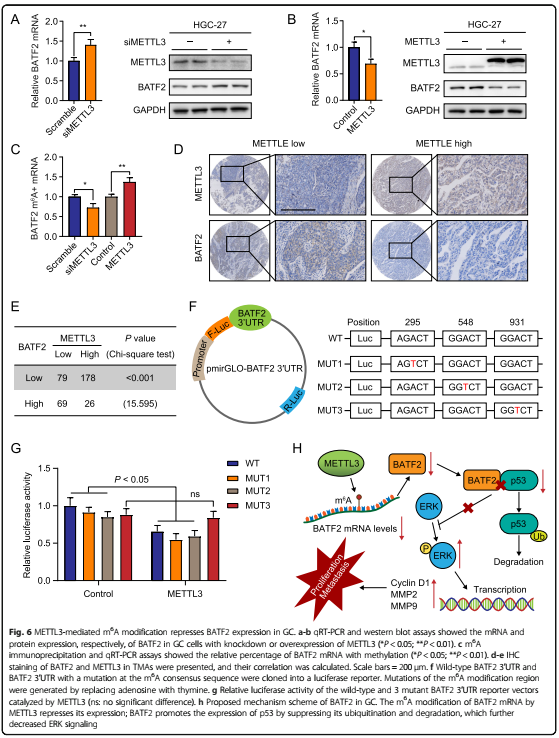
6. GC中,METTL3介导BATF2 mRNA的m6A修饰
沉默METTL3的表达能增加BATF2的表达,反之亦然。我们发现,在GC细胞中,BATF2 mRNA m6A修饰与METTL3表达呈正相关。基于TMA的免疫组织分析显示,METTL3在GC中的表达与BATF2存在一定程度的负相关。荧光素酶报告基因检测确定BATF2的3个未翻译区域(3’UTR)特异性m6A修饰位点-MUT3位点。这些结果表明,在GC中,m6A通过METTL3维持了BATF2 mRNA的稳定性。
总 结:
1.文章揭示了BATF2在胃癌发展中的抑癌作用。
2.BATF2表达显著下调与胃癌患者预后不良相关。
3.METTL3/BATF2/p53/ERK通过调节细胞周期和ECM降解抑制GC生长和转移。综上,BATF2可能是潜在的胃癌预测因子和治疗靶点






