缺氧诱导的lncRNA-AC020978促进非小细胞肺癌的增殖和糖酵解代谢
非小细胞肺癌(NSCLC)是一种以代谢异常为特征的致死性疾病。糖酵解相关的lncRNA在NSCLC侵袭行为中的作用机制尚不清楚。因此小编为大家详细介绍发表于“Theranostics”上的文章“Hypoxia-induced lncRNA-AC020978 promotes proliferation and glycolytic metabolism of non-small cell lung cancer by regulating PKM2/HIF-1α axis”,让大家了解lncRNA-AC020978促进非小细胞肺癌的增殖和糖酵解代谢的分子机制。

在本研究中,我们采用实时定量PCR和荧光原位杂交技术检测AC020978在NSCLC中的表达水平。通过体内外功能实验,研究了AC020978在细胞增殖和有氧糖酵解中的生物学作用。采用双荧光素酶报告基因、染色质免疫沉淀法检、RNA下拉法等实验方法研究了AC020978的分子机制。
结果:
1.AC020978在非小细胞肺癌中的临床意义
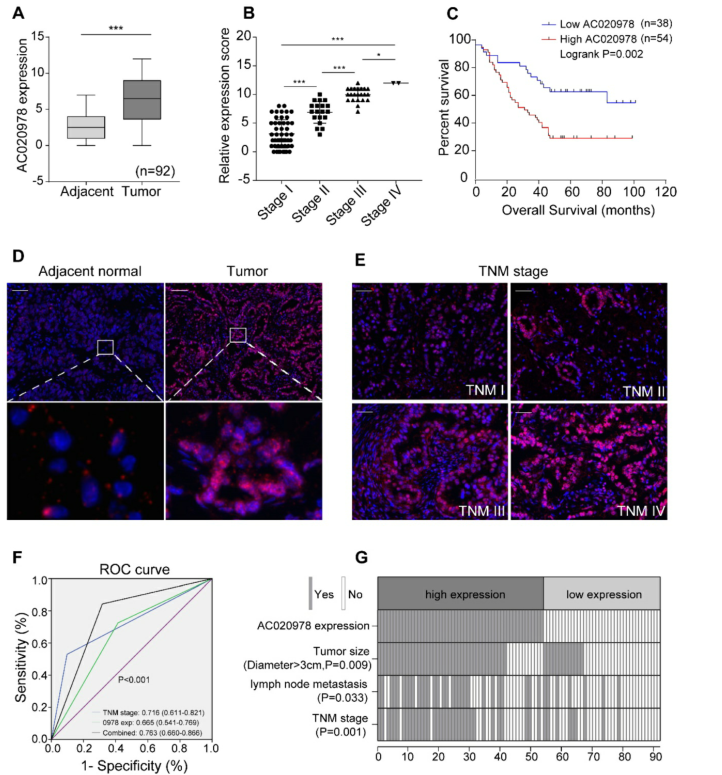
为了探讨AC020978在肿瘤中的临床意义,我们对NSCLC及其邻近组织进行了FISH检测。如图1A和1D所示,AC020978在肿瘤组织中过表达,在邻近的非肿瘤组织中很少表达。此外,AC020978的表达随着TNM的进展而增加(图1B,1E)。Kaplan-Meier分析显示AC020978的高表达与这些患者的预后不良显著相关(P<0.01,图1C)。
为进一步评价AC020978的病理和临床预测价值,对AC020978、TNM和AC020978与TNM联合应用组进行ROC分析。AUC数据显示,联合模型高于单用TNM模型(图1F)。随后,我们发现AC020978表达与肿瘤大小、淋巴结转移和TNM分期显著相关(图1G)。总之,这些结果提示AC020978可能是NSCLC的一个潜在的生物标志物。
2.AC020978是NSCLC细胞中的一种致癌lncRNA
为了阐明AC020978在细胞生物学行为中的作用,我们用两种不同的siRNA转染A549和H1299细胞。Si-0978#1对AC020978的抑制作用最强。qRT-PCR证实AC020978的表达可增加1000倍以上(图2A)。
为探讨AC020978在NSCLC进展中的生物学作用,采用CCK-8、EdU染色、集落形成分析等方法对细胞增殖进行了研究。结果表明在A549和H1299细胞中,AC020978基因敲除后,细胞增殖显著减弱。此外,重新表达AC020978可以挽救减弱的细胞增殖率(图2B-C)。在功能增益分析中,AC020978的过表达加速了H1299细胞的增殖效应(图2E-2F)。采用Transwell法检测AC020978在NSCLC细胞中的迁移能力。结果表明,AC020978异位表达的H1299细胞迁移能力增强,而AC020978的下调与阴性对照相比抑制了A549和H1299细胞的迁移活性,而AC020978在稳定的AC020978敲除细胞中的重新表达可以挽救减弱的细胞迁移(图2D和2G)。

3.AC020978是在代谢应激下诱导的,是糖酵解代谢重编程的关键
为了阐明AC020978在代谢应激下是否对细胞存活起作用,我们采用2.5mM到25mM的葡萄糖浓度梯度模拟葡萄糖剥夺条件。如图3A-3D所示,AC020978是由葡萄糖剥夺或2-DG治疗以剂量依赖和时间依赖的方式诱导的,表明AC020978可能在细胞对代谢应激的适应中起关键作用。
其次,检测AC020978是否直接影响葡萄糖代谢。如图3E和3F所示,AC020978的沉默提高了最大呼吸强度, AC020978的敲除明显降低了A549细胞的糖酵解、糖酵解能力和糖酵解储备。相比之下,AC020978的过表达在H1299细胞中表现出相反的代谢通量(图3G和3H),表明AC020978促进了糖酵解途径。此外,AC020978下调的A549细胞18F-FDG摄取和乳酸生成显著减少,而在H1299细胞中异位诱导的AC020978表现出逆转作用(图3I-J)。此外,我们还测量了几种葡萄糖转运体和代谢酶的蛋白质水平。Western blotting结果显示,AC020978表达的改变对它们有积极影响(图3K)。这些数据表明AC020978是一种葡萄糖饥饿诱导的lncRNA,可以调节NSCLC的糖酵解代谢。
由于HIF-1α是一种转录因子,参与调节细胞适应缺氧和低葡萄糖供应的重要基因,因此在葡萄糖饥饿条件下分析了HIF-1α的蛋白水平和反式激活(图3L)。结果表明,HIF-1α和HIF-1α响应的荧光素酶报告均受低葡萄糖诱导。有趣的是,与较长的供应相比,24小时的HIF-1α蛋白表达最高,而48小时的HIF-1α响应性荧光素酶活性最高,这表明癌细胞可能不断适应其代谢应激微环境。

4.AC020978促进肿瘤生长和体内有氧糖酵解
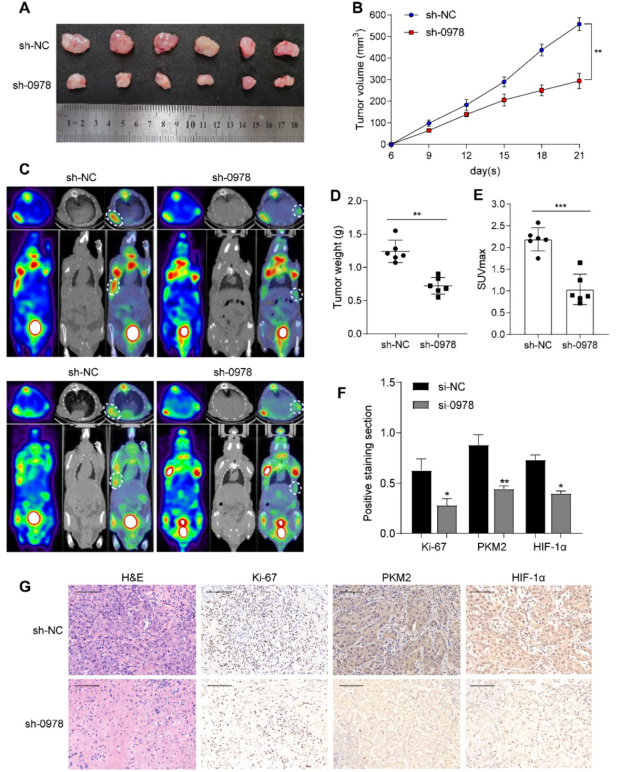
为了探讨AC020978在体内的作用,我们建立了AC020978基因敲除的A549细胞系,并建立异种移植模型。如图4A-B和4D所示,与对照组相比,AC020978基因敲除显著降低了肿瘤体积和肿瘤重量。此外,来自对照组的异种移植体具有相对较强的18F-FDG积累,而AC020978下调组的18F-FDG摄取量要低得多(图4C-4E)。异种移植组织的IHC染色表明AC020978介导肿瘤生长和糖酵解(图4F-4G)。总之,这些结果表明AC020978在促进NSCLC增殖和糖酵解方面发挥了重要作用。
5.AC020978是缺氧诱导的HIF-1α直接反式激活因子
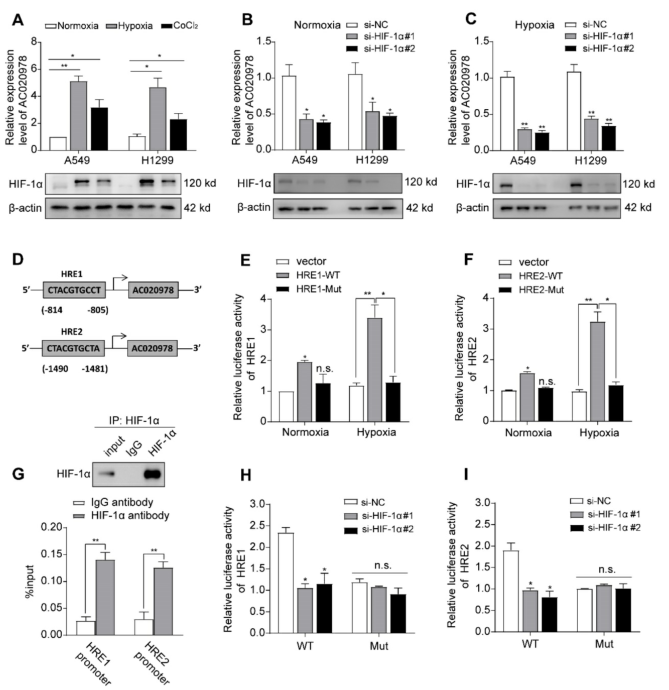
我们探讨了导致非小细胞肺癌AC020978高表达的原因。利用启动子序列分析工具对编码AC020978基因进行了检测。在启动子区发现两个假定的HIF-1α结合位点(图5D)。缺氧或其化学诱导剂CoCl2处理24小时后,A549和H1299细胞中AC020978的表达明显升高,与HIF-1α表达上调一致(图5A)。相反,HIF-1α基因敲除显著抑制AC020978在常氧和缺氧条件下的表达(图5B-5C)。另外,ChIP-qPCR分析表明HIF-1α直接与AC020978基因两个预测启动子区的染色质片段结合(图5G)。为了进一步验证HIF-1α对AC020978转录的激活作用,进行了荧光素酶报告基因实验。与预期的一样,在含有野生型启动子(WT)的细胞中,缺氧显著提高了荧光素酶的密度。然而,HIF-1α的敲除显著抑制了含有WT启动子的荧光素酶密度(图5E-F,H-5I)。综上所述,我们的数据强烈表明AC020978是HIF-1α的直接转录靶点。
6.AC020978与PKM2物理结合并介导PKM2蛋白的稳定性
我们进行RNA下拉和质谱分析筛选AC020978相互作用蛋白,如图6A所示。 RIP分析结果表明,在PKM2免疫复合物中,AC020978共沉淀有一个稳定而特异的富集(图6B)。RNA下拉实验证实PKM2蛋白特异性地与AC020978的序列结合(图6C)。
接下来,我们尝试探索这种AC020978-PKM2相互作用的分子功能。我们发现AC020978表达的改变调节了PKM2蛋白水平(图6D)因此,我们推测AC020978可能调节PKM2蛋白的稳定性。我们观察到,通过在A549细胞中添加MG-132,明显恢复了通过AC020978下调而降低的PKM2蛋白水平(图6E)。环己酰亚胺(CHX)实验结果表明,AC020978下调细胞中PKM2的半衰期较短,而AC020978高表达细胞中PKM2的半衰期较长(图6F),提示AC020978对PKM2的调控可能是通过抑制蛋白酶体降解来实现的。
最后,我们通过体外泛素化试验检测了AC020978是否参与了泛素介导的PKM2降解。下调AC020978可提高A549细胞PKM2蛋白泛素化水平。泛素介导的PKM2的降解作用在AC020978高表达H1299细胞中被显著抑制(图6G)。这些结果表明,AC020978通过泛素介导的蛋白酶体降解有助于维持PKM2蛋白的稳定性。
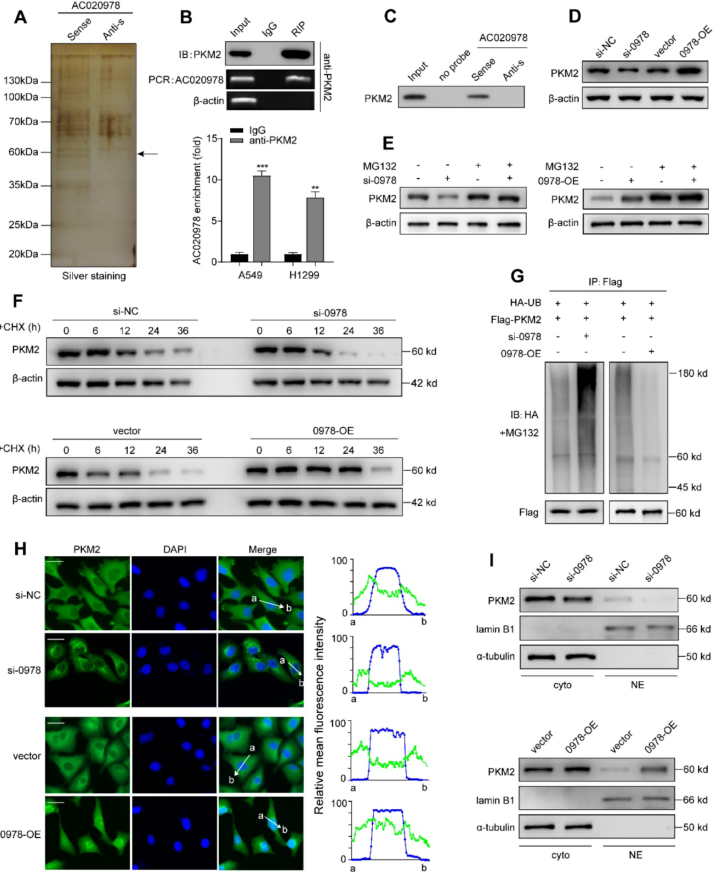
7.AC020978促进PKM2的核移位并调节PKM2增强的HIF-1α反式激活活性
免疫荧光染色显示,AC020978可调节PKM2的表达。在A549阴性对照细胞中,PKM2主要存在于胞浆中。而在AC020978敲除细胞中,几乎看不到任何可检测到的核PKM2。当比较AC020978高表达细胞中PKM2的细胞分布时,可以看到核PKM2水平的增加(图6H)。对A549和H1299细胞核质和胞质组分的Western blotting分析表明,PKM2主要在胞质组分中表达。A549细胞沉默AC020978后,PKM2的细胞核和胞浆部分信号降低。然而,根据免疫荧光结果(图6I),异位表达的AC020978表现出一定程度的核和胞浆PKM2信号的增加。
我们猜测AC020978参与了PKM2/HIF-1α途径的激活。首先,我们采用co-IP技术探讨AC020978是否能调节PKM2与HIF-1α的相互作用。结果表明,敲除AC020978的功能受损,但AC020978的过表达明显增强了PKM2和HIF-1α的相互作用(图7A)。此外,为了可视化天然蛋白质复合物,我们使用原位邻近连接分析(图7B)。在AC020978沉默条件下,发现含有PKM2和HIF-1α的PLA阳性蛋白复合物较少。相反,在AC020978高表达组中发现PKM2/HIF-1α簇的整体高密度,这与co-IP的蛋白质相互作用结果一致。
接下来,我们确定AC020978是否调节PKM2刺激的HIF-1α的反式作用。荧光素酶检测结果表明,在缺氧条件下,PKM2的异位表达均能提高HRE报告活性,而AC020978和PKM2的联合表达则能协同增强启动子活性(图7C)。缺氧条件下检测HIF-1α靶向基因GLUT1、LDHA、ENO1和PDK1的表达。AC020978和PKM2的共转染对所有这些基因都表现出较高的表达(图7D)。综上所述,这些数据表明AC020978增强PKM2增强HIF-1α转录活性。
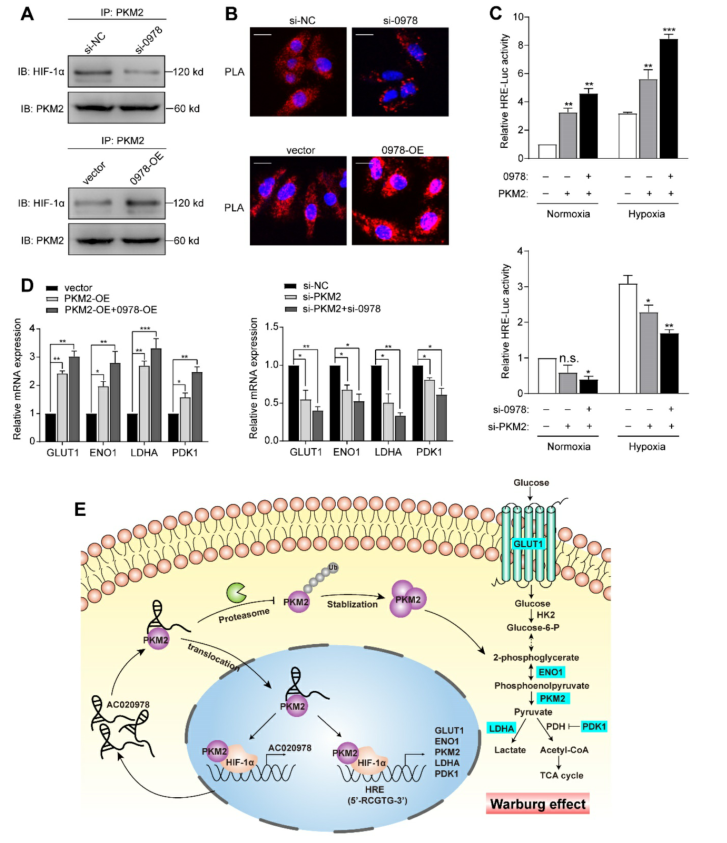
结 论:
AC020978是一种上调的lncRNA,在NSCLC中具有临床意义,有望成为NSCLC预后预测的独立生物标志物。靶向AC020978/PKM2/HIF-1α轴可能为NSCLC的防治提供新的视角。