室下区神经干细胞释放细胞外囊泡作为小胶质细胞形态原
室下区(SVZ)神经干细胞(NSCs)是围产期神经小生境的基础。小胶质细胞是神经系统的免疫细胞,在新生儿SVZ中富集。虽然小胶质细胞调节NSCs,但这种相互作用的双向程度尚不清楚。2018年4月,在Cell Report (IF=8.032)上发表的一篇名为“Neonatal Subventricular Zone Neural Stem Cells Release Extracellular Vesicles that Act as a Microglial Morphogen”就讲述了神经干细胞分泌的外泌体诱导小胶质细胞变形的故事。SVZ NSCs生成和释放EV,胞外囊泡(EVs)是包裹miRNA和蛋白的细胞源性颗粒。荧光标记的EV融合蛋白由NSCs释放,随后从SVZ中清除。EV优先针对微神经胶质。小RNA测序鉴定了EVs中调节小胶质细胞生理和形态的miRNA。EVs诱导细胞向CD11b/ Iba1非星状小胶质细胞形态转变。转录时伴有小胶质细胞转录状态,其特征是let -7调控的细胞因子释放和控制NSC增殖的负反馈环。这些发现暗示了NSC细胞-EV-小胶质细胞轴的存在。
技术路线
结果
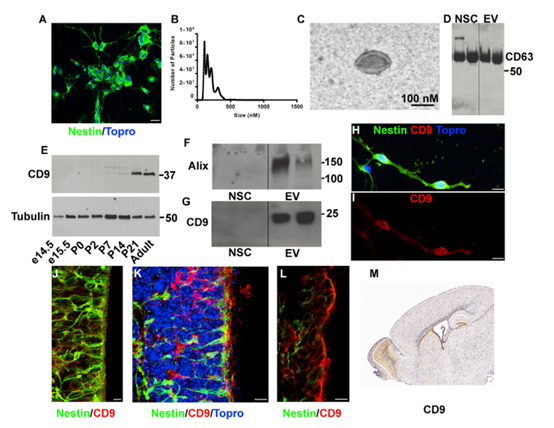
1、新生SVZ NSCs释放Evs分离与鉴定
原代SVZ NSCs培养为单层培养,从产后0 (P0)小鼠开始,对NSC标记蛋白Nestin进行免疫细胞化学实验。新生儿SVZ培养物为DCX阴性,而大多数细胞为巢蛋白阳性(92%)(图1A)。对新生的SVZ NSC培养基进行低速离心,,然后进行纳米颗粒跟踪分析。 (图1 B)。NSC EV大小经电镜证实为外泌体形态(图1C)。CD63是EV标记蛋白,证实在NSCs和EV中表达(图1D)。另一种EV蛋白CD9在背前脑提取物中被检测到。新生儿大脑中存在CD9, P7上调(图- 1E)。western blot检测原发性新生儿SVZ NSC EVs中CD9(图1F)。此外,SVZ NSC EV中还存在外泌体货运蛋白ALIX(图1G)。CD9表达在原发性SVZ NSC培养基中通过免疫细胞化学进一步证实(图1H和1I)。为了检测体内CD9蛋白的表达,作者对P0和P4大脑进行了免疫组化。P4时,在巢蛋白阳性的NSCs中,CD9表达沿着心室壁传输(图1J-1L)。在新生儿SVZ中CD9的富集与Allen脑研究所矢状切片原位杂交相一致(图1M)。这些结果都证实了新生儿SVZ神经干细胞释放胞外囊泡的存在。
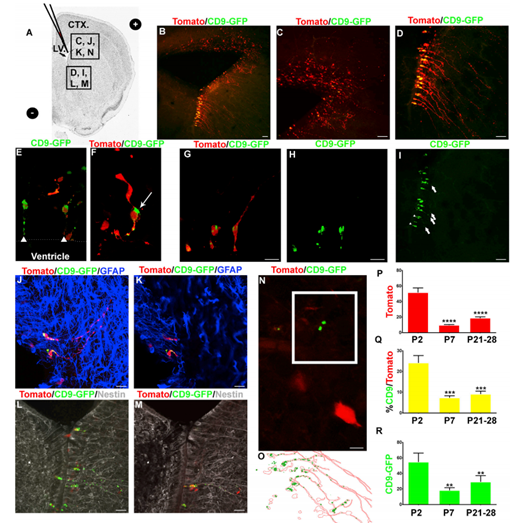
2. 体内实验证明SVZ NSCs释放CD9
为了研究NSC外泌体,将番茄荧光蛋白和CD9-GFP编码质粒电转至P0小鼠SVZ,并检测NSCs(图2A)。在整个体细胞中检测到番茄荧光蛋白的表达(图2B-2D)。CD9-GFP阳性细胞在腹外侧心室壁最常见(图2B - 2D)。CD9-GFP在具有b1样NSC形态的细胞中被检测到(图2E-2H)。CD9-GFP定位于顶端和基质的过程(图2E和2I)。P7对胶质原纤维酸蛋白(GFAP)的NSC形态学染色呈阳性(图2J和2K)。b1样的番茄/CD9-GFP-阳性细胞也呈巢蛋白阳性,证实其为NSCs(图2L和2M)。在电穿孔细胞外检测到CD9-GFP(图2N和2O)。检测到52个番茄阳性细胞/SVZ 48小时后电循环(图2P)。SVZ中残存的番茄阳性细胞较P2-P7明显减少80%(图2P)。,在P7时,共表达CD9-GFP和番茄的细胞百分比从24%显著降低到7.32%(图2Q)。在P21-P28的大脑中,CD9-GFP/番茄共表达细胞百分比的降低是相似的。考虑到番茄阳性细胞的减少,与番茄/CD9-GFP双阳性细胞一致,这些结果支持了71%的CD9-GFP/番茄阳性细胞为NSCs的模型。每个电穿孔细胞电孔48小时后,至少可检测到一个细胞外颗粒(54.77 CD9-GFP颗粒/图像)(图2R)。在P21-P28小鼠中,共电穿孔番茄NSCs外的CD9- GFP颗粒数在电穿孔后7天内下降至18.20个颗粒,且保持相似(19.06)(图2R)。这些结果表明SVZ NSCs释放CD9, CD9可以从细胞外环境中次序的被清除。
3.SVZ神经干细胞胞外囊泡EV是针对小胶质细胞的
iba1阳性的小胶质细胞与来自新生SVZ NSC细胞外CD9- GFP共定位(图3A和3B)。作为一项初步实验,为了进行更公正的评估,将转染CD9- GFP N2a细胞的外泌体用荧光亲脂染料DiI标记。然后将外泌体注射入新生儿小鼠的侧脑室(图3C)。注射后一到七天,老鼠被收集,大脑被分离。侧脑室附近的细胞群用DiI和GFP标记(图3D-3E)。细胞偶有星状形态,类似于小胶质细胞(图3F)。Iba1染色证实这些细胞是小胶质细胞(图3F)。用DiI标记P100组分的SVZ NSC EVs,并将其注射到P0小鼠体内。NSC EVs主要针对iba1阳性的小胶质细胞(图3H)。EV标记的小神经胶质常呈圆形,常与侧脑室和SVZ相邻。CD68和CD11b是新生SVZ小胶质细胞外压的两个小胶质细胞标记物。与这些发现一致的是,dii标记的细胞对CD68和Iba1以及CD11b和Iba1呈双重阳性(图3I-3K)。
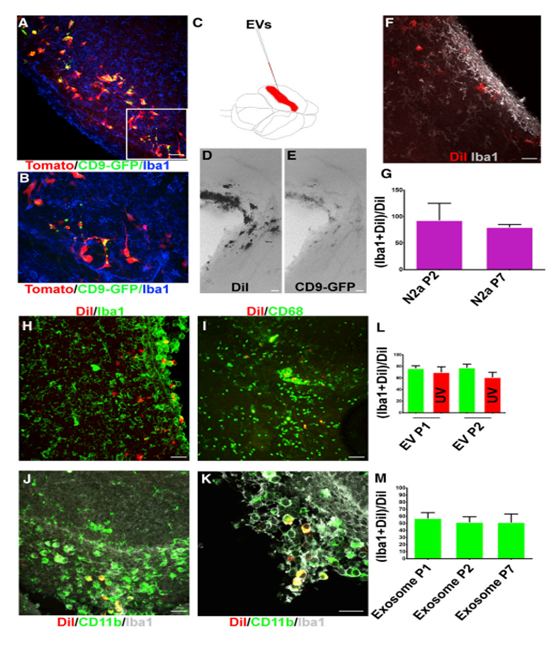
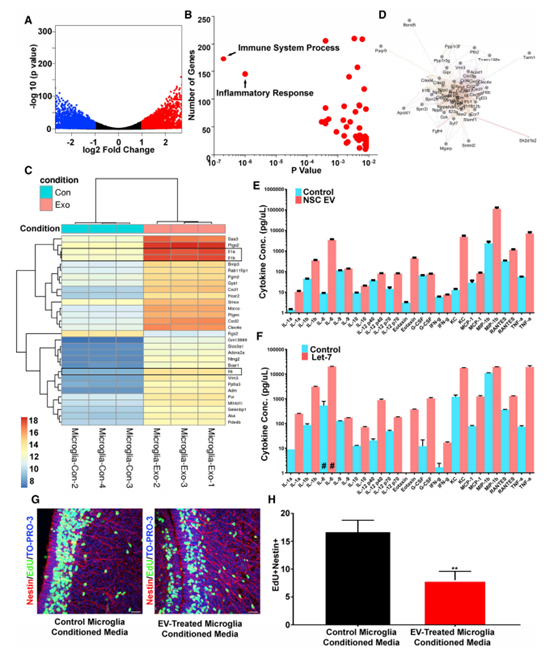
4.神经干细胞胞外囊泡和RNA含量调节小胶质细胞形态
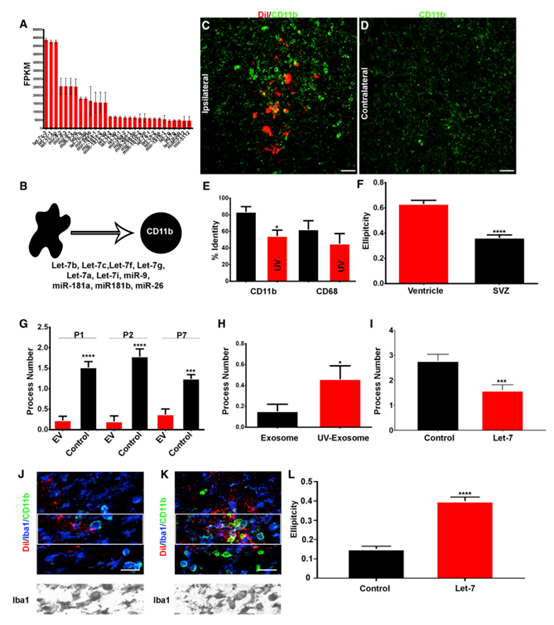
为了确定EVs对小胶质细胞的功能影响,进行了小RNA测序。在NSC P100 EV中发现了大量的miRNA,大于平均miRNA的10倍(图4A)。miR-9、Let-7、miR-26和miR-181在NSC EV中高度富集。都在调节小胶质细胞形态和生理方面发挥作用.假设EVs调控cd11b阳性的小胶质细胞以诱导圆形非星状表型(图4B)。与对侧半球相比,NSC P100 EV移植增加了cd11b阳性小胶质细胞(图4C和4D)。与对照组相比,UV预处理EVs导致cd11b阳性的小胶质细胞减少(图4E)。作者推测外源体Let-7可能调控小胶质细胞的形态。收集转染Let-7的N2a细胞外泌体。体外酶体经过模拟或合成Let-7转染,移植到新生小鼠SVZ中。经合成的Let-7 miRNA转染的外泌体诱导小胶质细胞获得了一种与MIMICS转染外泌体不同的圆形外观(图4I-4L)。这些结果证实SVZ NSCs释放的外泌体是针对小胶质细胞的、被小胶质细胞吸收和修饰的。
5. NSC EVs激活小胶质细胞转录网络,形成NSC反馈回路
NSC EVs激活小胶质细胞转录网络, NSC EVs处理的小胶质细胞有1713个转录本上调大于2倍(图5A)。GO分析表明,免疫系统过程和炎症反应是最丰富和最显著的表达(图5B)。热图中转录本的检测显示,上调程度最高的转录本包括白细胞介素-1a (IL-1a)、IL-1b和IL-6等细胞因子(图5C)。与此一致的是,对顶端差异调节转录本的网络分析包括了该网络核心的一个细胞因子节点(图5D)。细胞因子的上调在小胶质条件培养基中得到验证(图5E)。合成的含有let -7的EV可以刺激模拟NSC EVs作用的小胶质细胞因子的强力释放(图5F)。为了验证小胶质细胞摄取NSC外泌体的功能意义,将未处理或EV处理的小胶质细胞的条件培养基注射回P0小鼠侧脑室,并进行EdU标记(图5G)。由外泌体处理的小胶质细胞产生的条件培养基,但不能控制小胶质细胞,减少了分裂NSCs的数量(图5H)。综上所述,这些结果表明外泌体对新生儿时期小胶质细胞信号通路的影响是显著的。