外泌体瓦解血脑屏障在脑转移中的作用
脑转移是乳腺癌患者死亡的重要原因之一。脑转移过程中的一个关键事件是癌细胞通过血脑屏障(BBB)的迁移。然而,通过这一自然屏障的分子机制尚不清楚。
来自日本国家癌症中心研究所的作者发现,来自癌症的细胞外囊泡(EVs),通过蛋白质和miRNAs 传递的细胞通讯介质,触发了血脑屏障的崩溃。尤其是,miR-181c通过调控靶基因PDPK1,通过肌动蛋白的异常定位促进BBB的破坏。miR-181c降解PDPK1导致cofilin磷酸化下调,从而激活cofilin诱导的肌动蛋白动力学调节。此外,研究者证明全身注射脑转移癌细胞来源的EVs促进了乳腺癌细胞系的脑转移,并优先在体内融入大脑。这些结果表明由EVs介导的一种新的脑转移机制,可触发血脑屏障的破坏。
主要研究结果:
1.乳腺癌脑转移细胞系的建立
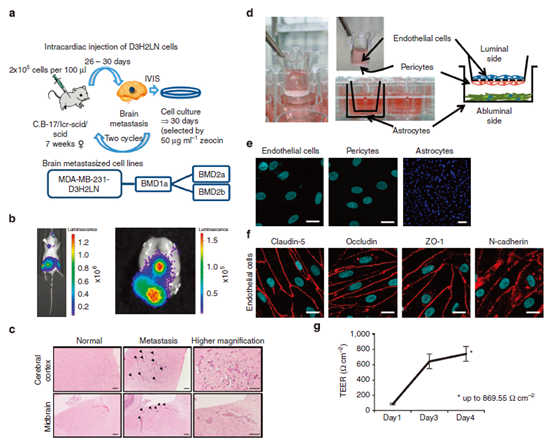
图1 脑转移乳腺癌细胞系及体外模型的建立。
(a) 脑转移乳腺癌细胞系制备示意图 (b) 脑转移小鼠生物发光图像(左)。右边的图像表示小鼠肿瘤细胞转移的生物发光图像。(c)小鼠大脑皮层和中脑HE染色切片的代表性图像。左上方和下方分别显示正常小鼠大脑皮层和中脑,未见癌细胞转移。中间上下面板分别显示小鼠大脑皮层和中脑,癌细胞转移。箭头表示转移性癌细胞。右上方和下方的面板显示更高的放大倍数。(d)构建BBB体外模型的示意图猴脑毛细血管内皮细胞、周细胞和星形胶质细胞的原代培养。(e)共聚焦显微镜观察内皮细胞和周细胞,荧光显示显微镜观察星形胶质细胞。 (f)免疫荧光显示紧密连接蛋白(Claudin-5, Occludin和ZO-1)和N-cadherin(红色) (g) 内皮细胞电阻(transendoelectrical resistance, TEER)来测量脑血管内皮细胞紧密连接的形成,证明血脑屏障的完整性。
2.抑制EV分泌抑制通过血脑屏障的侵袭性
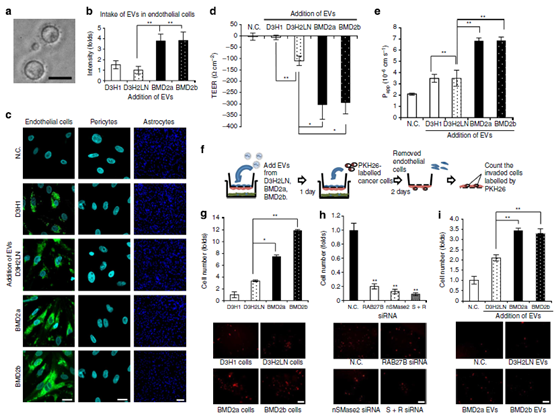
图2 脑转移癌细胞的EV被纳入内皮细胞,通过癌细胞的BBB调控侵袭。
(a) 透射电子显微镜相衬技术观察重新悬浮的EV球团。 (b)用ImageJ测量pkh67标记EVs的强度。 (c)用PKH67标记从癌细胞中分离出来的EVs,并将其添加到上室。图示内皮细胞、周细胞和星形胶质细胞。(d)在第4天和第5天从每个细胞系中分离出的EVs添加前(第4天)和后(第5天)监测了TEER的值。从脑转移癌细胞中分离出来的EVs在体外BBB模型中孵育24小时。 (e)用NaF(分子量376.27)测定血脑屏障通透性。体外血脑屏障模型加入mda - mb -231-lu -D3H1 (D3H1)、D3H2LN、BMD2a或BMD2b细胞和N.C.的EV,24小时后加入NaF。荧光光度计测量通过血脑屏障的NaF。 (f)在体外BBB模型中加入pkh26标记的癌细胞(2104个细胞)。孵育48小时后,清除内皮细胞,用荧光显微镜计数入侵细胞。(g) D3H1、D3H2LN、BMD2a或BMD2b细胞体外血脑屏障迁移活性。绘制了相对于D3H1细胞系的迁移细胞数量。(h)为了阐明EVs对脑转移细胞外渗的贡献,作者评估了体外BBB模型中,当这些细胞系中的EV分泌 被EV分泌相关蛋白snSMase2 和RAB27B siRNAs 抑制后,BMD2a细胞的外渗。
3.肿瘤细胞来源的ev在体内促进脑转移
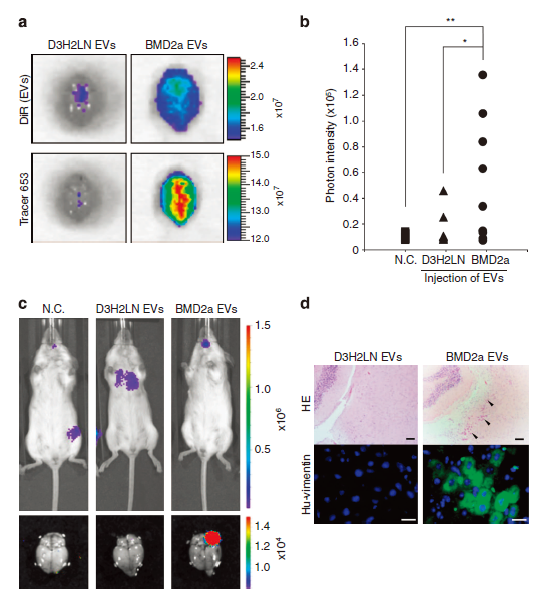
图3 癌源性EV促进乳腺癌细胞脑转移。
(a)注射D3H2LN或BMD2a细胞来源EV的小鼠大脑荧光图像。上面的图像代表了老鼠大脑吸收的EVs。下面的图片代表了老鼠大脑的渗透性。以D3H2LN细胞来源的EV作为对照。这个实验重复了两次。(b)光子强度在大脑中的分布,用ImageJ分析量化。(c) D3H2LN和BMD2a细胞源EV和N.C.的生物发光图像。上图为小鼠全身生物发光图像。下面的图片是患有癌细胞转移的老鼠大脑的生物发光图像。(d)小鼠大脑皮质(上板)HE染色的代表性图像。箭头表示癌细胞。下图为抗人波形蛋白(Hu-vimentin)免疫荧光图像。数据分别代表至少三个独立实验(图d)。
4. 细胞间连接的中断导致血脑屏障的崩溃
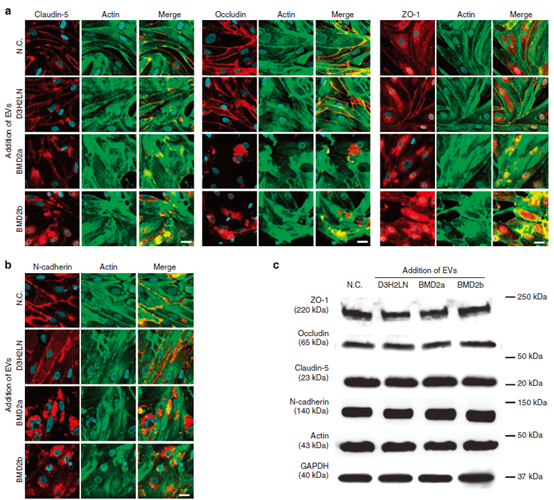
图4脑转移癌细胞的EV促进BBB分解。
(a)加入D3H2LN、BMD2a或BMD2b细胞的EV后,紧密连接蛋白(Claudin-5、Occludin和ZO-1)(红色)和肌动蛋白丝(绿色)的免疫荧光共定位。(b)添加来自D3H2LN、BMD2a或BMD2b细胞的EV后,N-cadherin(红色)和肌动蛋白丝(绿色)的免疫荧光共定位。(c)紧密连接蛋白、N-cadherin、肌动蛋白和GAPDH的Western blot分析。内皮细胞经阴性对照(N.C.)或EVs处理后的蛋白。这个实验重复了两次。数据分别代表至少三个独立的实验(图a,b)。
5. EV携带的miR-181c减少肌动蛋白丝组织
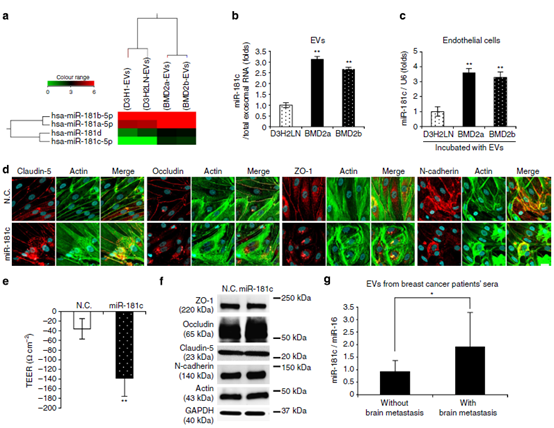
图5 miR-181c在脑转移患者血清中参与血脑屏障破坏和上调。
(a)热图显示miR-181c在癌源性EV中的表达水平。(b)从D3H2LN、BMD2a和BMD2b细胞中分离得到的ev中miR-181c的含量。 (c)内皮细胞与D3H2LN、BMD2a或BMD2b细胞分离的ev孵育24 h,内皮细胞加入ev后24 h分离RNA, qRT-PCR检测内皮细胞中miR-181c的表达 (d)内皮细胞加入D3H2LN、BMD2a或BMD2b细胞的ev后,对Claudin-5、Occludin、ZO-1、N-cadherin(红色)和肌动蛋白丝(绿色)共免疫染色。 这些蛋白定位于mir -181c转染细胞的细胞质。(e)在转染miR-181c或对照siRNA前(第4天)和后(第5天)监测TEER值。转染的miR-181c或N.C. siRNA在体外BBB模型中孵育24小时。 (f)紧密连接蛋白、N-cadherin、肌动蛋白和GAPDH的Western blot分析。 (g)患者血清中miR- 181c含量。
6. PDPK1调控的肌动蛋白定位对血脑屏障具有重要意义
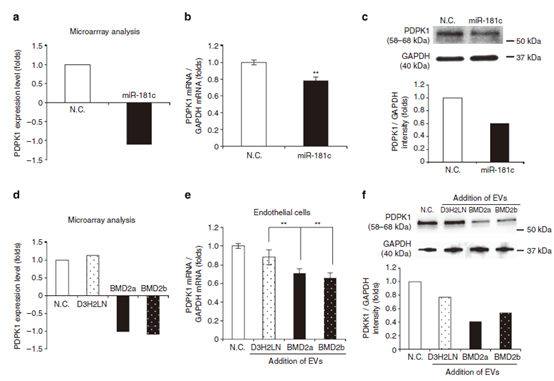
图6 miR-181c调控脑内皮细胞PDPK1的表达。
(a)芯片分析显示转染miR-181c后,PDPK1在内皮细胞中的表达水平。数据表示为log2值。(b)转染miR-181c后,PDPK1 mRNA在内皮细胞中的表达水平。 (c) PDPK1和GAPDH的Western blot分析。蛋白来源于转染miR-181c的内皮细胞。下图为nc . siRNA或miR-181c转染得到的PDPK1的强度。实验重复了两次。(d)芯片分析显示EV处理后PDPK1在内皮细胞中的表达水平。(e)添加D3H2LN、BMD2a或BMD2b细胞的ev后,PDPK1 mRNA在内皮细胞中的表达水平 (f) PDPK1和GAPDH的Western blot分析。蛋白来自内皮细胞,经D3H2LN、BMD2a或BMD2b细胞的EV处理。
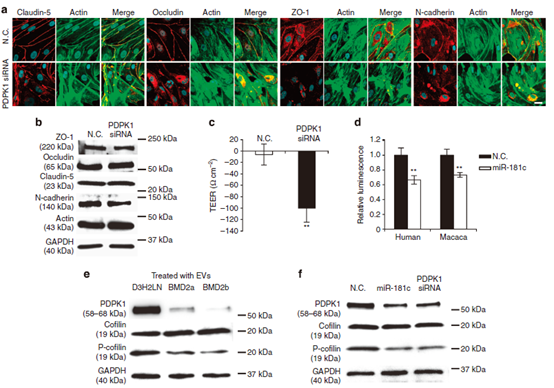
图7 内皮细胞中miR-181c, PDPK1的靶点|调控紧密连接蛋白N-cadherin和肌动蛋白的定位。
(a)加入D3H2LN、BMD2a或BMD2b细胞的ev后,紧密连接蛋白(Claudin-5、Occludin和ZO-1)、N-cadherin(红色)和肌动蛋白丝(绿色)的共免疫荧光。规模的酒吧。(b)紧密连接蛋白、N-cadherin、肌动蛋白和GAPDH的Western blot分析。用PDPK1 siRNA处理的内皮细胞蛋白。 (c) 在PDPK1 siRNA转染前(第4天)和(第5天)后监测TEER值或阴性对照。(d) 共转染miR-181c和PDPK1荧光素酶的记者测量荧光素酶活性。 (e) PDPK1、cofilin、phospho-cofilin (P-cofilin)和GAPDH的Western blot分析。蛋白来自D3H2LN、BMD2a或BMD2b细胞的ev处理的内皮细胞。 (f) PDPK1、phospho-cofilin (P-cofilin)、cofilin和GAPDH的Western blot分析。






