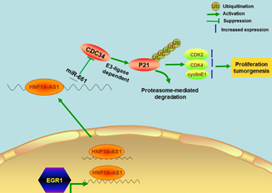
LncRNA上游机制研究:在胃癌中EGR1介导lncRNA-HNF1A-AS1转录从而提高细胞周期进程
长链非编码RNAs(LncRNAs)在各种人类癌症中都出现失调,并控制肿瘤的发生和进展。然而,LncRNAs失调的上游机制仍不清楚。这项研究证明了肝细胞核因子1同源框A反义RNA 1(HNF1A-AS1)在胃癌(GC)组织中表达显著上调。过表达HNF1A-AS1促进细胞增殖和细胞周期进程,而敲除HNF1A-AS1得到的实验结果则相反。早期生长反应蛋白1(EGR1)直接结合HNF1-As1启动子区域并激活其转录。过表达EGR1增强了细胞增殖并促进了细胞周期进程,与HNF1-As1的功能相似。HNF1A-AS1可作为竞争性内源性RNA(ceRNA)与miR-661结合,上调miR-661直接靶向的细胞分裂周期蛋白34(CDC34)的表达。研究还发现EGR1和HNF1A-AS1可以促进细胞周期素依赖性激酶2(CDK2)、CDK4和细胞周期素E1的表达,并通过促进CDC34介导的p21泛素化的降解而抑制p21的表达。
综上所述,这些发现表明EGR1激活HNF1A-AS1调节各种促生长因子和抗生长因子以促进GC的发展,暗示它可能作为治疗干预该病的靶点。
实验路线:
实验结果:
1. HNF1A-AS1促进细胞增殖和细胞周期进程
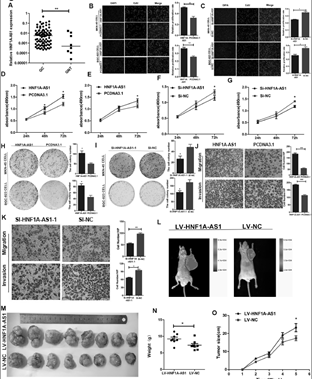
A: HNF1A-AS1在胃癌组织中高表达。B-C: HNF1A-AS1促进细胞增殖。D-G:HNF1A-AS1增加细胞代谢活性。H-I:HNF1A-AS1促进细胞非贴附性生长。J-K:HNF1A-AS1促进细胞迁移和侵袭能力。L-O:HNF1A-AS1促进肿瘤的形成。
2. HNF1A-AS1促进细胞周期进程
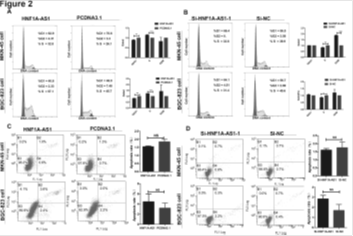
A: 过表达HNF1A-AS1增加S期细胞比例。B:沉默HNF1A-AS1减少S期细胞比例。C-D:过表达或沉默HNF1A-AS1细胞凋亡不发生改变。
3. EGR1直接与HNF1-As1启动子结合
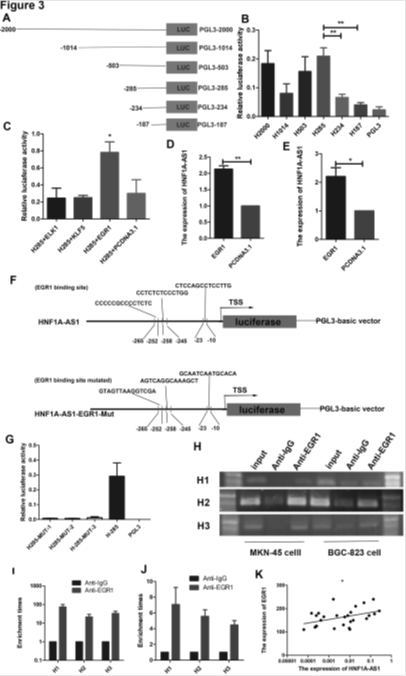
A:HNF1-As1启动子上游2000bp序列。B:启动子不同区域活性分析。C:启动子结合区域活性分析。D-K: EGR1促进HNF1-As1的表达。F:HNF1-As1启动子与EGR1结合区域引入三个点突变。G-J: EGR1直接与HNF1-As1启动子结合。K:在人类胃癌组织中EGR1与HNF1-As1的表达正相关。
4. EGR1促进细胞增殖并加快细胞周期进程
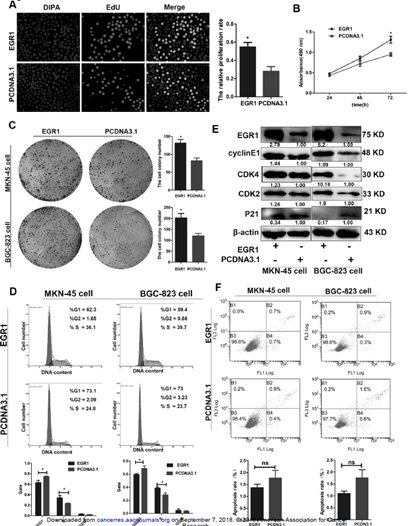
A:EGR1促进细胞增殖。 B:EGR1增加细胞代谢活性。C:EGR1增加细胞非贴附性生长。E:EGR1促进cyclinE、CDK4、CDK2的表达,降低P21的表达。D:EGR1增加S期细胞比例。F:EGR1不影响细胞凋亡。
5. HNF1-As1促进P21的泛素化降解
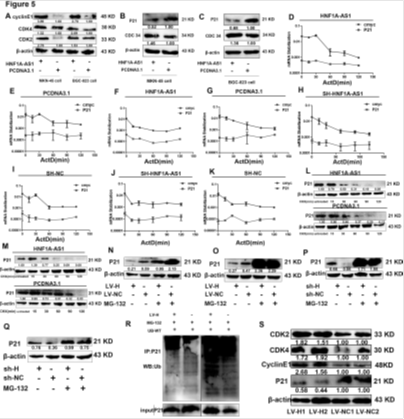
A:HNF1-As1促进cyclinE、CDK4、CDK2的表达。B-C:HNF1-As1降低P21的表达。D-K: 过表达或沉默HNF1-As1不影响P21 mRNA的表达。L-M:过表达HNF1-As1降低P21的稳定性。N-Q:过表达HNF1-As1, MG-132处理细胞后P21表达增加。 R:过表达HNF1-As1后EGR1的泛素化降解增加。S:过表达HNF1-As1小鼠癌症组织中P21表达下降。
6. HNF1-As1通过CDC34调控P21泛素化降解
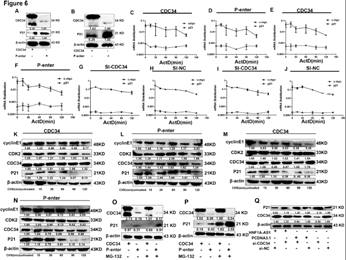
A-B:过表达CDC34导致P21表达下降。 C-J:过表达或沉默CDC34,P21 mRNA表达水平不发生改变。 K-N:过表达CDC34,P21的半衰期缩短。 O-P:过表达CDC34,MG-132处理细胞后内源性P21增加。 Q:挽救实验。沈默CDC34可以恢复由过表达HNF1-As1引起的P21蛋白的下降。
7. HNF1-As1作为ceRNA发挥作用
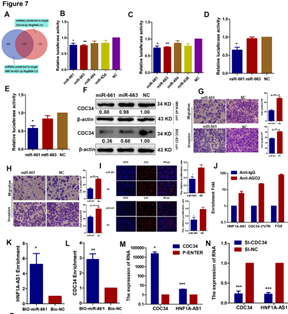
A:共同靶向HNF1-As1及CDC34的miRNA。B-C:miR-661和miR-663可结合HNF1-As1。 D-E:miR-661可结合CDC34.。F:只有miR-661能够在两种胃癌细胞系中同时降低CDC34的表达。 G-I:miR-661抑制细胞的迁移、侵袭和增殖。 J:RIP实验表明miR-661可以和HNF1-As1及CDC34结合。 K-L:miR-661可以富集到HNF1-As1和CDC34。M-N:过表达CDC34后HNF1-As1表达上调,沉默CDC34后HNF1-As1表达下调。
8. 作用机制图