一种新的lncRNA,ZFPM2-AS1通过稳定MIF来抑制p53途径并促进胃癌发生
长链非编码RNAs(lncRNs)与多种癌症的发病机制有关。2018年7月 9号Oncogene杂志上发表了一篇题为“ZFPM2-AS1, a novel lncRNA, attenuates the p53 pathway and promotes gastric carcinogenesis by stabilizing MIF”的文章,论文报道了一种新的lncRNA,ZFPM2反义RNA1(ZFPM2-AS1)在胃癌发生中的关键作用。应用基因表达综合数据对胃癌组织中ZFPM2-AS1进行了分析,并用qRT-PCR在73对胃癌组织和正常胃组织标本进行了验证。通过改变ZFPM2-AS1在体外和体内的表达,评价ZFPM2-AS1表达对胃癌细胞增殖和凋亡的影响。采用细胞和分子生物学方法进行机理研究。ZFPM2-AS1在胃肿瘤组织中的表达高于正常胃组织。胃癌组织中ZFPM2-AS1表达的增加与肿瘤大小、肿瘤浸润深度、分化程度、TNM分期有关。ZFPM2-AS1高表达可显著降低胃癌患者的总生存期和无病生存期。功能实验表明,ZFPM2-AS1表达促进胃癌细胞的增殖和抑制细胞凋亡,促进体内肿瘤的生长,这种作用与p53的核转位减弱有关。机械实验表明,肿瘤激活的ZFPM2-AS1可以结合并保护一种有效的p53失稳剂-巨噬细胞迁移抑制因子(MIF)的降解。敲除MIF可降低ZFPM2-AS1对胃癌细胞p53表达的影响。
这些研究结果表明ZFPM2-AS1调节胃癌进展,并揭示了一种新的ZFPM2-AS1/MIV/p53信号转导轴,阐明了某些恶性胃癌细胞致瘤性的分子机制。
技术路线
结果:
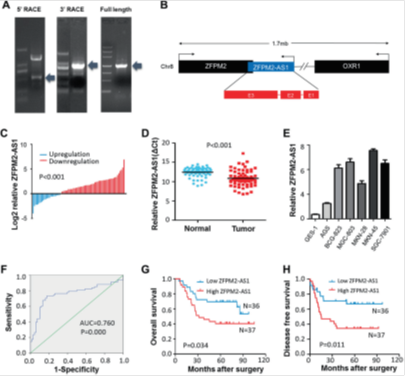
图1. ZFPM2-AS1表达上调预示胃癌预后不良。
(a)ZFPM2-AS1的5',3'和全长RACE。(b)ZFPM2-AS1位置示意图。ZFPM2-AS1的部分序列在反义链中与ZFPM2蛋白编码基因的内含子重叠。(c)胃癌和邻近非肿瘤胃组织标本中ZFPM2-AS1的相对表达水平。结果表示为log2(2-△△Ct)。(d)使用qRT-PCR分析胃癌和邻近非肿瘤胃组织标本(n = 73)中的ZFPM2-AS1表达。将ZFPM2-AS1表达水平标准化为U6的表达水平。(e)ZFPM2-AS1在正常胃细胞(GES-1)和胃癌细胞系(AGS,BGC-823,MGC-803,MKN-28,MKN-45和SGC-7901)中的表达水平。(f)根据基于qRT-PCR的ZFPM2-AS1表达水平预测胃癌的受试者 - 操作特征曲线。(g,h)Kaplan-Meier分析胃癌患者的总生存期(OS)(g)和无病生存期(DFS)(h)。
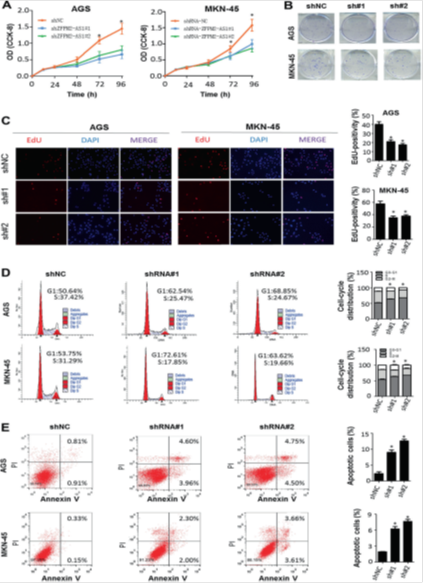
图2. ZFPM2-AS1在体外促进胃癌细胞增殖并抑制胃癌细胞的凋亡。
(a) 在体外用生长细胞计数试剂盒-8(CCK-8)评估胃癌细胞在体外生长。OD光密度。* P <0.05。(b)用ZFPM2-AS1特异性shRNA(sh#1和sh#2)或非靶向对照shRNA(shNC)转染AGS和MKN-45细胞的克隆形成实验。 (c)进行EdU掺入测定以确定ZFPM2-AS1抑制对胃癌细胞增殖期间DNA合成的影响。敲除ZFPM2-AS1降低了总胃癌细胞中EdU阳性(S期)细胞的比例。(d)流式细胞术检测HSZFPM2-AS1处理48小时后对AGS和MKN-45细胞周期阻滞的影响。* P <0.05(e)用流式细胞术分析SZFPM2-AS1或SHNC治疗后AGS和MKN-45细胞的凋亡率。* P <0.05
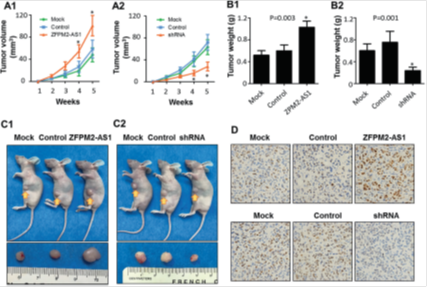
图3. ZFPM2-AS1在体内促进胃癌细胞的生长。
将ZFPM2-AS1表达质粒或shRNA处理后的AGS细胞经皮下注射到裸鼠的左大腿(每只小鼠1×10 6个细胞,每组5只小鼠)。在所示小鼠组中显示了肿瘤生长曲线(a1,a2; * P <0.05),肿瘤重量(b1,b2)和肿瘤(c1,c2)。(d)Ki67肿瘤组织免疫组化染色的代表性图像
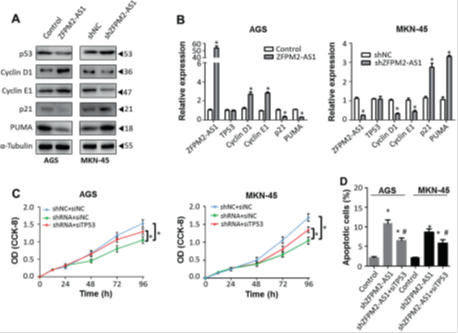
图4. ZFPM2-AS1负调控p53蛋白的表达并抑制p53下游分子的表达。
(a)Western印迹分析表明,ZFPM2-AS1表达的上调或下调改变了胃癌细胞系中p53及其下游靶标cyclin D1,cyclin E1,p21和PUMA的表达。(b)ZFPM2-AS1敲除改变了p53下游基因的mRNA表达,但没有改变胃癌细胞系中p53 mRNA的表达水平。 * P <0.05。(c)AGS和MKN-45细胞的生长速率。 * P <0.05。 (d)shZFPM2-AS1转染有或没有siTp53存在的胃癌细胞的凋亡分析。 *与对照组相比具有统计学意义(P <0.05); 与shZFPM2-AS1组相比具有统计学意义(P <0.05)
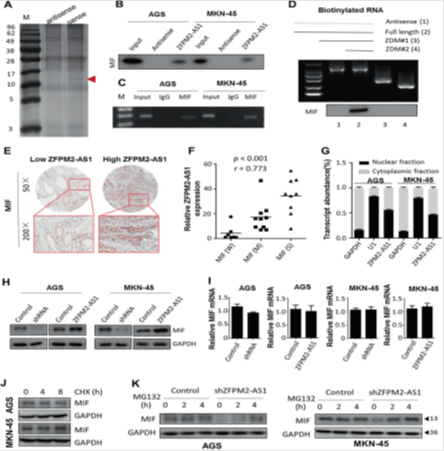
图5. ZFPM2-AS1与MIF结合并增加MIF表达。
(a)带有银染色的SDS-PAGE分析显示来自AGS细胞的免疫沉淀蛋白被ZFPM2-AS1或其反义RNA拉下。箭头表示随后可能切除用于质谱分析的ZFPM2-AS1结合蛋白。 (b)生物素化的ZFPM2-AS1或反义RNA与AGS和MKN-45细胞的全细胞蛋白裂解物在另一种RNA pull-down测定中一起孵育。使用特异性MIF抗体通过蛋白质印迹检测MIF蛋白。(c)RIP实验确定了MIF和ZFPM2-AS1的相互作用。(d)用不同的ZFPM2-AS1片段拉下AGS细胞的免疫印迹。 (e)在胃癌标本中具有高或低ZFPM2-AS1表达的MIF蛋白表达的代表性免疫组织化学图像(n = 26)。(f)使用Spearman相关系数分析(n = 26)评估ZFPM2-AS1和MIF蛋白表达之间的直接相关性。分别检测ZFPM2-AS1的表达和每种胃癌标本中MIF蛋白的免疫组织化学评分。 W弱,M中等,S强。 (g)通过RT-qPCR分析ZFPM2-AS1在AGS和MKN-45细胞裂解物中的细胞内分布。 GAPDH和U6用作内部对照。 (h)在AGS和MKN-45细胞中ZFPM2-AS1表达降低或增加后,MIF表达的Western印迹。(i)qRT-PCR结果证明ZFPM2-AS1的过表达和敲除不影响胃癌细胞中的MIF mRNA表达水平。(j)用40μg/ mL CHX处理指定时间的AGS和MKN-45细胞中MIF的Western印迹。 (k)Western印迹显示蛋白酶体抑制剂MG132在有或没有shZFPM2-AS1处理48小时的条件下对胃癌细胞中MIF表达的影响
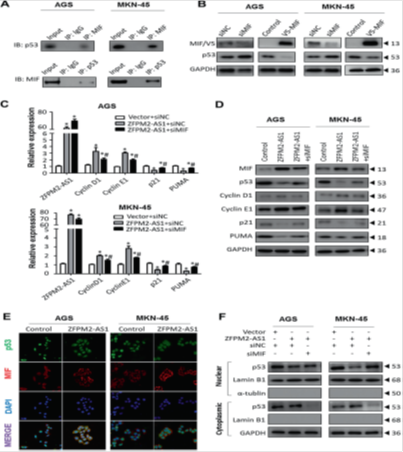
图6. ZFPM2-AS1 / MIF轴通过减弱p53信号传导促进胃癌细胞增殖并抑制其凋亡。
(a)使用抗-MLF抗体或用抗-p53抗体进行对照IgG对AGS和MKN-45细胞提取物的蛋白质印迹进行共免疫沉淀(IP)。使用抗p53和-IgG抗体进行相互的共-IP,然后用抗MIF抗体进行蛋白质印迹。(b)在MIF表达降低或增加后,AGS和MKN-45细胞中p53表达的Western印迹分析。(c,d)qRT-PCR(c)和蛋白质印迹(d)分析结果证明ZFPM2-AS1以MIF依赖性方式调节p53途径。检测了所示组中p53靶向细胞周期蛋白D1,细胞周期蛋白E1,p21和PUMA的mRNA和蛋白质表达。 GAPDH用作加载对照。 siMIF MIF特异性siRNA。 * P <0.05用于“vector + siNC”和“ZFPM2-AS1 + siNC”之间的比较; #P <0.05用于“ZFPM2-AS1 + siNC”和“ZFPM2-AS1 + siMIF”之间的比较。 (e)用ZFPM2-AS1过表达载体转染AGS和MKN-45细胞的免疫荧光染色,体外培养48小时,p53(绿色),MIF(红色)和细胞核(4',6-二咪啶-2-苯基吲哚)蓝色)。将ZFPM2-AS1用50nM siMIF或对照siRNA(siNC)共转染到AGS和MKN-45细胞中48小时。 Western印迹显示ZFPM2-AS1通过激活MIF表达抑制p53的核转位






