新机制—CAF外泌体调节胃癌细胞铁死亡
铁死亡是一种新的非凋亡性细胞死亡方式,由铁依赖性的脂质过氧化物的积累引起。肿瘤相关成纤维细胞(CAFs)通过分泌多种生物活性物质支持肿瘤的进展和耐药性。然而,CAFs在调节肿瘤细胞脂质代谢和铁死亡中的作用仍然是未知的。接下来,小编为大家讲解发表于“Molecular Cancer”上的文章“CAF secreted miR-522 suppressesferroptosis and promotes acquired chemo-resistance in gastric cancer”。

在本研究中,我们应用质谱技术筛选胃癌中铁死亡相关基因,超离心法分离外泌体,RT-qPCR法检测CAF分泌的miRNAs。以Erastin诱导铁死亡,通过测定脂质ROS、细胞活力和线粒体膜电位来评价铁死亡程度。
结 果:
1)GC中与铁死亡相关的关键基因的筛选
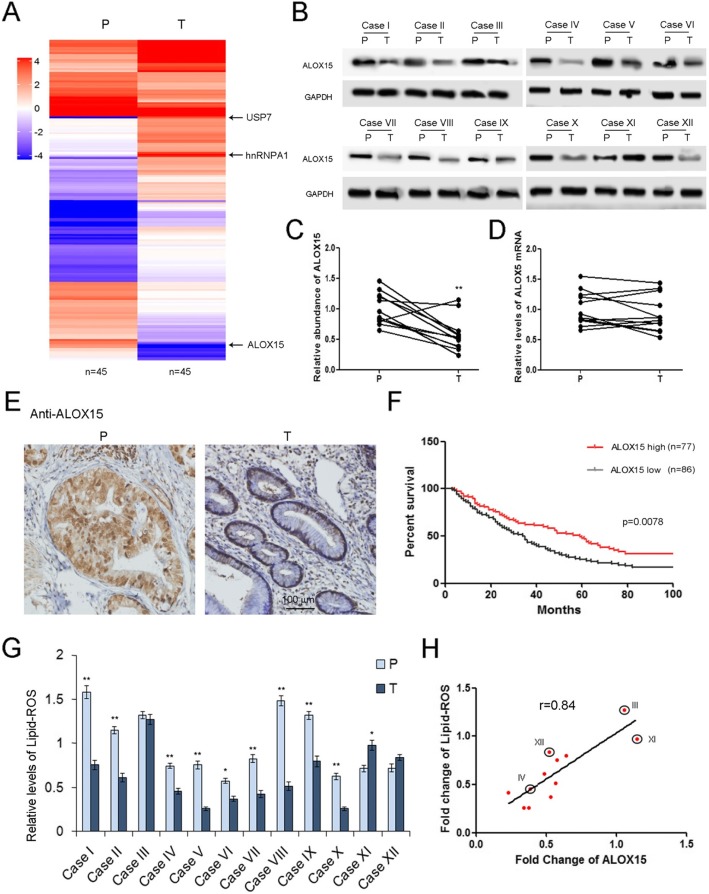
我们首先用质谱法比较了GC特异性蛋白,发现GC肿瘤组织(T)中的一组蛋白表达明显低于癌旁组织(P)。ALOX15是导致铁死亡的关键基因之一,呈急剧下降趋势,而肿瘤组织中USP7和hnRNPA1的水平明显升高(图1a)。随后,测定ALOX15蛋白和mRNA。ALXO15蛋白总体呈下降趋势,但ALOX15mRNA无明显变化(图1b-d)。我们还通过IHC检测了ALOX15的分布,ALOX15主要在癌旁组织的腺体细胞中表达,少量在腺瘤细胞中表达(图1e)。根据ALOX15蛋白水平的平均值,将GC患者分为ALOX15高组和ALOX15低组。高水平的ALOX15蛋白与胃癌患者的总生存率(OS)有更好的相关性(图1f)。脂质ROS是ALOX15产生的一种重要代谢物。在肿瘤组织中脂质ROS的水平明显降低(图1g),并且与ALOX15呈正相关(图1h)。这些数据表明,ALOX15在调节胃肿瘤脂质活性氧生成中起着关键作用。
2)外泌体miR-522主要来源于肿瘤微环境中的CAFs
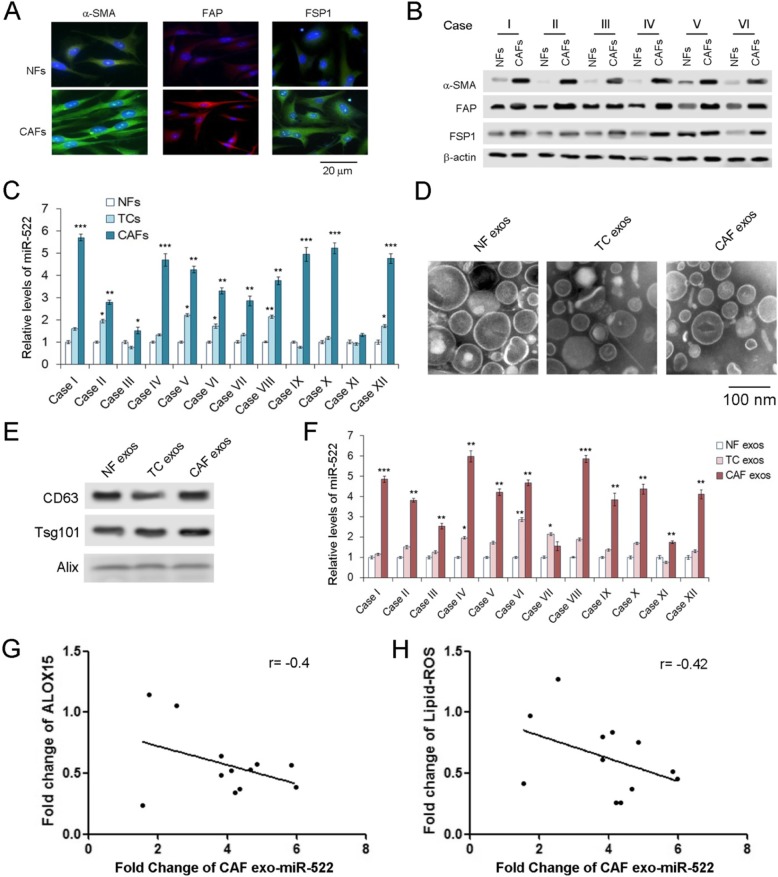
虽然我们已经证明miR-522在GC中明显上调,但是miR-522的起源仍然不清楚。分离癌组织中CAFs和癌旁正常成纤维细胞(NFs),检测原代细胞和外泌体miR-522水平。与NFs相比,CAFs中CAFs、α-SMA、FAP和FSP1的标记物均明显增加(图2a和b)。与肿瘤细胞和NFs相比,CAFs中miR-522的浓度最高(图2c)。NFs、TCs和CAFs的外泌体按上述方法分离并拍摄(图2d),外泌体的标记物通过WB分析检测(图2e)。miR-522在CAF外泌体中的含量最高,其次是TC外泌体(图2f)。正如预期的那样,来自CAFs的外泌体miR-522也与ALOX15和脂质ROS呈负相关(图2g和h)。这些数据表明,GC肿瘤微环境中的exo-miR-522主要由CAFs分泌。
3)CAFs分泌的exo-miR-522抑制GC细胞的铁死亡
为探讨CAFs来源的exo-miR-522对胃癌细胞铁死亡的调节作用,分离CAF外泌体并与人胃癌细胞株共培养。SGC7901细胞、MGC803细胞和MKN45细胞分泌的外泌体照片如图3a所示,这些外泌体还含有CD63、TSG101和Alix(图3b)。CAFs中miR-522的含量是GC细胞株的6倍,在外泌体中也有同样的趋势(图3c)。CAF外泌体与GC细胞共培养,6h时在SGC7901细胞和MKN45细胞中均检测到PKH-26 标记的CAF外泌体(图3d),表明CAFs来源的外泌体能与GC细胞有效融合。CAFs外泌体显著抑制了GC细胞中ALOX15的表达(图3e-g)。此外,exo-miR-522被证明能有效抑制erastin诱导的GC细胞脂质ROS积聚和铁死亡(图3h,3i)。erastin处理的SGC7901细胞线粒体膜电位明显升高(图3j),CAF外泌体部分逆转了erastin对线粒体的损伤(图3k)。总之,CAFs分泌的外泌体miR-522抑制ALOX15的表达,下调GC细胞的铁死亡水平。

4)USP7通过稳定hnRNPA1促进miR-522的分泌
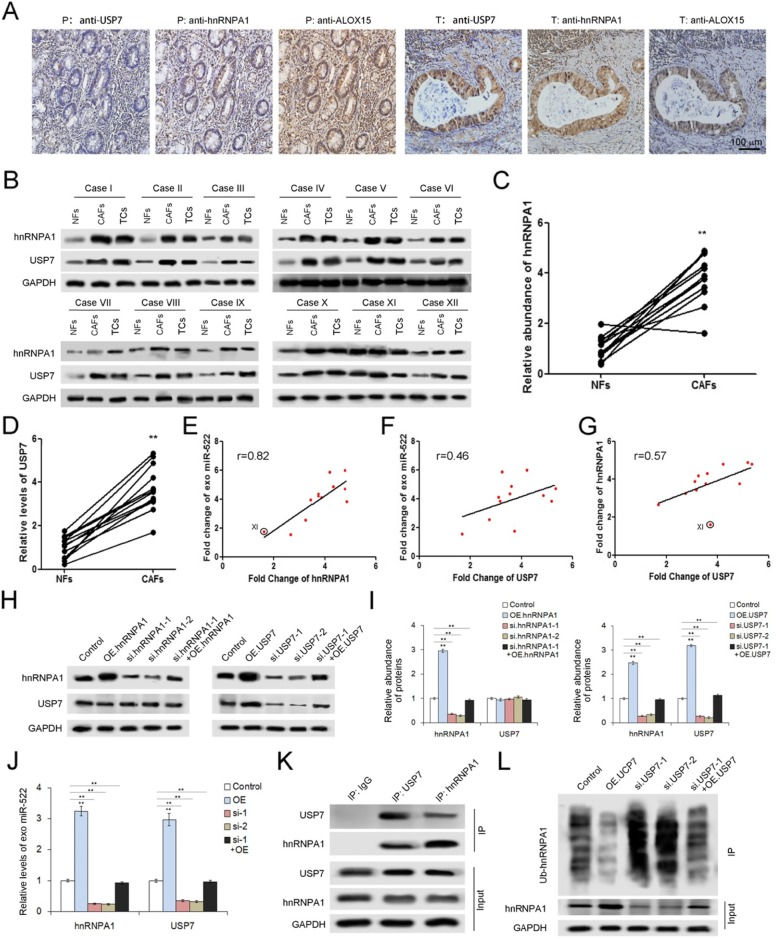
在目前的研究中,hnRNPA1在胃肿瘤组织中上调。IHC分析显示了USP7、HNNPA1和ALOX15之间的相关性(图4a)。接下来,我们检测发现上述12种肿瘤组织的hnRNPA1和USP7在CAFs中高表达(图4b-d)。此外,hnRNPA1和USP7水平与外泌体miR-522呈正相关(图4e,4f),提示USP7和hnRNPA1参与CAFs miR-522分泌。此外,与去泛素相关的USP7在增加HRNPA1水平方面起着重要作用(图4g)。
为了进一步研究USP7、hnRNPA1和miR-522之间的内在联系,我们构建了包含hnRNPA1和USP7编码序列的质粒以及两个基因的siRNAs。质粒的转染显著上调了hnRNPA1和USP7的表达,而siRNAs的应用导致了这两个基因的显著减少(图4h,4i)。在CAFs中,hnRNPA1或USP7的过表达促进外泌体miR-522的表达;然而,这两个基因的敲除相对降低了外泌体miR-522的水平(图4j)。拯救实验表明,过表达的hnRNPA1或USP7部分中和了各自siRNAs对exo-miR-522的影响(图4h-j)。接下来,在免疫沉淀法的产物中,可以使用抗hnRNPA1抗体检测USP7,反之亦然(图4k)。此外,USP7与HRNA1泛素化水平之间呈负相关(图4l)。总之,这些结果表明USP7通过去泛素化稳定了CAFs中的hnRNPA1,从而增强了外泌体miR-522的分泌。
5)hnRNPA1直接介导CAF中外泌体miR-522
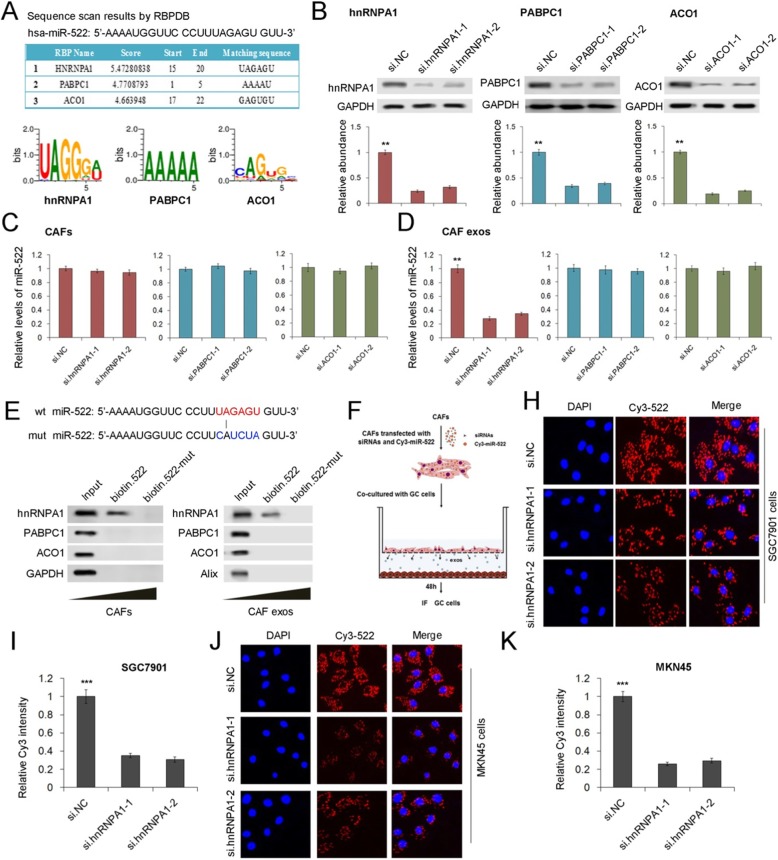
为了进一步验证hnRNPA1选择性地将miR-522包装成外泌体中的作用,我们利用RBPDB预测了miR522结合蛋白的表达。图5a显示了前三个RNA结合蛋白,hnRNPA1得分最高。我们设计了PABPC1和ACO1 siRNAs,PABPC1和ACO1明显被siRNAs敲除(图5b)。这些siRNAs的转染对CAFs中miR-522的表达几乎没有影响(图5c),但是hnRNPA1的下调显著降低了CAF外泌体miR-522的水平(图5d)。用生物素标记野生型和突变miR-522,转染CAFs。结果表明,在使用野生型生物素miR-522产生co-IP时,只检测到hnRNPA1(图5e)。另外,Cy3标记的miR522被转染到CAFs中,来自CAFs的外泌体通过细胞膜与较低的GC细胞融合。Cys-miR-522在SGC7901细胞和MKN45细胞中均能清楚地被检测到,并且在CAFs中hnRNPA1的沉默阻止了Cys-miR-522从CAFs向GC细胞的转移(图5h-k)。这些数据表明hnRNPA1在miR-522进入CAF外泌体的过程中起着重要的中介作用。
6)化学毒性通过激活USP7/hnRNPA1途径促进CAFs分泌miR-522
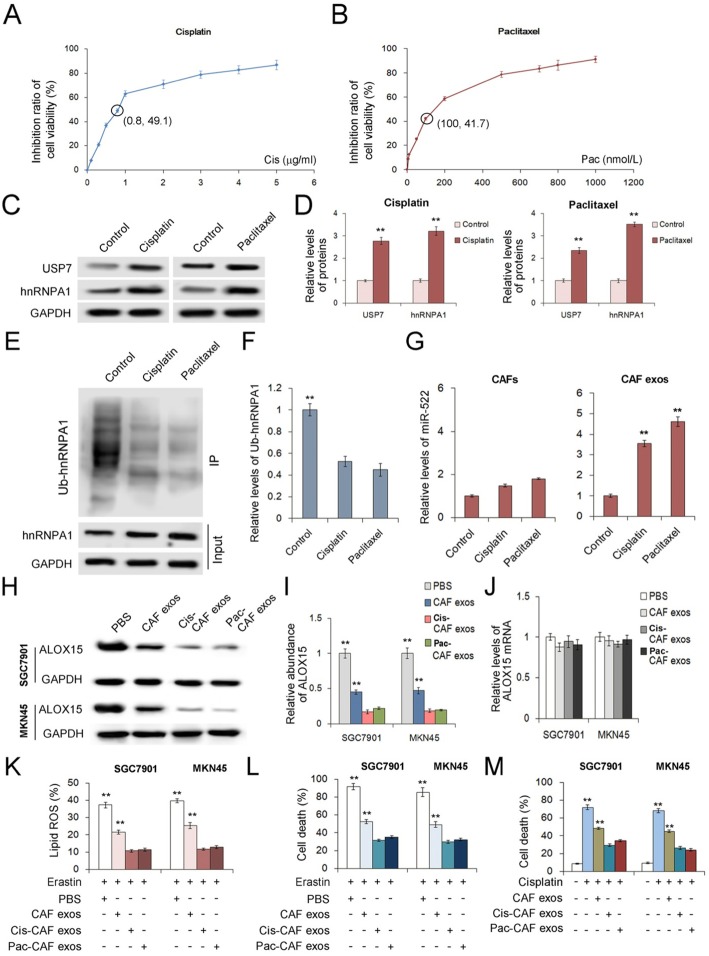
为了获得CAFs化疗诱导的损伤反应,我们检测了用亚致死剂量顺铂或紫杉醇治疗的GC细胞。顺铂和紫杉醇对CAFs细胞活力的抑制作用如图6a,6b所示。选用8μg/mL顺铂和100 nmol/L紫杉醇作为CAFs的亚致死剂量。结果表明,顺铂或紫杉醇均能促进CAFs中USP7和hnRNPA1的表达(图6c和d);化疗毒性也增强了hnRNPA1的去泛素化(图6e和f),从而导致miR-522在外泌体中的表达上调,而对原发性CAFs中miR-522的表达无明显影响(图6g)。这一结果表明,化疗通过增加USP7的表达和减少hnRNPA1的泛素化,促进外泌体miR-522分泌。
从经顺铂或紫杉醇处理的CAF中分离的外泌体与GC细胞共培养结果看,它们显示出比对照CAF外泌体更大的抑制ALOX15蛋白表达的能力,而不影响ALOX15转录(图6h-j)。在SGC7901和MKN45细胞中,顺铂处理的CAF外泌体和紫杉醇处理的CAF外泌体均能更有效地减少脂质ROS的产生并抑制erastin诱导的铁死亡(图6k,6l)。在培养基中加入顺铂可导致GC细胞的高死亡率,而顺铂处理的CAF外泌体和紫杉醇处理的CAF外泌体可降低GC细胞的死亡率(图6m)。这些体外实验为CAF外泌体在化疗过程中降低药物敏感性提供了证据。
7)USP7/hnRNPA1/miR-522对胃癌生长及化疗敏感性的体内调节作用
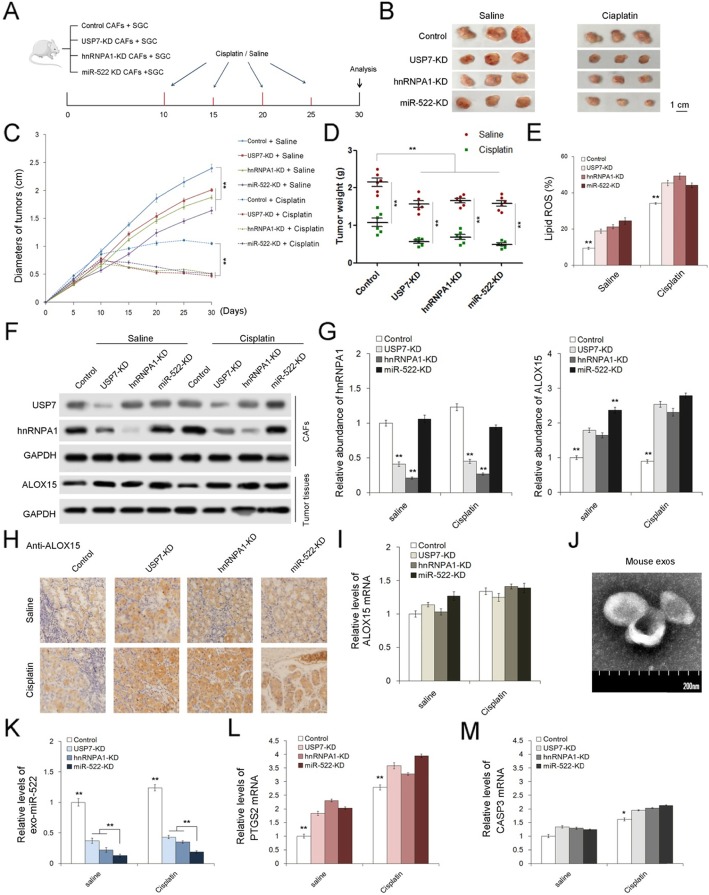
在体内评价USP7/hnRNPA1/miR-522轴对肿瘤生长和化疗疗效的影响。我们用含有shRNAs的慢病毒分别产生了三株敲除USP7、hnRNPA1和miR-522的胃成纤维细胞株,并将这些成纤维细胞株与SGC7901细胞混合用于小鼠皮下肿瘤移植(图7a)。从第10天开始,每5天给这些荷瘤小鼠注射顺铂或生理盐水,第30天取出肿瘤。CAFs中USP7、hnRNPA1或miR-522的敲除明显抑制肿瘤生长,增强对顺铂的敏感性(图7b-d),但肿瘤中脂质ROS水平上调(图7e)。另外,USP7的敲除降低了hnRNPA1蛋白水平;CAF中三个基因的抑制导致癌细胞中ALOX15的上调(图7f-h)。此外,顺铂的治疗相对促进了CAFs中USP7/hnRNPA1和癌细胞中ALOX15的表达(图7f-h),但ALOX15的mRNA变化不大(图7i)。从这些小鼠中分离出血浆外泌体(图7j),外泌体miR-522在USP7-KD和hnRNPA1-KD组中水平急剧下降,在miR-522-KD组中最低(图7k)。细胞凋亡标志物CASP3在CAFs中随USP7、hnRNPA1和miR-522基因敲除而略有升高(图7l-m)。综上所述,这些结果表明USP7/hnRNPA1促进CAFs分泌exo-miR-522,降低肿瘤中脂质ROS水平,促进肿瘤生长。此外,通过阻断miR-522的分泌,可以提高化疗药物的疗效。
8)USP7/hnRNPA1/exo-miR-522通路对肿瘤移植小鼠生存的影响
USP7、hnRNPA1和miR522的抑制延长了荷瘤小鼠的生存期(图8a),而顺铂组小鼠的存活率高于生理盐水组(图8b)。最后,我们提供了一个示意图来说明跨细胞信号通路在调控GC细胞铁依赖性中的生物学作用,包括USP7、HRNPA1、exo-miR-522和ALOX15(图8c)。

结 论:
CAFs通过靶向ALOX15和阻断脂质ROS的积累,分泌外泌体miR-522抑制癌细胞的铁死亡。由USP7、hnRNPA1、exo-miR-522和ALOX15组成的细胞间通路揭示了GC中获得性耐药的新机制。






